挛缩肢体深筋膜中Ⅰ型胶原的表达
2018-12-03薛书生赵凤朝
薛书生,笪 虎,吴 琪,赵凤朝
0 引 言
肢体骨折后,骨折断端常发生重叠,肢体短缩。如不能早期恢复肢体的长度,患肢活动受限,肌肉组织受到张力变小,易出现制动性挛缩。经过一段时间后,行二期手术时,术中肢体将不易牵拉、延展,影响骨折断端的复位及术后肢体功能恢复[1]。为了恢复骨折处正常对位关系,术者常需要做广泛软组织的松解,如骨膜剥离等。骨骼的血供受到破坏,常引起骨折愈合延迟甚至骨不连等后果[2]。在皮肤、肌肉、肌腱、筋膜等组织中,Ⅰ型胶原蛋白是最主要的胶原蛋白,其直径粗大、具有较强的抗张能力[3-4]。故我们推测软组织不易被拉伸,应与Ⅰ型胶原蛋白表达的改变有密切关系。本研究选取兔后肢股部的深筋膜组织为研究对象,通过研究挛缩肌肉组织的深筋膜表达Ⅰ型胶原的变化,来分析挛缩的肌肉延展性变差的原因,为肢体骨折二期手术前行牵引、维持肢体长度的处理,提供理论依据。
1 材料与方法
1.1材料24月龄以上健康新西兰大白兔40只,雌雄不限,体重2.0~2.5 kg,均由南京青龙山动物繁育场提供[实验动物许可证号:SCXK(苏)2017-0011];戊巴比妥钠(上海恒瑞医药有限公司);四甲基联苯胺(DAB)试剂盒(上海基因生物工程有限公司);兔抗兔单抗、辣根过氧化酶标记羊抗兔IgG(上海远慕生物科技有限公司);总RNA提取(TRIzol)试剂(omga公司,美国);DNA酶消化试剂盒、反转录酶试剂盒(TaKaRa公司,日本);荧光定量PCR分析仪(Applied-Biosytems,美国);苦味酸饱和水溶液(1.22%)(上海远慕生物科技有限公司);天狼猩红(Sirius Red,中国国药集团化学试剂有限公司);偏振光显微镜(Nikon Eclipse 80i )、OLYMPUS CX41 显微镜、CANON DS16275 数码相机。
1.2方法
1.2.1兔股骨重叠骨折模型的制作将每只兔的右后肢分配至实验组,左后肢分配至对照组。肌注麻醉兔后,人为折断右侧股骨干中段,使之完全性骨折。由于肌肉的收缩,骨折断端自动处于重叠短缩状态。兔麻醉清醒后,置于笼内自由活动。实验对动物的处理方法符合国家科学技术部颁发的《关于善待实验动物的指导性意见》[5]。
1.2.2深筋膜组织的取材于兔股骨骨折后1个月和2个月,各自随机选取20只兔子。耳缘静脉注射空气处死后,迅速切取双后肢股部外侧中段深筋膜。
1.2.3深筋膜组织的苦味酸天狼猩红染色将切取的标本立即置于10%甲醛固定24 h后,石蜡包埋、切片,切片厚约4 μm,继而脱蜡至水,浸染于苦味酸天狼猩红溶液1 h。水洗后苏木精复染核,脱水、透明、封片,于偏振光显微镜下观察。
1.2.4SP法免疫组化检测筋膜组织中Ⅰ型胶原表达将切片脱蜡至水,PBS冲洗3 min×3次。用稀释后的高pH脱蜡抗原修复液修复后,PBS冲洗。3%H2O2去离子水孵育10 min,PBS冲洗。滴加山羊血清工作液,室温下孵育15 min,吸去多余液体。滴加1∶100兔源抗兔Ⅰ型胶原抗体,孵育60 min。PBS冲洗5 min×3次,滴加生物素标记山羊抗兔IgG,37 ℃孵育30 min。PBS冲洗后,滴加辣根过氧化酶标记链霉素卵白素工作液,37 ℃孵育10 min。PBS冲洗后,以DAB显色剂显色。水冼后,复染、脱水、透明、封片。切片在显微镜下观察,见Ⅰ型胶原免疫阳性产物为棕黄色颗粒,位于深筋膜细胞膜外。每张切片内任选5个视野(800×),采用EMAL200真彩图像分析系统对免疫组化阳性染色强度进行半定量分析,测量每张切片阳性染色的平均灰度值。
1.2.5Westernblot方法检测Ⅰ型胶原表达2组各取20份骨折后1个月和2个月的新鲜后肢股部中段外侧深筋膜,共80份,每份质量约10 mg左右。经蛋白裂解液裂解后,提取组织总蛋白。然后加入上缓冲液,100 ℃煮沸30 min。采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶分离电泳(PAGE),再将蛋白质转到聚偏氟乙烯(PVDF)膜上,使用封闭液封闭过夜。室温下,使用兔抗兔一抗孵育2 h, TBST清洗3次;羊抗兔二抗孵育2 h,TBST清洗3次。最后,利用ECL显色,曝光。采用ImageQuant TL图像分析系统测定Western blot条带A值,并与内参照β-actin的测定值进行比较,计算A比值,进行半定量分析。
1.2.6RT-PCR法检测Ⅰ型胶原的mRNA表达将2组各40份质量约10 mg左右的新鲜兔后肢股部深筋膜在冰上的低温条件下进行研磨,然后分别加入0.5 mL TRIzol试剂,按TRLzol试剂说明书进行RNA的提取。cDNA合成参照反转录试剂盒说明书进行。产物存于-20 ℃备用。检索NCBI GenBank数据库中Ⅰ型胶原全长mRNA序列,应用Primier 5.0软件,委托TaKaRa宝生物工程(大连)股份有限公司合成Ⅰ型胶原基因以及内参GAPDH基因的上下游引物,引物序列为GAPDH(正向: 5′-TCACCATCTTCCAGGAGCGA-3′,下游:5′-CACAATGCCGAAGTGGTCGT-3′);Ⅰ型胶原蛋白引物正向: 上游: 5′-GGTTACGACTTTGGTTATGA-3′,下游: 5′-GGAGGGTCTCAATCTGGTTG-3′)[6]。并用NCBI中的Blast程序进行核酸序列相似性比较和引物特异性分析取反转录产物cDNA 1 μL为模板,采用(大连宝生物公司) 2×SYBR Premix DimerEvaser建立反应体系,将各反应管放入荧光定量PCR仪,按下列条件扩增:95 ℃ 30 s,然后40个循环按95 ℃ 5 s,60 ℃ 30 s,读板,以GADPH作为内参照,用Light Cycler Software Ver. 4.0分析目的基因的相对表达水平。

2 结 果
2.1深筋膜组织的天狼猩红染色深筋膜组织经天狼猩红染色后,在偏振光显微镜下观察,见深筋膜组织内的细胞外基质中Ⅰ型胶原呈鲜艳的猩红色,有较强的双折射光。对照组的Ⅰ型胶原纤维束有明显的定向性,密度稍大、形态偏长,而实验组的定向性较差,密度稍小、形态较短。见图1。实验组骨折后1个月和2个月的Ⅰ型胶原纤维长度均明显小于对照组(P<0.01),见表1。
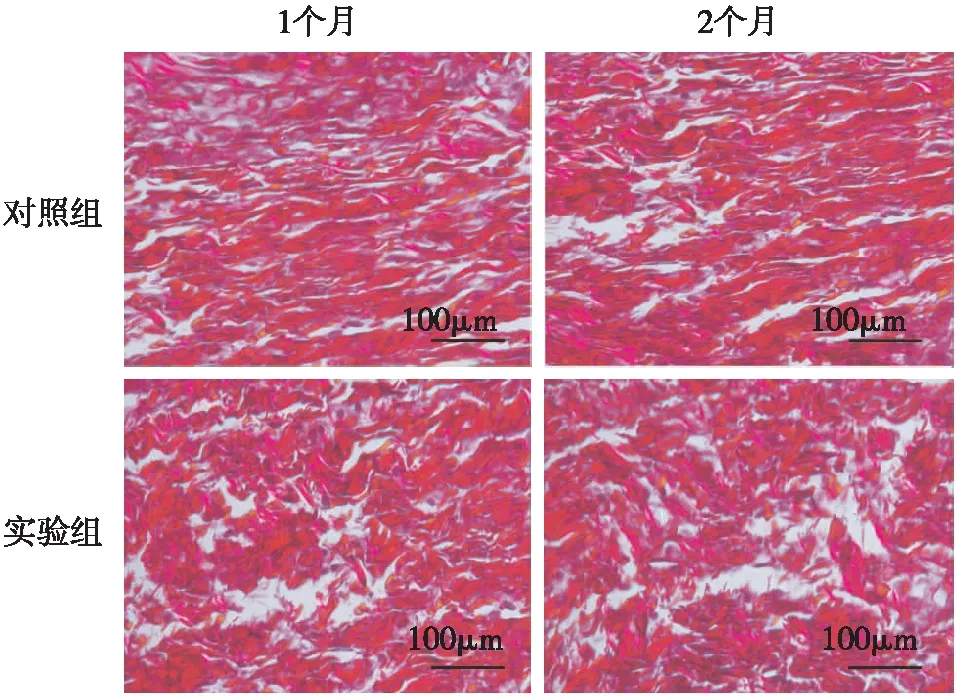
图1 镜下观察骨折后兔深筋膜内Ⅰ型胶原纤维表达(天狼猩红染色 ×400)
2.2深筋膜组织的Ⅰ型胶原蛋白免疫组化染色深筋膜组织的切片经Ⅰ型胶原免疫组化染色后,在显微镜下观察,见细胞内和细胞外的中Ⅰ型胶原蛋白呈棕黄色,实验组的棕黄色染色明显浅于对照组,见图2。实验组骨折后1个月和2个月深筋膜Ⅰ型胶原蛋白免疫组化染色所产生的棕黄色的平均灰度值均明显高于对照组(P<0.05),见图3。


组别n不同时间Ⅰ型胶原纤维长度1个月2个月对照组2081.7±13.483.5±14.6实验组2058.3±18.551.1±16.2t值2.52.9P值<0.01<0.01
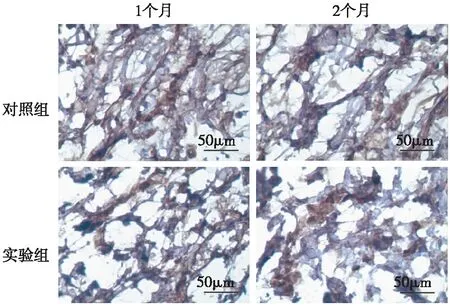
图2 骨折后兔深筋膜内Ⅰ型胶原蛋白表达(免疫组化染色 ×800)
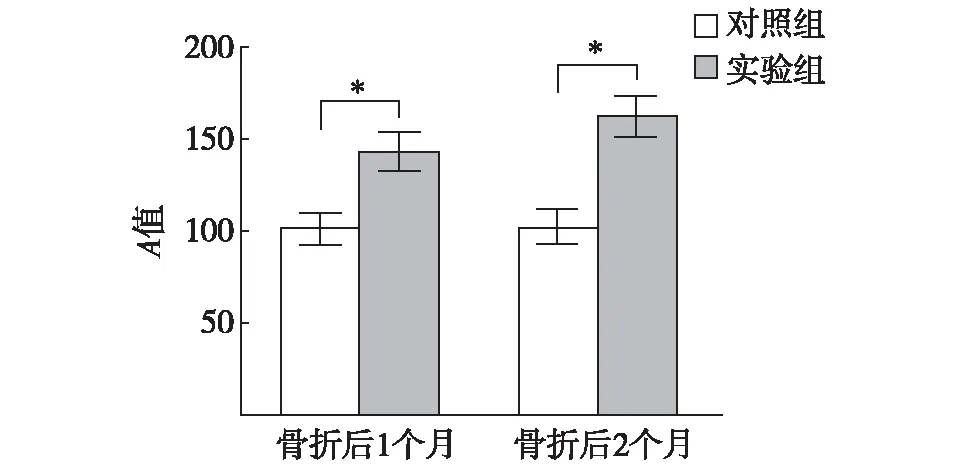
与对照组比较,*P<0.05图3 骨折后不同时间兔深筋膜Ⅰ型胶原免疫组化染色灰度值比较
2.3Westernblot检测Ⅰ型胶原的表达实验组骨折后1个月和2个月深筋膜组织中Ⅰ型胶原的表达均显著低于对照组(P<0.05),见图4。
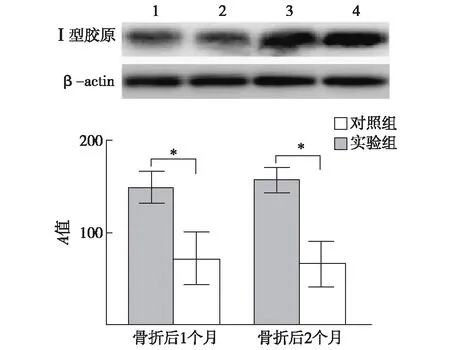
1、2:实验组术后1个月、2个月;3、4:对照组术后1个月、2个月与对照组比较,*P<0.05图4 Western blot法检测骨折后深筋膜内Ⅰ型胶原蛋白表达比较
2.4RT-PCR法检测深筋膜Ⅰ型胶原蛋白的mRNA表达RT-PCR结果显示,实验组骨折后1个月和2个月的Ⅰ型胶原蛋白mRNA的相对表达量均显著低于对照组(P<0.05),见图5。
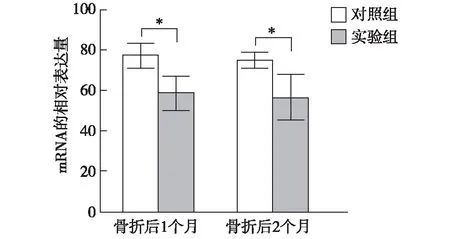
与对照组比较,*P<0.05图5 PCR法检测骨折后深筋膜内Ⅰ型胶原蛋白的mRNA的相对表达量比较
3 讨 论
胶原蛋白是由三条肽链拧成的螺旋形纤维状大分子蛋白质,作为一种细胞外基质广泛存在皮肤、肌腱、筋膜等组织中,由于这一长且坚韧的特殊构型,使这些组织富有弹性,在保持组织整体功能方面发挥着重要生物力学作用[7]。胶原蛋白是一个有多达十余种成员的蛋白质家族,其中Ⅰ型胶原蛋白含量最多,约占生物体胶原总量的90%。Ⅰ型胶原蛋白直径较为粗大,主要作用是吸收和传递应力,具有较强的抗张能力[8-9]。
在对发生四肢制动性挛缩的骨伤患者行Ⅱ期手术时,发现术中软组织抗拉伸能力增加,特别是深筋膜、肌膜、肌腱等纤维结缔组织发生挛缩、粘连,不易伸展,进而影响到骨折短缩畸形的矫正及术后肢体功能的恢复。由于Ⅰ型胶原蛋白是纤维结缔组织的最主要的抗张力蛋白,故本研究推测,发生制动性挛缩的肢体软组织抗拉伸能力增加,可能与肢体筋膜、肌膜、肌腱等组织的Ⅰ型胶原蛋白表达有着密切相关性。
在本研究中,我们选取兔后肢股部的深筋膜为研究对象,右侧股骨发生重叠、短缩性骨折。骨折1个月和2个月后,右后肢股部肌肉组织发生制动性挛缩。切取右后肢股部中段外侧深筋膜,并置于实验组,左后肢股部相应部位的深筋膜置于对照组。天狼猩红染色可见实验组的Ⅰ型胶原蛋白组成的纤维束定向性较差,并且长度变短。进行型胶原蛋白免疫组化染色,并用EMAL200真彩图像分析系统分析棕黄色的灰度值;采用Western blot法检测Ⅰ型胶原蛋白的表达;还采用RT-PCR法检测型胶原蛋白mRNA的表达。以上结果提示:无论在骨折后1个月还是2个月,实验组深筋膜的型胶原蛋白的量及其mRNA的表达均显著低于对照组(P<0.05),即挛缩的深筋膜表达型胶原蛋白明显减少。
本研究开始之前,我们认为由于Ⅰ型胶原蛋白具有较强的抗张能力,发生制动性挛缩的肌肉不易被拉伸时,Ⅰ型胶原蛋白表达应该增加,而结果却与我们之前的设想截然相反。出现这一个结果应该是由于制动导致肢体中Ⅰ型胶原蛋白分解代谢和合成失衡所造成的[10]。但这并未能对筋膜等软组织延展性能下降给出一个合理解释。经过仔细观察与分析,认为在实验前我们混淆了组织的延展性与刚性这两个概念。延展性,即韧性,是指组织受力时发生变形的能力;而刚性,即强度,是指组织在受力时抵抗变形的能力。
有研究表明,对于包括筋膜组织在内的任何弹性材料而言,“胡克定律”和“弹性模量(E)”均能够反映出其最基本的弹性行为方式[11]。在材料弹性限度内,其应力与应变成正比例关系,即胡克定律,其比值被称为材料的弹性模量(E)[12-13]。E=σ/ε,σ为应力,ε为应变。目前弹性模量作为软组织力学性能重要参数之一,已经得到较为广泛的研究和测量,例如足部肌肉及肌腱等组织[16-17]。有研究显示当皮肤等组织中胶原蛋白含量增加时组织的韧性也相应提高,反之,当组织中胶原蛋白含量减小时组织的韧性也下降[11,16]。有学者研究表明弹性体韧性与弹性模量(E)成负相关关系,韧性越大的组织拉伸弹性模量越小[17-18]。由于挛缩肢体筋膜等结缔组织中Ⅰ型胶原蛋白含量下降导致韧性下降,在韧性下降同时组织的拉伸弹性模量(E)增大。根据E=σ/ε公式,当收到相同应力σ(纵向牵引力)作用时,随着组织弹性模量(E)增大,发生应变量ε(拉伸长度)将变小。因此与新鲜骨折相比,当骨折肢体发生制动性挛缩时,由于胶原蛋白含量减少导致拉伸弹性模量变大,使得软组织难以牵拉、伸展。故而实验中得出的“Ⅰ型胶原蛋白表达下降”的结论,与临床上所见肌肉组织挛缩后延展性能下降的现象,是完全契合的。
发生制动性肌肉挛缩的骨伤患者,软组织延展性差,是多种因素共同作用的,包括皮肤、肌肉纤维、肌膜、肌内膜、肌腱组织的因素,还有其他组织成分表达改变的因素[19]。本研究只单纯检测了深筋膜组织中Ⅰ型胶原蛋白表达的改变,没有对作用力大小、组织拉伸度等具体量化,具有显著的局限性,是本研究不足之处,有待于我们进一步研究。
综上所述,肌肉组织在发生制动性萎缩时,由于Ⅰ型胶原蛋白的表达变小导致组织弹性模量增加,延展性下降,导致术中肌肉组织不易于被牵拉、伸展。这为临床工作中对于不能早期手术的肢体骨折患者,进行适当牵引,尽量维持肢体长度,减轻肢体挛缩程度,降低Ⅱ期手术难度和减小手术创伤提供了理论依据。
(致谢: 感谢解放军第八二医院王连丽老师以及南京总医院马恒辉、张明超老师对本实验提供的帮助。)
