SD大鼠肢体缺血-再灌注损伤模型的建立
2018-12-03朱付平潘成熙罗伟业周富强李武平
申 震,朱付平,潘成熙,罗伟业,周富强,李武平
(湖南中医药大学第一附属医院,长沙 410007)
缺血-再灌注(ischemia-reperfusion,IR)损伤是临床中一种常见的复杂的病理过程,是指缺血一段时间后,重新恢复血流,组织损伤程度反而进一步加重,器官功能进一步恶化的综合征[1]。IR主要影响O2依赖性器官,如肝脏、肾脏、心脏、脑、肠道以及骨骼肌等[2],多见于器官移植术、冠状动脉成形术、溶栓治疗以及挤压伤、四肢血管损伤、断肢再植、骨筋膜间室综合症等骨科疾病[3 - 4]。相较于其他器官,骨骼肌研究较少,但骨骼肌对缺血却十分敏感[5],文献报道[6],缺血时间超过2.5 h血流再通就会导致肢体缺血-再灌注损伤(limb ischemia-reperfusion injury,LIRI),尤其是线粒体等重要代谢细胞器会发生不可逆转的病理改变。近年来,由骨骼肌缺血复灌导致的LIRI的发病率、致残率乃至病死率呈逐年上升的趋势,若没有进行及时有效的治疗,对患者的损害程度极大,严重者引发远隔脏器损伤[7 - 8],甚至诱发全身炎症反应综合征或多器官功能不全综合征,给患者个人及社会带来沉重的负担[9]。故而,构建LIRI模型并研究LIRI发病机制以及防治要点具有重要的现实意义。
然而,当前LIRI模型的构建方法主要是通用无创血管夹夹闭或无创缝合线结扎股动脉进行缺血再灌注操作[10]。这种方式对动物损伤较大,无菌条件要求高,操作精细复杂,耗时较长,且易出现切口感染,误伤神经血管等问题,成功率较低。鉴于以上因素,本研究改良而成一种应用于SD大鼠LIRI模型的构建方法,并进行骨骼肌组织形态学等相关检测,以评价模型的可靠性,现介绍如下。
1 材料和方法
1.1 实验动物
本实验选用15只2月龄SPF级SD雄性大鼠,体质量(232.50±6.00) g,各组间比较差异无显著性(P> 0.05),购自湖南斯莱克景达实验动物有限公司[SCXK (湘) 2013-0004],饲养及实验操作在湖南中医药大学动物实验研究中心[SYXK (湘) 2013-0005],实验室温度20℃~24℃,相对湿度60%~70%。实验动物予以常规饲料喂养,自由饮水。本实验严格遵守国家实验动物福利伦理相关规定,科研项目伦理审查意见号:HN-LL-GZR-201609,实验中对动物处置符合科技部颁行的《关于善待实验动物的指导性意见》,满足动物保护、动物福利以及伦理原则的相关要求,严格遵守动物使用的3R原则。
1.2 主要试剂与仪器
苏木素-伊红染色(HE)液(广州,凯秀贸易有限公司);4,6-联脒-2-苯基吲哚(DAPI,美国,Sigma公司);戊巴比妥钠(美国,Sigma公司)。市售统一规格橡皮圈,尼龙扎带,50 mL注射器;BX51型正置荧光显微镜(日本,Olympus公司)。
1.3 实验方法
SD大鼠按照随机数字表法随机分为正常组,缺血再灌注0 h组、2 h组、4 h组以及8 h组5个组,每组3只。所有SD大鼠术前禁食禁饮12 h,3%戊巴比妥钠(1.5 mL/kg)腹腔注射麻醉。正常组大鼠不阻断血流,缺血再灌注0 h组、2 h组、4 h组以及8 h组各组大鼠采用50 mL注射器自制成套管及市售统一规格橡皮圈复制SD大鼠右后肢缺血-再灌注损伤模型。既要达到阻断血流目的,又要避免橡皮圈对骨骼肌的直接损伤,经摸索实验选取直径0.8 cm和1.0 cm橡皮圈各一个,并将橡皮圈套在大鼠大腿根部,并用尼龙扎带系在橡皮圈下阻挡橡皮圈向下滑动,尼龙扎带不对骨骼肌产生压力,当大鼠趾掌变得苍白青紫、发凉,即是股动脉血流被成功阻断,大鼠趾掌由暗紫色又转为粉红色则为恢复血流灌注。具体步骤如下:
①制备长度为2 cm,内径为2 cm的塑料套管,外覆软布圈(以防压力集中使肌肉断裂),将直径0.8 cm和1.0 cm橡皮圈各一个紧密套在塑料管上;
②由助手将大鼠固定牢靠,将大鼠右后肢充分套入上述制备完毕的塑料管内(使橡皮圈能从大腿根部阻断血流),然后拉动软布圈使其带动其上的多个橡皮圈一起退至大鼠右后肢大腿根部,橡皮圈因弹性回缩压迫股动脉而阻断右后肢的血流(阻断大鼠后肢血流的标志是趾掌变得苍白青紫、发凉);
③大鼠右后肢阻断血流的时间为4 h以实现肢体处于缺血状态,然后依次于缺血后0 h、2 h、4 h和8 h用手术刀片分别切断橡皮圈,恢复血流灌注,构建缺血-再灌注损伤模型,并可轻柔按摩橡皮圈固定处以利于恢复血液的灌注(见图1),并依次于缺血后再灌注0 h、2 h、4 h和8 h四个时间点,在大鼠处于麻醉状态下采用颈椎脱臼法将其处死,收集腓肠肌,经4%多聚甲醛固定,石蜡包埋切片等操作后行HE染色和DAPI染色,光镜下观察腓肠肌组织结构的病理学变化。

注:a:造模所需元件及组装;b:阻断右后肢股动脉血流侧位图;c:阻断右后肢股动脉血运前后位图;d:维持缺血状态4 h,右侧趾掌变得苍白青紫、发凉。图1 大鼠肢体缺血-再灌注损伤模型操作示意图Note. a: Materials and assembly for the model; b: Blocking blood flow of the right femoral artery in the lateral position; c: Blocking blood flow of the right femoral artery in the anteroposterior position; d: Pale and cool paw on the right hind limb during the ischemic state for 4 hours.Figure 1 Operational diagram of the establishment of the rat LIRI model
2 结果
2.1 肢体骨骼肌大体形态观察
依次于缺血后再灌注0 h、2 h、4 h和8 h四个时间点处死大鼠,然后沿大鼠右后肢纵轴方向剪开皮肤,钝性分离皮肤软组织等浅筋膜,切掉深筋膜,暴露腓肠肌。正常组3只大鼠腓肠肌鲜活红润,肌组织结构轮廓清晰;与正常组比较,再灌注0 h组、2 h组、4 h组及8 h组共计12只大鼠(每组3只,没有未纳入分析的大鼠)右后肢腓肠肌均有不同程度肿胀、瘀青,肌组织结构模糊、暗淡,组织液化坏死等表现,而且随着时间的进展损伤逐渐加重(见图2)。
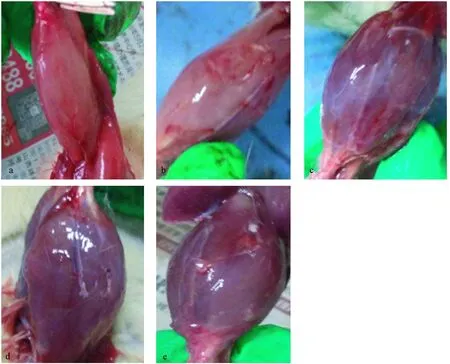
注:a:正常组;b:0 h组;c:2 h组;d:4 h组;e:8 h组。图2 后肢大体解剖形态观察图Note. a: Normal group; b: 0 h group; c: 2 h group; d:4 h group; e:8 h group.Figure 2 Gross appearance of the mouse hind limbs
2.2 HE染色结果
光镜下对各组腓肠肌进行形态学观察,正常组3只大鼠腓肠肌细胞轮廓正常,胞膜完整,肌纤维排列整齐,结构清晰(见图3a);与正常组相比,0 h、2 h、4 h和8 h组所有大鼠(每组3只,共计12只)右后肢腓肠肌肌纤维结构均出现异常,肌纤维排列紊乱、增粗、肿胀或部分肌纤维完整性、连续性遭到破坏,肌纤维变细、断裂或肌纤维间缝隙增宽,肌纤维间炎性浸润,但各组损伤程度不一,其中0 h组和2 h组损伤程度较轻,而4 h组和8 h组较严重;4 h与8 h两组正常骨骼肌细胞明显减少,变性或坏死的骨骼肌细胞明显增多(见图3b~3e)。

注:a:正常组;b:0 h组;c:2 h组;d:4 h组;e:8 h组。图3 腓肠肌染色形态光镜图(HE染色,× 200)Note. a: Normal group; b: 0 h group; c: 2 h group; d:4 h group; e:8 h group.Figure 3 Histology of the mouse gastrocnemius muscle. HE staining
2.3 DAPI染色结果
正常组3只大鼠腓肠肌细胞核呈圆形或椭圆形形状,边缘轮廓清晰,染色均匀(见图4a);除正常组外,其余4组所有大鼠(共计12只)右后肢腓肠肌细胞内均可见凋亡小体,即核碎裂成大小不等的圆形小体,并被细胞膜所包绕,细胞核边缘不规则(见图4b~4e),其中尤以4 h和8 h两组最为明显;此外,4 h组中3只大鼠和8 h组中3只大鼠的腓肠肌细胞着色较重,核出现浓缩、呈新月形聚集于核膜一边(见图4c~4d)。

注:a:正常组;b:0 h组;c:2 h组;d:4 h组;e:8 h组。红色箭头指示凋亡小体;黄色箭头指示核浓缩和新月形细胞核。图4 腓肠肌细胞核荧光染色图(DAPI染色,× 400)Note. a: Normal group; b: 0 h group; c: 2 h group; d:4 h group; e: 8 h group. Red arrowhead: apoptotic body; Yellow arrowhead: nuclear enrichment and crescent nucleus.Figure 4 Fluorescence images of cell nuclei of the gastrocnemius muscle. DAPI staining
3 讨论
Jennings等[11]于1960年在心肌的研究中最早提出了缺血-再灌注损伤概念。之后诸多实验证实缺血再灌注损伤也可在心、脑、肝、肾、骨骼肌等其他器官组织中发生。近些年,有关缺血-再灌注损伤模型的构建方法,在大鼠、小鼠、兔、猪等实验动物上均有报道,然而,无论是在常见的心、脑、肝、肾、肠道缺血-再灌注损伤模型[12 - 17]中,还是在骨骼肌缺血-再灌注损伤模型[18]中,大都均采用较为复杂的、开放有创的造模方法,即依次切开皮肤、皮下组织,显露动脉、静脉和神经,用显微器械分离动脉,通过无创血管夹夹闭或无创缝合线结扎相应的营养动脉造成器官缺血,然后放开血管夹或剪断缝合线,恢复阻断区血供诱发再灌注损伤。然而,这种切开皮肤软组织,游离营养血管再结扎的开放造模方法,操作精细复杂,耗时较长,不仅对实验人员造模技术要求较高,而且对实验动物损伤较大。此外,在造模过程中对无菌条件要求高,易出现切口感染,误伤神经血管等问题,造模成功率较低。
而本实验中所描述的LIRI模型是在张连元等[19]介绍的方法基础上,加入自制注射器套筒,精简步骤,细化操作,在大鼠体外闭合阻断股动脉血流诱发肢体缺血-再灌注损伤的一种方法。本造模方法血流阻断部位在股骨近端,而取材部位是胫腓骨后面的腓肠肌,故而避免橡皮圈对腓肠肌的直接损伤,腓肠肌结构形态上的异常变化应是由阻断股动脉血运再复灌血流而诱发骨骼肌发生缺血-再灌注损伤所导致。与当前采用较多的开放有创的造模方法相比,本方法具有简便、快捷、安全、可靠等优点。本方法在体外阻断股动脉,一方面实验人员无需进行系统、精细的外科操作培训,另一方面对无菌条件要求相对较低,且对大鼠本身损伤较小,避免了因切开皮肤软组织造模而产生的出血、感染、误伤血管和神经等问题,不仅可以降低风险,而且在保障造模质量的前提下,通过改进实验方法尽可能地减轻了对实验动物的损害,这正是善待实验动物、提高动物福利,遵循“减少、替代、优化”3R原则的具体体现。在本实验中,再灌注0 h、2 h、4 h和8 h四组骨骼肌均出现了不同程度肌纤维肿胀、炎性浸润、肌纤维排列不规则、变细、间隙增宽,甚至肌纤维断裂等异常情况,表明在缺血-再灌注过程中骨骼肌结构形态表现异常,骨骼肌出现不同程度损伤,其中4 h和8 h两组损伤程度较之0 h和2 h两组显著加重,且8 h组损伤程度最为严重,说明骨骼肌损伤随时间进展性加重,缺血时间拖延越久,骨骼肌损伤越严重,LIRI危害也就越大,这或许就是LIRI“早期、及时、全程”治疗思路的实验依据。此外,四组的骨骼肌细胞表现出典型的凋亡形态学特征,这与在LIRI过程中有细胞凋亡机制参与的论述相一致[20 - 21],表明在一定的病理条件下,如骨骼肌处于缺血缺氧环境中,骨骼肌细胞可以发生细胞凋亡现象,在LIRI过程中长时间的缺血缺氧状态导致了核细胞自身启动细胞内特定的程序诱发细胞自然死亡。凋亡的细胞体积则会整体缩小,细胞膜变得皱缩,或形成许多突起分割包裹胞质,亦或核体皱缩,染色体致密,形成凋亡小体,细胞核最终破裂、解体。
综合上述,本造模方法构建的模型符合LIRI损伤过程中骨骼肌的病理变化特点,与LIRI临床特征相似。且该模型操作简便、快捷、模型结果质量可靠,从而为系统研究LIRI的病因、发病机制及其预防和治疗,提供了一种接近临床、简便可控的动物建模方法。
