呋虫胺在我国稻田生态系统中的残留消解动态研究
2018-12-03蔡达夫徐钰哲杨丽华龚道新
蔡达夫,徐钰哲,熊 胜,杨丽华,龚道新*
(1湖南农业大学农业环境保护研究所,长沙410128;2湖南农业大学资源环境学院,长沙410128;3长沙市环境科学研究与信息中心,湖南长沙410001)
呋虫胺(dinotefuran)为新烟碱类杀虫剂,是第三代烟碱类杀虫剂,结构中不含卤素元素,其特征取代基为四氢呋喃甲基,取代了氯代吡啶基或氯代噻唑基等[1,2]。呋虫胺杀虫谱广,主要作用于昆虫神经传递系统,使害虫麻痹从而发挥杀虫作用[3,4]。目前,呋虫胺相关制剂广泛应用于防治水稻、蔬菜和水果上的各种害虫,如二化螟、稻飞虱、稻叶蝉等[5,6]。现在水稻上使用的呋虫胺制剂有可湿性粉剂、水分散粒剂、可溶液剂、颗粒剂和拌种剂及种子包衣剂等。
国内外对呋虫胺已有不少研究。张雯雯等[7]在QuEChERS方法基础上,建立了棉花和土壤中呋虫胺残留的超高效液相色谱—串联质谱快速检测分析方法,结果表明不同添加浓度的呋虫胺在棉花植株、棉籽和土壤中的平均回收率为80.9% ~107.5%,变异系数为3.3%~10.3%。彭莎等[8]采用高效液相色谱建立了测定水稻和稻田中呋虫胺残留量的分析方法,该方法快速简便,样品加标回收率为75.63%~106.02%,相对标准偏差为1.32%~10.24%。吴延灿等[9]建立了超高效液相色谱串联质谱检测蔬菜中呋虫胺及其代谢物DN、UF残留的方法,在3个添加浓度下,呋虫胺及其代谢物DN、UF在黄瓜、番茄、马铃薯、甘蓝4种基质中的添加回收率为72.0%~109.1%,相对标准偏差为1.4%~12.8%。但鲜有关于呋虫胺在整个稻田生态系统中的残留动态消解的研究。本研究较为系统地研究50%呋虫胺可溶粒剂在我国不同地区的水稻田施用后其有效成分呋虫胺在稻田水、稻田土壤和水稻植株中的残留消解动态。
1 材料与方法
1.1 试剂
50%呋虫胺可溶粒剂和呋虫胺标准品(纯度97.1%,青岛润生农化有限公司);纯净水[华润怡宝饮料(中国)有限公司];甲醇(色谱纯)、乙腈(分析纯)、氯化钠(分析纯)、无水硫酸钠(分析纯)(天津市恒兴化学试剂制造有限公司);乙酸(分析纯)、无水乙酸钠(分析纯)、无水 MgSO4(分析纯)、PSA(分析纯)、弗罗里硅土(0.15~0.25 mm)(国药集团化学试剂有限公司)。
1.2 仪器设备
Agilent Technologies 1260高效液相色谱仪(美国安捷伦科技有限公司);RE-2000旋转蒸发器(上海亚荣生化仪器厂);CCA-20低温冷却水循环泵、SHZ-DⅢ循环水式真空泵(巩义市予华仪器有限责任公司);SHY-2AS水浴恒温振荡器(上海智城分析仪器制造有限公司);XK80-A快速混匀器(江苏新康医疗器械有限公司);ID-5A台式多管架离心机(长沙英泰仪器有限责任公司);电子天平、布氏漏斗、分液漏斗等以及其它实验室常用仪器设备。
1.3 液相色谱检测条件
色谱柱:Agilent HC-C18(2)色谱柱(4.6 mm×250 mm,5μm);柱温:40℃;进样量:20μL;流动相:V(甲醇)∶V(水)=30∶70;流速采用梯度流速:0~7.5 min为 0.7 mL/min,7.5~8.0 min升至0.8 mL/min,之后一直保持 0.8 mL/min;检测波长:254 nm。
1.4 田间试验
1.4.1 试验设计与样品制备
2014~2015年在湖南长沙、浙江杭州、广西南宁、吉林长春4地同时进行消解动态和最终残留试验。按《农药残留试验准则》[10]设置试验小区,小区面积30 m2,重复3次,随机排列,小区间设保护带,另设对照小区。将50%呋虫胺可溶粒剂按180.0 g/hm2对水(2.7 kg/hm2)稀释,在水稻移栽后15 d左右(水稻分蘖期),茎叶喷雾施药1次。
水稻植株样本的采集与制备。在每个试验小区内,采用对角线法随机分别采集水稻植株样品,采样量不少于1 kg,切碎混均,四分法留样250 g左右,装入洁净的封口塑料袋中,贴好标签,贮存于-20℃冰柜中备用。小区边行和每行距离两端0.5m内不采样。
稻田水和稻田土壤样本的采集与制备。每个试验小区随机采集稻田水(每个小区不少于10个采样点,样品量不少于1 L),混合均匀后留取500 mL左右,盛在洁净的封口塑料瓶中备用。同时,随机选取10~12个采样点,用土钻采集稻田土壤(取样深度0~10 cm)1~2 kg,除去土壤中的碎石、杂草等杂物,混匀后采用四分法留样250 g左右,装入洁净的封口塑料袋中,贴好标签,贮存于 -20℃冰柜中备用。
1.4.2 气候条件及土壤类型
湖南长沙:属中亚热带季风湿热气候,多年平均气温16.8~17.3℃,年日照时数1610~1750 h,年平均无霜期280 d,年平均雾天26.4 d,多年平均降水量1483.6 mm,降水主要集中在4~7月。地带性土壤以红壤为主,还有黄壤、棕壤、草甸土、冲积土(河潮土)等。
浙江杭州:地处东部沿海,属亚热带季风气候,温和湿润、光照充足、雨量丰沛、四季分明。常年平均气温15.3℃,年降水量1350 mm。水稻试验地的土壤为小粉土(河潮土)。该试验地近几年未施用过呋虫胺及其他烟碱类杀虫剂,土壤质地为沙壤土,pH值6.6左右,有机质含量14.2 g/kg。
广西南宁:属湿润的亚热带季风气候,阳光充足,雨量充沛,霜少无雪,气候温暖,夏长冬短。南宁气温较高,年平均温度22℃左右,1月温度最低,平均温度13℃,平均最低温度10℃左右;7、8月最热,平均温度29℃左右,平均最高温度33℃。年均降水量1300 mm以上,平均相对湿度为79%。赤红壤是南宁有地带性特征的代表性土壤,水稻土是南宁市最重要的粮食生产用地。
吉林长春:气候类型属于温带大陆性季风气候,四季分明。春季少雨干燥,夏季温热多雨,秋季凉爽多晴,冬季漫长而寒冷。年平均气温3~5℃,气温受地形影响,由西、西北向东、东南逐渐降低。1月平均气温最低,为-18~-20℃,7月平均气温最高,为21~23℃,极端最高气温36.6℃。山区无霜期120 d,平原区可达130~140 d。全年降水量约700 mm。土壤主要是黑土,土壤表层有机质含量为30~60 g/kg。
1.5 呋虫胺的提取和净化
1.5.1 稻田水样品
准确量取稻田水样品20.0 mL,置于250 mL三角瓶中,加入20 mL乙腈,在30℃恒温条件下振荡提取30 min;移入250 mL分液漏斗中,加入5 g氯化钠,剧烈振摇2 min,静置分层,取乙腈相10.0 mL旋蒸浓缩至干,用甲醇定容至5.0 mL,过0.45μm滤膜,待测[11,12]。
1.5.2 稻田土壤和水稻植株样品
准确称取已经制备好的稻田土壤样品20.0 g(或水稻植株样品10.0 g,水稻植株样品的提取与净化同土壤样品),置于250 mL具塞三角瓶中,加入80 mL乙腈,在30℃下恒温振荡提取30 min,再经布氏漏斗减压抽滤,用20 mL乙腈洗涤残渣和抽滤瓶2次(每次10 mL左右),收集全部滤液,旋蒸浓缩至近干,待弗罗里硅土柱净化。
弗罗里硅土净化柱自下至上依次装填少许脱脂棉、2 cm无水硫酸钠、5 g弗罗里硅土和2 cm无水硫酸钠,先用20 mL乙腈溶液预淋洗,弃去淋出液;再转入待净化液,用50 mL乙腈分10次淋洗(每次5 mL),收集全部淋出液,旋蒸浓缩至干,用甲醇定容至 5.0 mL,过 0.45μm滤膜,待测[13~15]。
1.6 检测
1.6.1 检测方法
稻田水样品用等体积的乙腈直接提取,提取液经盐析后取乙腈相,浓缩后用色谱甲醇定容,利用HPLC检测。稻田土壤、水稻植株用乙腈振荡提取,乙腈提取液用弗罗里硅土柱净化[16,17],浓缩后用色谱甲醇定容,待测。
1.6.2 标准曲线绘制
采用梯度稀释法将呋虫胺标准储备溶液用甲醇(色谱纯)稀释成浓度分别为 0.05、0.10、0.20、0.50、1.00、2.00、5.00及 10.00 mg/L的呋虫胺标准工作溶液,采用HPLC测定。每次进样量20μL。以呋虫胺标准工作溶液的质量浓度(x,mg/L)为横坐标,相对应的色谱峰的峰面积(y)为纵坐标,统计计算得到呋虫胺的标准工作曲线(图1)。

图1 呋虫胺标准曲线
1.6.3 回收率测定
分别在稻田水、稻田土壤、水稻植株的空白样品中添加呋虫胺标准工作溶液[18,19],使稻田水中呋虫胺的添加浓度分别为0.05、0.50和2.00 mg/L,使稻田土壤和水稻植株中呋虫胺的添加浓度分别为0.05、0.50和 2.00 mg/kg,用上述选定的 HPLC分析与检测方法测定其回收率。每档浓度重复5次。
2 结果与分析
2.1 标准曲线及回归方程
呋虫胺在稻田水和水稻植株、稻田土壤的回归方程为y=100.3x+7.894,相关系数为0.999;呋虫胺标准液的最小检出量为1.0×10-9g,稻田水中的最低检出浓度为0.05 mg/L,稻田土壤和水稻植株中的最低检出浓度均为0.05 mg/kg。表明所选定的检测方法完全可以用来对呋虫胺进行定量分析。
2.2 添加回收率
呋虫胺在稻田水中的添加回收率为89.3%~98.0%,稻田土壤中的添加回收率为87.3% ~98.3%,水稻植株中的添加回收率为90.4% ~99.0%;相对标准偏差(RSD)稻田水为2.62% ~2.73%,稻田土壤为1.28%~3.60%,水稻植株为2.32%~3.31%(表1)。均符合农药残留实验准则范围,该方法可以用于呋虫胺在稻田中的残留实验研究。
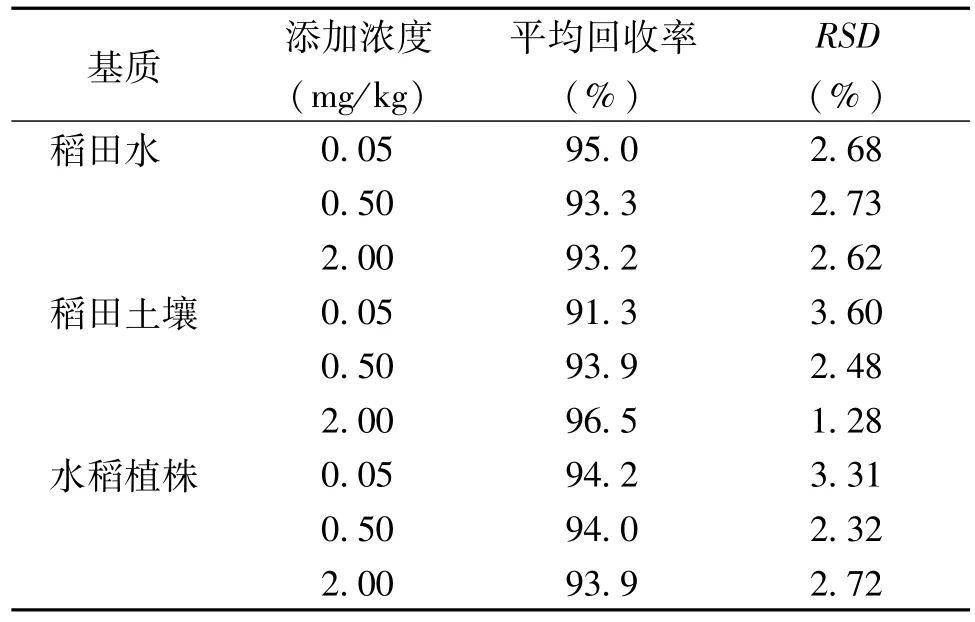
表1 呋虫胺在稻田水、稻田土壤及水稻植株中的添加回收率及相对标准偏差(RSD)
2.3 呋虫胺在稻田水、稻田土壤及水稻植株中的消解动态
各地呋虫胺原始沉积量见表2。
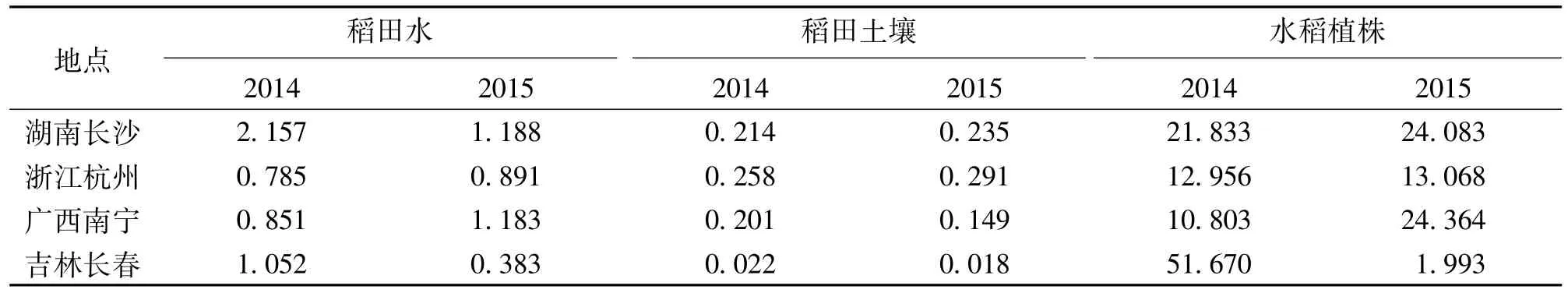
表2 各地呋虫胺原始沉积量(mg/kg)
实验结果表明,呋虫胺在稻田水和水稻植株中是一个随时间增加逐渐降低的过程,而在稻田土壤中却是一个先升后降的过程。呋虫胺在稻田水、稻田土壤和水稻植株中的残留降解符合一级动力学反应指数模型,降解方程可按公式Ct=C0e-kt计算,半衰期可按公式 T1/2=ln2/k计算[20]。式中:Ct为 t时刻呋虫胺的残留量(mg/kg),C0为呋虫胺的原始沉积量(mg/kg),k为降解速率常数,t为施药后时间(d)。
综合2年4地的数据发现,施药3 d时,呋虫胺在稻田水中的消解率为60.9%~96.8%,不同时间不同地点的消解程度不一,可能与取样选点及水质、生物等有关;施药7 d时消解率为83.6%~97.6%,均在80%以上,消解速率较快;施药10 d时,呋虫胺在稻田水中的残留量为0.050~0.078 mg/L;施药14 d时,其残留量均<0.05 mg/L。施药3 d时,呋虫胺在水稻植株中的消解率为83.2%~87.6%;施药7 d时,消解率为89.5%~98.3%,均在89%以上,消解速率较快;施药14 d时,其消解率为96.8%~99.5%;施药28 d时,其残留量为0.050~0.071 mg/kg;施药35 d时,其残留量均 <0.05 mg/kg。施药后2 h~1 d,呋虫胺在稻田土壤中为一个逐渐增加的过程,到第1天时达最大值,之后逐渐降低;施药3 d时,呋虫胺在稻田土壤中的消解率为14.1%~65.1%,波动范围较大,可能与施药方法、土壤质地及土壤生物活动有关;施药7 d时,其消解率为31.9% ~85.4%,消解速率较快;施药14 d时,其消解率为49.6%~92.5%;施药28 d时,其残留量为0.050~0.053mg/kg;施药35 d时,其残留量均 <0.05mg/kg。
从表3可以看出:50%呋虫胺可溶粒剂施用于稻田后,其有效成分呋虫胺在稻田水中的平均消解半衰期为2.02 d,4地的消解半衰期接近,表明呋虫胺在水体中的消解受温度、日照或降水量的影响较小。在稻田土壤中的平均消解半衰期为7.61 d,但4地差别较大,湖南长沙与浙江杭州消解速率快,广西南宁与吉林长春消解速率慢,推测与各地的气候、土壤类型及降水量有关,表明气温低或降水量大将不利于呋虫胺在土壤中的消解,广西南宁的赤红壤可能也不利于呋虫胺的消解,吉林长春则主要是低气温导致呋虫胺消解慢。在水稻植株中的平均消解半衰期为2.94 d,4地消解半衰期接近,说明呋虫胺在水稻植株中的消解受温度、日照或降水量的影响较小。

表3 呋虫胺在稻田水、稻田土壤和水稻植株上的消解动态
3 结论与讨论
50%呋虫胺可溶粒剂施用于稻田后,其有效成分呋虫胺在稻田水、稻田土壤及水稻植株中的残留量与施药剂量、施药后取样时间等因素有关。一般来讲,在其它因子相同时,施药剂量越大其残留量也越大,施药后取样时间越短,其残留量也越高。此外,稻田所在区域的气候条件、土壤类型和施药时期等因素也会影响其有效成分呋虫胺在稻田水、稻田土壤及水稻植株中的残留量。
建立高效液相色谱法检测呋虫胺在稻田水、稻田土壤和水稻植株中的残留检测方法,前处理简单、便捷,准确度、精密度和灵敏度较高,经验证呋虫胺平均回收率为91.3%~96.5%,相对标准偏差在1.28%~3.60%,符合农药残留分析的要求。实验结果显示,实际生产中按推荐剂量施药,呋虫胺主要分布在水稻植株中,在稻田土壤中的原始沉积量较低。建议进行室内模拟试验,进一步研究呋虫胺在稻田土壤中的残留趋势。
