TiO2/BDD复合电极在电化学氧化处理药厂废水中的应用
2018-11-30赵新阳李智强马玉祥张珂皓黄金洲苑鑫杰王海龙席耀辉赵延军王志强
赵新阳, 李智强, 马玉祥, 张珂皓, 黄金洲, 苑鑫杰,徐 阳, 王海龙, 席耀辉, 徐 帅, 赵延军, 闫 宁, 王志强
(1. 郑州大学 材料科学与工程学院, 郑州 450001) (2. 郑州磨料磨具磨削研究所有限公司 超硬材料磨具国家重点实验室, 郑州 450001) (3. 河南省功能金刚石材料创新中心, 郑州 450001)
近年来,随着我国工业现代化的快速发展,水污染问题日趋突出[1],在众多污染源中,富含难降解有机污染物的污水造成的影响尤为严重。这类污水主要包括制药废水、印染废水、生化废水等。处理此类污水的传统方法主要包括物理法、化学法、生物法,但这些方法很难在高浓度或者有毒、强酸、强碱等恶劣的条件下使用,并且可能存在降解不彻底、造成二次污染的问题。
高级氧化法则是通过光、电、磁及声学等手段在水中产生具有强氧化性能的羟基自由基(·OH),快速高效地降解污水中的有机物,是处理难降解有机污水的有效手段之一。掺硼金刚石(boron-doped diamond, BDD)薄膜电极由于具有低背景电流、宽电化学势窗的特点,在电化学氧化法处理有机污水方面展现出良好的应用前景[2>-4]。
BECK等[5]比较了Si/BDD、Ti/SnO2、Ta/PbO2以及Pt电极处理苯酚的效果,有机碳总量从处理前的1500 mg/L分别降到了50、300、650、950 mg/L,与其他3种电极相比较,Si/BDD电极去除有机碳的能力最强。李学敏等人[6]采用循环电解方式对含苯酚的废水(原始化学需氧量为1600 mg/L)进行了电化学氧化实验,同时对BDD电极和活性涂层钛基电极进行了对比实验研究,结果表明:在60 min时间内,BDD电极可将水样化学需氧量(chemical oxygen demand,COD)降解到趋近于零,而活性涂层钛基电极则只能将水样的COD 降解至 820 mg/L。上述研究可以看出,BDD 电极在处理酚类废水中表现出的明显优势。除此之外,采用BDD 电极为阳极,通过电化学氧化,对于含有邻苯二甲酸二甲酯[7]、十六烷基三甲基铵氯化物[8]、聚丙烯酸酯[9]、环乙酮[10]、磺酸萘[11]、TNT 废水[12]、垃圾渗出液[13]等废水的降解处理均有良好的效果。本课题组前期研究发现:通过TiO2修饰制备而成的TiO2/BDD复合电极在处理模拟污水时,比普通的BDD电极性能更优异。其研究是基于对以亚甲基蓝和活性艳红X-3B模拟废水的降解,并且研究进一步发现TiO2/BDD复合电极比BDD电极和TiO2电极单独降解后的加和效果更好[14]。但该部分研究仅限于实验室模拟的有机污水,尚未对相关工厂的实际废水进行研究。
实验通过在河南天方药业有限公司实地取样,对其不同浓度的制药废水进行降解处理,研究降解时间对COD去除率以及污水颜色变化的影响规律,推进TiO2/BDD复合电极在电化学氧化处理有机污水中的产业化发展。
1 实验过程
1.1 电极材料的制备
1.1.1实验原料
实验过程中所使用的化学试剂种类、纯度以及生产厂家如表1所示。其中,实验过程中所用到的水均为实验室自制的去离子水。

表1 TiO2/BDD复合电极制备中所用的实验原材料与试剂Table 1 The experimental raw materials and reagents used in the preparation of TiO2/BDD composite electrodes
1.1.2 制备过程
实验主要运用水热法在以单晶硅为衬底的掺硼金刚石薄膜电极表面生长出TiO2纳米束,从而制备出TiO2/BDD复合电极,详细制备过程见课题组前期研究成果[14,16]。
1.2 电极的组装
使用导电银浆将铜线一端粘在制备出的TiO2/BDD复合电极上,同时用热熔胶法进行封装,在电极表面预留出0.7 cm2的区域。将4个电极片固定在一起,总面积约为3 cm2。封装完成后,利用电化学工作站对电极进行电化学检测,并进行降解处理实验。

图1 组装电极模型图Fig. 1 The model of assembled electrode
1.3 电极的表征
实验采用循环伏安法[15]来研究TiO2/BDD复合电极在液体环境中电解时的化学性能。为了判断电极处理污水时是表面控制过程亦或扩散控制过程,在利用循环伏安法测试电极电化学性能时,改变扫描速率,观察峰电流与扫描速率的比例关系,从而进行判断。
1.4 废水的降解实验
1.4.1 原始水样的COD以及降解目标
废水水样取自河南天方药业有限公司不同工段的制药废水,共有3组浓度不同的废水。根据初始浓度的高低分别记作1#水样、2#水样、3#水样。水样初始COD(用ρ0表示)以及企业给出的降解标准如表2所示。

表2 水样初始COD及降解标准Table 2 Initial COD and degradation standard of water samples
1.4.2 实验设计
实验过程中,直流稳压电源提供电能,该电源最高输出电压30 V,电源精度可达0.000 1 A,具有短路保护功能。电极作为本实验的核心装置,阴阳两极均采用TiO2/BDD复合电极。为了提高扩散过程,加快废水的降解速率,实验在降解时采用磁力搅拌,同时设置电极间距为10 mm。另外,为了模拟工业化处理情景,提高光催化效果,实验在太阳光下进行。
针对1#、2#、3#水样的COD差距较大的情况,实验中的3种水样分别采取不同的时间间隔,每次取样10 mL待检测,取样同时记录数据。
1.4.3 废水的评价方法
在处理过程中选择合适的时间间隔取样检测,为进一步准确直观地观测污水处理效果,根据本实验待降解废水颜色不一的特点,采用紫外分光计对降解废水进行吸光度测试。同时采用高锰酸钾滴定法,对取出的水样进行COD测定。
COD去除率ρr的计算公式为:
其中:ρ0和ρt分别为初始时和电解t时间后的COD,其单位为mg/L。
2 实验结果与分析
2.1 电极的电化学性能表征
TiO2/BDD复合电极在0.1 mol/L H2SO4、 0.1 mol/L Na2SO4、0.1 mol/L NaOH溶液中的循环伏安曲线如图2所示。从图2中可以看出:TiO2/BDD复合电极在酸性、中性和碱性条件下的电化学势窗分别为3 V、4 V和4V,金刚石的sp3碳结构则是电极具有较宽电化学势窗的主要原因。从图2中还可以看出:该复合电极在不同条件下均具有较高的析氧过电位,均为2 V左右,高的析氧电位更有利于生成强氧化性的羟基自由基(·OH),氧化更多有机物,达到降解效果。
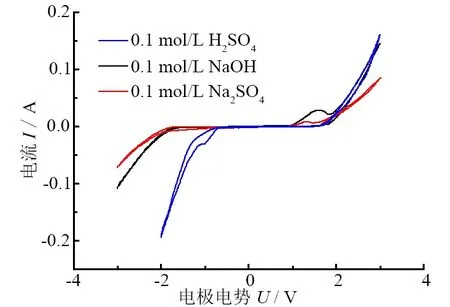
图2 不同电解质条件下TiO2/BDD电极的循环伏安曲线(扫描速率:50 mV/s)
图3所示为TiO2/BDD复合电极在5 mmol/L K3Fe(CN)6和1 mol/L KCl混合液中以不同扫描速率扫描的循环伏安曲线。
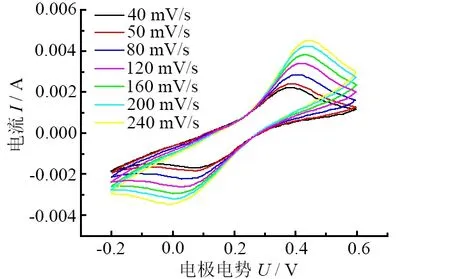
图3 TiO2/BDD复合电极在5 mmol/L K3Fe(CN)6和1 mol/L KCl混合溶液中不同扫描速率的循环伏安曲线
由图3可知:当扫描速率为80 mV/s时,有明显的氧化还原峰出现,并且峰电流比约为1.18(最接近于1),由此可以表明该电极材料表面具有良好的可逆性;并且随着扫描速率的增大,氧化还原峰电流略微增大,电极的氧化峰和还原峰间距也略微增大,进一步证明该复合电极较好的可逆性。
2.2 水样的紫外可见光谱分析
降解实验中的3种水样,其中2#水样和3#水样严重超出了紫外可见分光光度计的测试范围,仅对1#水样进行吸光度测试。
不同处理时间下1#水样的吸光度曲线如图4所示。从图4中可看出:水样的吸收峰在293 nm附近,峰值越高,说明水样的有机物浓度越大;随着处理时间延长,其吸收峰峰值不断降低,说明TiO2的光催化氧化效果随着时间变化并未明显减弱。

图4 1#水样吸光度曲线
2.3 水样的处理结果
采用TiO2/BDD复合电极电化学氧化处理1#水样的COD随处理时间的变化如图5所示。1#水样处理前颜色呈淡黄色,无气味,COD为162 mg/L,以电流密度为0.095 A/cm2的工作条件处理该污水水样。

图5 1#水样COD随时间变化趋势
从图5中可以看出:随着降解时间的延长,污水COD快速降低,污水也从最开始的淡黄色变清澈;当处理时间达到75 min时,1#水样COD低至19 mg/L, COD去除率为88.3%。
采用TiO2/BDD复合电极电化学氧化处理2#水样的COD随处理时间的变化如图6所示。2#水样处理之前,污水颜色为深褐色,无气味。在经过60 min处理后,污水的颜色变化较明显,当经过150 min的处理后,水样由最开始的深褐色变清澈,其COD也由593 mg/L降解到5 mg/L,COD去除率为99.1%。

图6 2#水样COD随时间变化趋势
采用TiO2/BDD复合电极电化学氧化处理3#水样的COD随处理时间的变化如图7所示。3#水样处理前,颜色为深黑色,有难闻气味。经过450 min的电化学氧化处理后,其颜色由深黑色逐渐变为淡黄色,难闻气味消失,当经过630 min处理后,其颜色接近于纯水的颜色,基本清澈,其COD也由起始的7339 mg/L降低到19 mg/L,COD去除率为99.7%。

图7 3#水样COD随时间变化趋势
3 结论
TiO2/BDD复合电极对难降解的药厂废水具有显著的降解处理效果。针对不同起始浓度的废水分别经过75、150和630 min处理,可将原废水的COD从162、593和7339 mg/L分别降低到19、5和19 mg/L,均达到国家排放标准。高效去除COD的主要机理与TiO2/BDD复合电极的光电协同催化作用密切相关,在电场的作用下,电子在二者的导带间转移,而空穴则在二者的价带间转移,从而使电子>-空穴的复合率显著降低,促使更多的电子和空穴参与到氧化还原反应过程中,产生更多的羟基自由基(·OH),氧化更多的水中有机物,达到高效降解的目的。
