3种樟属植物对皿式培养牛樟芝菌丝生长的影响
2018-11-30孟红岩林文珍林志楷刘黎卿
孟红岩,郭 莺,林文珍,林志楷,刘黎卿
(福建省亚热带植物研究所,福建省亚热带植物生理生化重点实验室,福建 厦门 361006)
【研究意义】牛樟芝(Antrodiacamphorata)别名牛樟菇、樟内菇或红樟菇等,隶属于担子菌纲,多孔菌目,多孔菌科,薄孔菌属,是 20世纪90年代在台湾发现的食(药)用真菌,有“森林红宝石”的美称。牛樟芝具有多种生理活性成分,包括多糖类、固醇类、三萜类、腺苷类、不饱和脂肪酸和免疫蛋白等[1-3]。多项研究证实,牛樟芝具有解酒保肝、消除肿瘤、补肾强心、益胃整肠、强化免疫、镇痛抗菌等作用,特别在治疗肝癌和子宫颈癌方面具有显著功效[4-10]。【前人研究进展】野生牛樟芝只生长在台湾百年以上的牛樟(Cinnamomumkanehirae)树干腐朽之心材内壁,或枯死倒伏的牛樟树潮湿表面。台湾学者张东柱认为牛樟木材精油会促进牛樟芝菌丝生长,同时抑制其它可能的竞争真菌,这有助于牛樟芝在牛樟木材上建立群落,但牛樟芝出菇时,牛樟精油并非必需[11]。野生牛樟芝生长速度极为缓慢,数量稀缺价格昂贵,现多以人工培养的方式来取代,并藉由不同培养方式来达到提高菌丝体产量的目的。牛樟芝的理论研究在台湾开展的相对较多,大陆亦逐渐兴起。台湾屏东科技大学的施玉兰在PDA(马铃薯葡萄糖琼脂)培养基中添加的牛樟木屑浸出液会促进牛樟芝菌丝的生长[12]。南台科技大学的郑维仁探讨了牛樟、冇樟(Cinnamomummicranthum)和樟树(Cinnamomumcamphora)的木屑热水提取物和乙醇提取物对牛樟芝菌丝生长的影响,结果发现加入木屑萃取物后牛樟芝的生长情形、清除DPPH(1,1-二苯基-2-苦味肼基团)自由基能力,抗肿瘤实验以及细胞抗氧化实验,均比纯PDA培养的效果佳,加入热水提取物生长情形以及活性均比加入乙醇提取物效果佳[13]。张洁怡利用牛樟芝天然寄主牛樟及4种同属的植物(冇樟、樟树、土肉桂和兰屿肉桂)进行牛樟芝生长因子筛选,他认为樟树水萃取物对牛樟芝的生长代谢力、碳水化合物产量、菌丝体产量和蛋白含量均有显著的促进效果,可选用樟树作为替代牛樟的参试树种[14]。我国大陆江南大学的陆震鸣研究了香樟 (Cinnamomumcamphoravar.linaloolifera) 树枝和树叶不同提取物对液态摇瓶培养的牛樟芝生物量和三萜含量的影响,结果发现香樟的石油醚提取物和乙酸乙酯提取物均能提高牛樟芝菌丝体中三萜的含量,香樟的水提取物能显著增大牛樟芝菌丝体生物量和菌丝球直径[15]。【本研究切入点】何种樟属植物更有利于牛樟芝菌丝体的生长,取决于牛樟芝菌株的生长条件(包括培养温度、湿度、通风、培养基的状态等),以及所添加樟属植物提取物的萃取方式和添加浓度等。我国大陆学者对牛樟芝皿式培养的研究鲜有报道。本研究团队开展了牛樟芝的皿式培养和相关分子生物学研究,着眼于在皿式培养条件下筛选促进牛樟芝生长的樟属植物,寻找促进牛樟芝生长的天然物质,优化培养基质,以获得优质的牛樟芝菌丝体或子实体,解决牛樟芝人工培养的技术瓶颈。【拟解决的关键问题】本研究以牛樟芝为实验菌种,选用了牛樟芝的天然寄主牛樟树,以及可能对牛樟芝菌丝体生长有促进作用的香樟和樟树,通过在皿式培养基中添加一系列浓度的牛樟、香樟和樟树的热水提取物或乙醇提取物,分析牛樟芝菌丝的扩散直径和菌丝体厚度等表型,比较3种樟属植物对牛樟芝菌丝生长影响的差异,初步筛选出在皿式培养中对牛樟芝生长有促进作用的牛樟和樟树,为牛樟芝的皿式培养提供理论基础和技术支撑。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株和植物材料 牛樟芝菌株由台湾群益富实业有限公司惠赠,保存于福建省亚热带植物研究所植物生理生化重点实验室。牛樟由台湾林业研究所引种至本单位,3年生;香樟由厦门牡丹香化实业有限公司提供,3年生;樟树为本研究所茶园内种植,多年生。3种樟属植物取材部位均为树枝。
1.1.2 主要试剂及引物 PDA和PDB(马铃薯葡萄糖水)培养基均购自广东环凯生物科技有限公司,基因组DNA 快速抽提试剂盒(真菌)购自生工生物工程(上海)有限公司,DNA marker 购自天根生化科技(北京)有限公司, 2×TaqMaster Mix和琼脂糖均购自厦门泰京生物技术有限公司,定性滤纸(102号)购自厦门海晟泰化工贸易有限公司,其他试剂均为分析纯。PCR引物由英潍捷基(上海)贸易有限公司合成。
1.2 试验方法
1.2.1 培养基的配置 木屑热水提取物的制备[13]:将木屑放至50 ℃烘箱,烘干至恒重,研磨成粉。分别称取牛樟、香樟和樟树的木屑各2、4、6 g于100 mL 2次去离子水中,以121 ℃萃取20 min,将萃取液用102号(快速)定性滤纸过滤,取滤液,制成浓度为20、40和60 g/L的木屑热水提取物。木屑乙醇提取物的制备[13]:将木屑放至50 ℃烘箱,烘干至恒重,研磨成粉。分别称取牛樟、香樟和樟树的木屑各2、4、8 g于100 mL 的75%乙醇溶液中,超声波萃取1 h,滤纸过滤,取滤液。重复上述步骤2次,合并3次萃取液,真空干燥后分别各用100 mL 2次去离子水复溶,制成浓度为20、40和80 g/L的木屑乙醇提取物。固体培养基制备:PDA培养基粉末(40 g/L )溶于2次去离子水、牛樟、香樟和樟树的木屑热水提取物或乙醇提取物中,加入微量元素MgSO4(0.5 g/L)、KH2PO4(0.5 g/L)和VB1(0.01 g/L),混匀,调pH至5.5,定容。121 ℃高压蒸汽灭菌20 min。灭菌后的培养基在超净工作台内分装至平皿或试管,冷却后供接种用。液体培养基制备:PDB粉末(24 g/L)溶于2次去离子水,加入微量元素MgSO4(0.5 g/L)、KH2PO4(0.5 g/L)和VB1(0.01 g/L),调pH至5.5,定容。121 ℃灭菌20 min。冷却后供接菌用。
1.2.2 菌种的培养及表型分析[12]用直径7 mm的打孔器于超净工作台内取距离菌落边缘5 mm生长状态良好,颜色鲜红的牛樟芝菌种。所取菌块分别接种于各种处理的平皿培养基上。每种处理5个重复。28 ℃培养30 d后测量“米”字型直径,拍照记录表型。
1.2.3 牛樟芝基因组DNA的提取[15-16]将牛樟芝菌块接种到PDA斜面培养基上28 ℃培养30 d,用10 mL PDB反复冲洗菌丝,然后按照每150 mL培养液中接种1 mL菌液的比例转接到液体培养基中。然后于28 ℃,120 r/min,震荡培养10 d后过滤收集菌丝球。在液氮冷却的研钵中加入适量菌丝球和液氮迅速研磨成粉末,装入1.5 mL离心管中,用真菌基因组DNA提取试剂盒提取牛樟芝的基因组DNA。
1.2.4 核糖体DNA(rDNA)的内转录序列(ITS)扩增及测序 ITS序列扩增采用真菌ITS通用引物引物ITS1 5’-TCCGTAGGTGAACCTGCGG-3’和ITS4 5’-TCCTCC GCTTATTGATATGC-3’,扩增ITS序列全长。反应体系为20 μl,模板DNA 0.5 μl,2×TaqMaster Mix 10 μl,10 pmol/μl的ITS1和ITS4各1 μl,无菌水7.5 μl。PCR扩增程序为94 ℃预变性50 s,30个循环(包括94 ℃变性50 s,51 ℃退火50 s,72 ℃延伸1 min)最后72 ℃延伸10 min。PCR产物经1.2 %琼脂糖凝胶检验纯度和浓度,合格的PCR产物纯化后由英潍捷基(上海)贸易有限公司测序。
1.2.5 供试菌株ITS rDNA扩增序列比对 将测序所得的ITS rDNA序列在NCBI中经进行比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。
2 结果与分析
2.1 牛樟芝菌种的培养和鉴定
本实验用的牛樟芝菌株在PDA培养基生长30 d后菌落直径可达5 cm以上,菌落最外环颜色最浅呈乳白色,菌落内部菌丝呈现橘黄色至橘色(图1A)。该菌有水蜜桃果腐味。牛樟芝菌具有多种基因型,为了确定实验菌株的基因型,提取了该菌的基因组DNA。在基因组DNA提取过程没有去除RNA的操作,因此电泳图中可以看到部分RNA条带的存在。箭头所指为实验菌株的基因组DNA(图1B)。核糖体DNA的ITS序列在绝大多数的真核生物中表现出极广泛的序列多态性。ITS分析在菌物系统发育研究中被广泛应用。以实验菌株的基因组DNA为模板扩增了其ITS rDNA序列,目标条带介于500~750 bp之间(图1C)。纯化的PCR产物经一代测序,结果显示实验樟芝菌株rDNA的ITS序列全长627 bp(图1D),与NCBI比对结果同源性达99%以上。经鉴定本研究所用菌株为牛樟芝模式菌株BCRC35396,GeneBank登录号为AY378094(图1E)。

A:PDA培养基上生长30 d的实验牛樟芝菌株表型,标尺为1 cm; B:牛樟芝基因组DNA电泳图; C:PCR扩增的牛樟芝ITS电泳图; D:测序得到的牛樟芝ITS序列信息;E:ITS序列比对结果A: Morphology of A. camphorata grown on PDA medium for 30 days, Scale bar 1 cm; B: Electrophoresis of A. camphorata genomic DNA; C: Electrophoresis of A. camphorata ITS; D: ITS sequence; E: Blast result of A. camphorata ITS 图1 本研究所用牛樟芝菌株的鉴定Fig.1 Identification of Antrodia camphorata used in this study
2.2 牛樟、香樟和樟树木屑热水提取物对牛樟芝生长的影响分析
为挖掘牛樟芝菌丝体生长的促进因子,选取牛樟芝的天然宿主牛樟,以及文献报道中对牛樟芝生长可能有促进作用的香樟和樟树,将其木屑提取物添加至培养基。牛樟、香樟和樟树3种植物的木屑热水提取物均采用20,40和 60 g/L 3个浓度梯度,分别添加到PDA培养基,观察其对牛樟芝菌丝生长的影响,对照为纯PDA培养基上生长的牛樟芝。结果发现,牛樟、香樟和樟树热水提取物的添加均能明显促进牛樟芝菌丝的生长。在添加热水提取物培养基上生长30 d的牛樟芝菌落直径显著大于纯PDA培养基生长的牛樟芝(图2A)。3种樟属植物对牛樟芝菌丝生长的促进效果不同。在实验条件下对照PDA培养基上生长的牛樟芝菌落最中心(接种区)附近会出现不同程度的老化;牛樟热水提取物的添加会使得牛樟芝菌落更大,菌落外环菌丝更蓬松,同时中心接种区附近老化区域面积增大(图2A)。20,40和60 g/L的牛樟提取物对牛樟芝菌丝体生长的促进效果类似(图2B)。在本研究选择的3种樟属植物中,香樟对牛樟芝菌丝生长的促进作用最强的。结果显示20,40,60 g/L的香樟热水提取物添加后牛樟芝菌落直径大于同浓度下牛樟和樟树提取物的添加(图2B)。同时,相比其他2种樟属植物香樟热水提取物添加后牛樟芝菌落老化更严重。樟树热水提取物的添加会使得牛樟芝菌丝长势远远优于对照条件,是3种樟属植物添加后菌丝状态最好的(图2A),但菌落直径最小(图2B)。结果表明,香樟的热水提取物最能促进牛樟芝菌丝的生长,牛樟次之,樟树最弱;综合考虑整个菌落的生长状态(包括直径、厚度和致密度),樟树的添加是最优的,牛樟次之,而香樟最差(图2)。以上结果说明在以收获牛樟芝菌丝体为目的的皿式培养中可以加入20 g/L低浓度的牛樟或樟树热水提取物来促进牛樟芝菌丝的生长。
2.3 牛樟、香樟和樟树木屑乙醇提取物对牛樟芝生长的影响分析
本实验设计了20,40和 80 g/L 3个浓度梯度的牛樟、香樟和樟树木屑的乙醇提取物,分别添加到PDA培养基,培养30 d后观察牛樟芝的生长状态,对照仍为纯PDA培养基上生长的牛樟芝。结果发现,20和40 g/L的牛樟和樟树的乙醇提取物的添加均能促进牛樟芝菌丝的生长,牛樟芝菌落直径增大;而80 g/L的牛樟和樟树乙醇提取物则会抑制牛樟芝菌丝的生长,牛樟芝直径缩小同时菌丝变致密(图3A)。3个牛樟乙醇提取物浓度中20 g/L对牛樟芝菌丝生长的促进作用最强,而樟树则是40 g/L的浓度对牛樟芝菌丝促进作用最强,结果均表现为菌落直径增大(图3B)。3个浓度的香樟乙醇提取物则都能不同程度地促进牛樟芝菌丝的生长,其中低浓度提取物(20 g/L)对牛樟芝的促进作用最强,高浓度提取物(80 g/L)对牛樟芝的促进作用则最弱(图3B)。与热水提取物添加后的结果类似,香樟乙醇提取物的添加会使得牛樟芝菌落严重老化,从中心接种区至菌落最外环,菌丝稀疏,颜色浅淡(图3A)。3种樟属植物乙醇提取物添加至培养基后,牛樟芝菌落直径最大的是添加樟树乙醇提取物40 g/L,其次为樟树乙醇提取物20 g/L、牛樟乙醇提取物20 g/L和香樟乙醇提取物20 g/L的添加条件,菌落直径均有不同程度的增大(图3B)。乙醇提取物添加后牛樟芝菌丝密集菌落生长状态最好的是添加樟树提取物80 g/L,其次为添加樟树和牛樟提取物40 g/L,以及添加樟树和牛樟提取物20 g/L的培养条件(图3A)。综合考虑菌落直径和菌丝状态,在牛樟芝皿式培养时可以添加40 g/L的牛樟或樟树乙醇提取物来促进牛樟芝菌丝的生长。
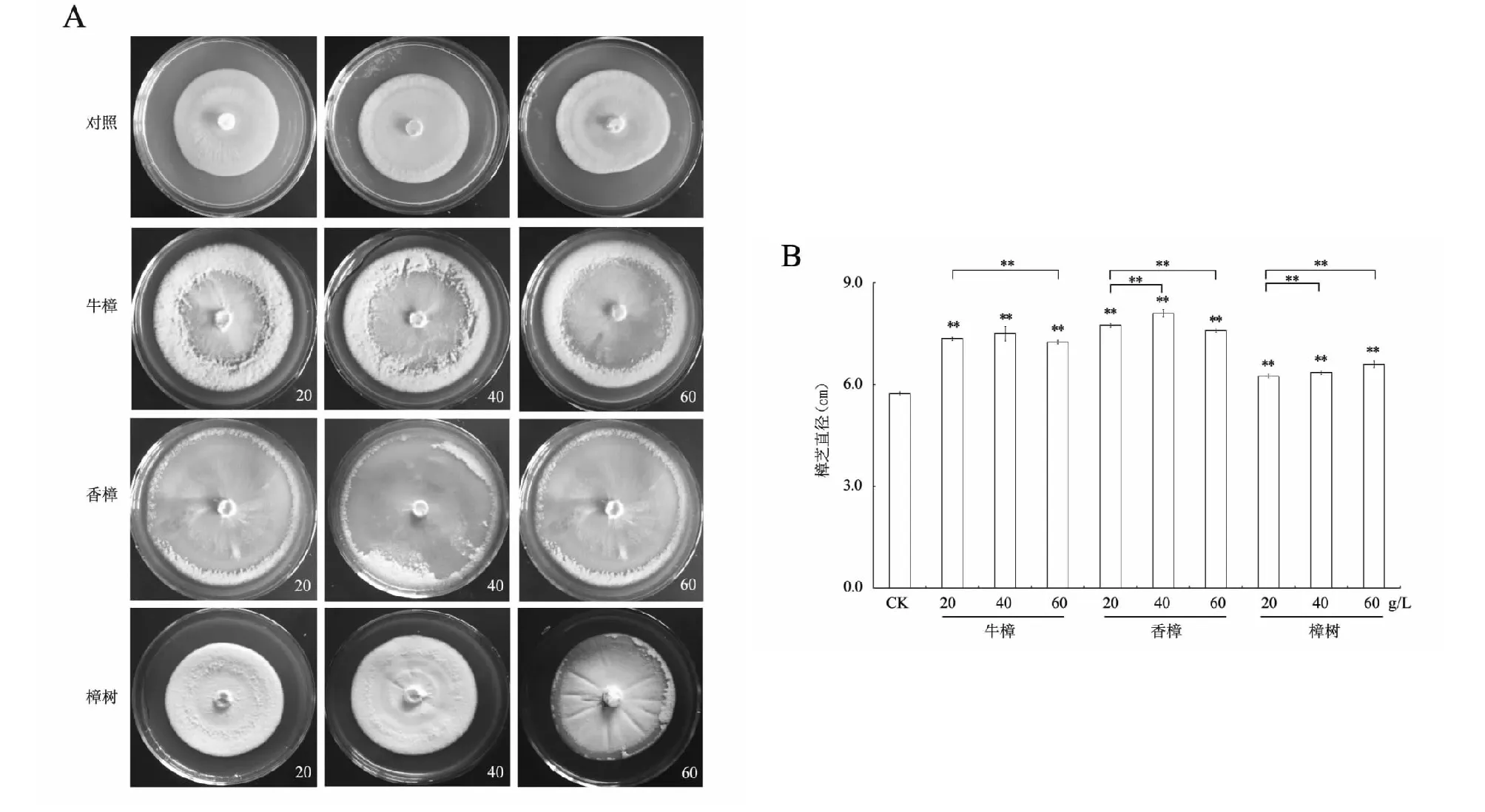
A:牛樟芝的菌丝表型;B:牛樟芝直径;**表示差异极显著(P<0.01)A:Morphology of A. camphorata hyphae; B:Diameter of A. camphorata;**indicates a highly significant difference(P<0.01)图2 在添加樟属植物热水提取物的培养基上生长30 d的牛樟芝Fig.2 Antrodia camphorata grown on medium supplied with Cinnamomum plant water-extract for 30 days

A:牛樟芝的菌丝表型;B:牛樟芝直径;**表示差异极显著(P<0.01)A:Morphology of A. camphorata hyphae; B:Diameter of A. camphorata;**indicates a highly significant difference(P<0.01)图3 在添加樟属植物乙醇提取物的培养基上生长30 d的牛樟芝Fig.3 Antrodia camphorata grown on medium supplied with Cinnamomum plant ethanol-extract for 30 days
3 讨论与结论
牛樟芝作为中国台湾地区特有的珍稀药(食)用真菌,具保肝、防癌、抗癌、提高免疫力等生理活性[4-10]。在自然界中,牛樟芝仅寄生、腐生于特定宿主牛樟树,目前并未发现牛樟芝生长在其他树种上。牛樟芝子实体生长极其缓慢,生产周期长,再加上牛樟树被列为台湾一级保护树种,能生长牛樟芝的老树非常少见,资源有限,这些都极大限制了野生牛樟芝的产量。牛樟芝的人工培养逐渐兴起。开展牛樟芝的人工培养,不仅可以在较短时间内获得牛樟芝的子实体或菌丝体满足市场需求,同时对于牛樟芝的理论研究具有积极的推动作用。
牛樟芝人工培养方式主要包括固态培养,液态发酵,椴木培养和皿式培养。大陆和台湾学者近些年的研究发现,牛樟、冇樟、樟树、香樟等都有可能促进牛樟芝菌丝的生长,只是在不同的实验条件下研究者筛选出最有利于牛樟芝生长的樟属植物品种不同[12-15]。有人用小叶红心樟椴木培养出牛樟芝子实体,与野生牛樟芝成分一致[17]。樟属植物不同品种之间代谢物的差异很大。曾春山等对4种樟属植物(樟树、阳春樟、肉桂和阴香)鲜叶的精油成分分析发现,樟属植物间精油相同成分较少,种间精油成分差异较大,各植物特有精油成分突出[18]。也有研究发现用牛樟椴木培养的樟芝与用其他椴木培养的樟芝代谢谱明显不同,用牛樟椴木培养的牛樟芝代谢物种类更丰富[19]。可以肯定的是,①牛樟树作为牛樟芝唯一的天然宿主,其中一定含有其他樟属植物不具备的特殊代谢物组分;②能用椴木培养牛樟芝的樟属植物中也一定具有促进牛樟芝生长的一种或多种共性物质。
近年来兴起牛樟芝的皿式培养,该方式以培养皿为栽培单位,可控性强,单位间交叉污染概率低,单位面积产量高,同时菌体品质稳定,也易于实现量化生产[20-21]。关于皿式培养的研究目前只有为数不多的台湾文献报道[12-14]。本研究团队在对牛樟芝进行皿式培养的过程中尝试添加了牛樟、香樟和樟树木屑的热水和乙醇提取物。牛樟和樟树木屑低浓度(20 g/L)、中浓度(40 g/L)和高浓度(60 g/L)的热水提取物均能促进牛樟芝的生长,表现为菌落直径大于对照条件(图2);牛樟和樟树木屑低浓度(20 g/L)和中浓度(40 g/L)的乙醇提取物能促进牛樟芝菌丝的扩散,而80 g/L的乙醇提取物则会抑制菌丝生长(图3)添加樟树提取物培养的牛樟芝菌丝更致密,这一结果验证了台湾张洁怡提出的樟树水萃取液促进牛樟芝菌丝生长的论断[14]。在本研究中,与牛樟和樟树不同的是,香樟不同浓度的热水提取物和乙醇提取物均能促进牛樟芝菌丝的生长(图2~3),这与陆震鸣[15]提出的在液态摇瓶培养时香樟促进牛樟芝菌丝生长的结论一致。在牛樟芝皿式培养时加入香樟的木屑提取物,可能由于菌丝生长太快,表现为菌丝稀薄。笔者认为,在以收获牛樟芝菌丝体或子实体为目的批量化皿式培养中不适合添加香樟的提取物来促进菌丝生长,可以添加适量牛樟和樟树的提取物。热水提取物的制备较乙醇提取物要简单、经济、易行。但在量化生产时添加何种提取物不仅要考量菌丝的扩散直径,更取决于收获的菌丝体或子实体的质量,即牛樟芝有效活性物质三萜和多糖等的含量。因此在牛樟芝的大规模皿式培养时用何种方式萃取牛樟或樟树的木屑加入到培养基中还有待进一步分析。另外,牛樟和樟树提取物组分的异同,以及这些提取物促进牛樟芝生长的机理等都有待于后续实验进一步研究。
