基于高通量测序的苎麻根际土壤真菌群落结构
2018-11-30汤涤洛涂修亮汪红武
汤涤洛,涂修亮,付 聪,熊 伟,汪红武*
(1.咸宁市农业科学院,湖北 咸宁 437100;2.湖北省苎麻工程技术研究中心,湖北 咸宁 437100)
【研究意义】苎麻是中国极具特色的经济作物,其产量和面积均占全世界的90 %以上[1]。土壤微生物在作物根际分布密集并且联系十分紧密[2],对根际养分有重要影响[3-5],研究表明光合产物碳作为枢纽由根系进入土壤使根际微域形成巨大的根际碳沉降[6-7],从而驱动了根际微生物群落变化调节植物与微生物的互作关系[8],表现为土壤养分的利用效率受土壤微生物活性降低的影响,土壤微生物种群结构不合理将使有害微生物数量逐渐增多并占优势[9-12]。【前人研究进展】微生物平板培养法、生物标记法等传统的土壤微生物研究方法往往会过低估计并且无法详细描述土壤微生物的群落结构组成[13]。第二代测序Illumina MiSeq方法避免了通量低、操作复杂和准确率低等问题[13-14]具有操作简单、成本较低、测序速度更快、通量更高和可信度更高的优势,并且它集中了Roche 454和Illumina HiSeq 2500的优点,可同时进行多样品多可变区测序,所以它更适合实验室进行群落结构的测定[15, 18-19]。当前,苎麻根际微生物群落的研究主要在于微生物数量与纤维产量关系、根际微生物量碳氮的差异比较[20-21],但不同苎麻品种根际土壤微生物多样性研究较少。【本研究切入点】本试验通过高通量测序法研究不同根型苎麻根际土壤真菌群落结构,探究不同根型苎麻根际土壤真菌群落结构组成及其多样性的差异。【拟解决的关键问题】本研究对深入研究苎麻根际群落结构是否合理、根系与土壤微生物互作关系具有一定的理论意义。
1 材料与方法
1.1 研究区概况与试验设计
研究地点位于咸宁市崇阳县白霓镇石山村(114°09′39″E,29°33′04″N),供试材料分别为湘苎三号,华苎四号,黄壳麻,试验设计了湘苎三号(深根型)、黄壳麻(浅根型)、华苎四号(中根型)、自然休闲处理(对照)4个处理,随机排列,3 次重复,共12个小区,种苗全部采用统一繁殖的嫩梢扦插苗。
1.2 样品采集
采样时间为2016年9月,按照“S”形在每个小区选取采样点,每个小区取6个点混匀为1个样,3次重复,共12个样品。根际土壤取样采用“抖根法”,将土壤表面5 cm以上的土壤扒掉,将植株根系从土壤中挖出并抖掉与根系松散结合的土体,然后将与根系紧密结合土壤(0~4 mm)用刷子刷下来作为根际土样。根际土样用冰盒带回存于-80 ℃,用于土壤微生物DNA提取及后续测定。
1.3 土壤DNA提取及MiSeq测序
取0.25 g左右的新鲜土壤样品,采用试剂盒(PowerSoil DNA Isolation kit,MOBIO Laboratories,Inc.美国)提取各样本土壤总DNA,用1 % 琼脂糖凝胶电泳后经Gold View染色检查提取的DNA质量。采用ABIGeneAmp 9700型PCR仪,选用可扩增的真菌ITS区段,引物为:1743F-5′-CTTGGTCATTTAGAGGAAGTAA-3′和2043R-5′-GCTGCGTTCTTCATCGATGC-3′,指定测序区域,合成带有barcode的特异引物。PCR反应采用20 μl体系,其中含5×FastPfu Buffer 4 μl,dNTPs(2.5 mmol) 2 μl,Forward Primer(5 μmol) 0.8 μl,Reverse Primer(5 μmol) 0.8 μl,Fast PfuPoglymerase 0.4 μl,Template DNA 10 ng,补ddH2O至20 μl。PCR扩增条件为1×(3 min 95 ℃);27×(30 s 95 ℃;30 s 55 ℃;45 s 72 ℃);10 min 72 ℃,10 ℃保存。每个样本的PCR产物用2 %琼脂凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱后进行定量,按照每个样本的测序要求,进行相应比例的混合,然后干冰保存快递至上海欧易生物医学科技有限公司用于MiSeq测序分析。
1.4 数据分析与处理
(1)MiSeq高通量测序所得到的Raw Data, 利用Trimmomatic[22]软件对其双端序列进行去杂,再使用FLASH(v1.2.11)[23]软件进行拼接。拼接后的原始序列通过QIIME (version 8.0)[24]软件进行质控后得到clean reads(tags), cleans reads采用 usearch[25]去除嵌合体序列总共得到优质序列(reads)
(2)OUT分类与统计。使用 Uparse 软件对优质序列按序列相似度 97 %进行聚类,并选取每个 OTU 中丰度最高的序列作为该 OTU 的代表序列[26]。对OTU 的代表序列同Unite数据库对比[27]。为了保证分析结果的准确性,精简去掉丰度值小于总序列条数 0.001 %的OUT[28],后续分析均使用精简后的 OTU 列表。
(3)数据处理。利用R软件(VennDiagram) 生成组间 OTU 维恩图,利用 mothur 软件中的 summary.single 命令,计算 Chao1 指数、Simpson 指数和 Shannon 指数等3种常用的α多样性指数[29-31]。利用 SPSS20.0软件进行数据统计分析。
2 结果与分析
2.1 不同处理间根际土壤真菌群落丰富度和多样性估计
如表1所示,对4个不同处理土壤共得到51 702条优质序列,样本优质序列R1(深根型)、 R2(浅根型)、 R3(中根型)和CK分别读取了13 546、13 136、15 040、15 751。对于整个过程进行统计得到结果如表1所示。不同处理土壤包含共有的真菌群落OTUs,对照自然休闲处理CK(1135)的OUT数量高于处理深根型处理R1(641),浅根型处理R2(778),中根型处理R3(1106),种植苎麻的根际土壤的OUT数量为R3(中根型)> R2(浅根型)> R1(深根型)真菌群落多样性的非参数估计,群落丰富度指数Chao1数、群落多样性指数Shannon和Simpson 表现为R3(中根型)> R2(浅根型)> R1(深根型),但是都低于对照处理CK。
总体来看,不同根型土壤根际真菌群落的OUT 数量、Chao1指数、Shannon指数、Simpson指数存在差异并表现一定的规律性,即R3(中根型)> R2(浅根型)> R1(深根型)>CK,表明:①自然休闲处理的真菌多样性较种植苎麻的根际土壤丰富,这说明苎麻根系对根际定殖土壤真菌有一定的选择性;②种植不同根型苎麻的根际土壤真菌群落多样性存在差异,并表现为种植中根型苎麻的根际土壤真菌群落要比种植浅根型、深根型苎麻丰富。
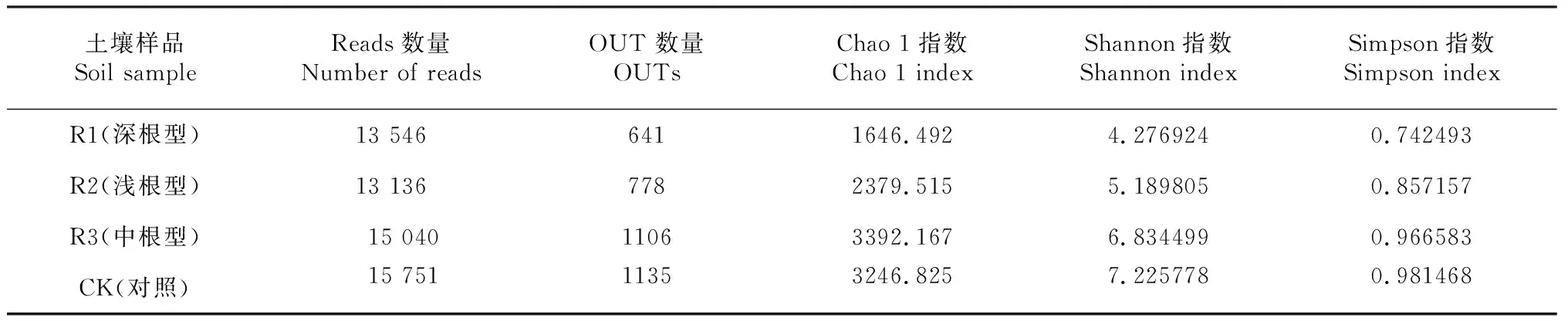
表1 不同处理真菌群落丰富度及多样性指数
2.2 不同处理土壤根际真菌群落比较
从图1可以看出,4个不同处理的土壤真菌分为两类,CK为一类,处理R1(深根型)和R3(中根型)组成相似性高,并与R2(浅根型)聚为一类,说明这3个处理的趋同性较高。
从图2可以看出,如,R1(深根型)和 R2(浅根型) 共同含有197个 OUT; R2(浅根型) 和 R3(中根型)共同含有247个OTU,R1(深根型)和R3(中根型) 共同含有235个 OUT;CK与R1(深根型)、
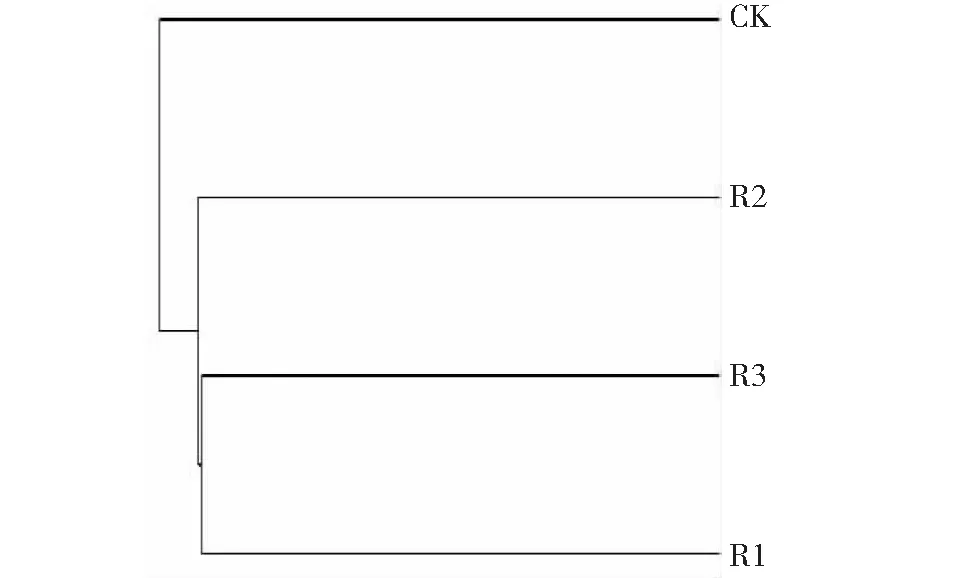
图1 不同处理相似性聚类图Fig.1 Similarity clustering of different treatments
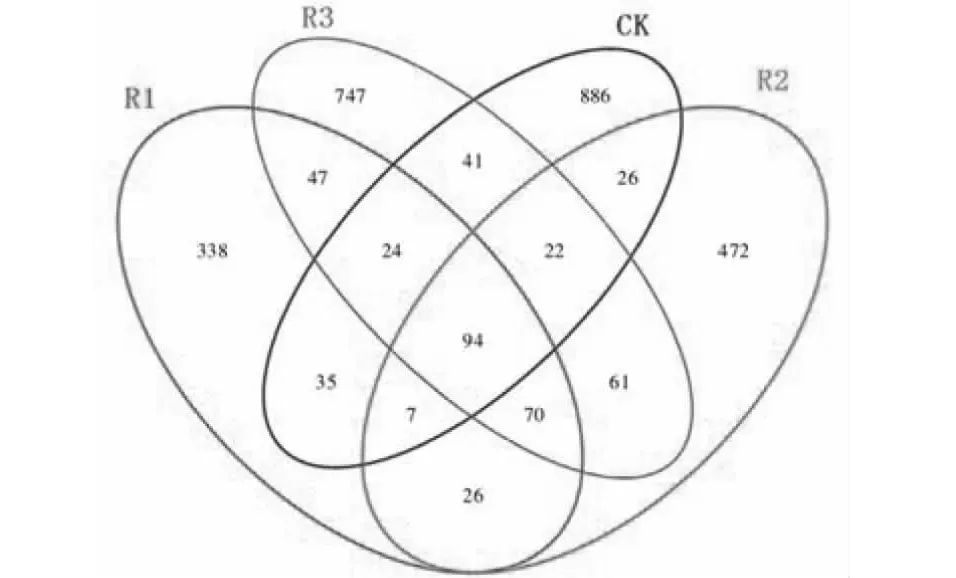
图2 不同处理土壤真菌群落 OTUs 韦恩图Fig.2 Venn diagram of OTUs of soil fungal communities in different treatments
R2(浅根型)、R3(中根型)共同含有的OUT分别为:160、149、181。
聚类分析与韦恩图结果均表明,种植不同根型苎麻的根际土壤真菌组成相似,但是种植苎麻的土壤真菌组成与对照自然休闲处理的土壤根际存在差异。
2.3 土壤真菌群落结构分析
如图3所示,4个不同处理土壤中真菌群落主要有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota)及未分类的真菌(Fungiun-classified),种植苎麻的根际土壤中担子菌门为第一优势门,都达到50 %左右,其次为子囊菌门。而对照自然休闲处理子囊菌门(47.51 %)为第一优势门,其次为担子菌门(25.00 %)。
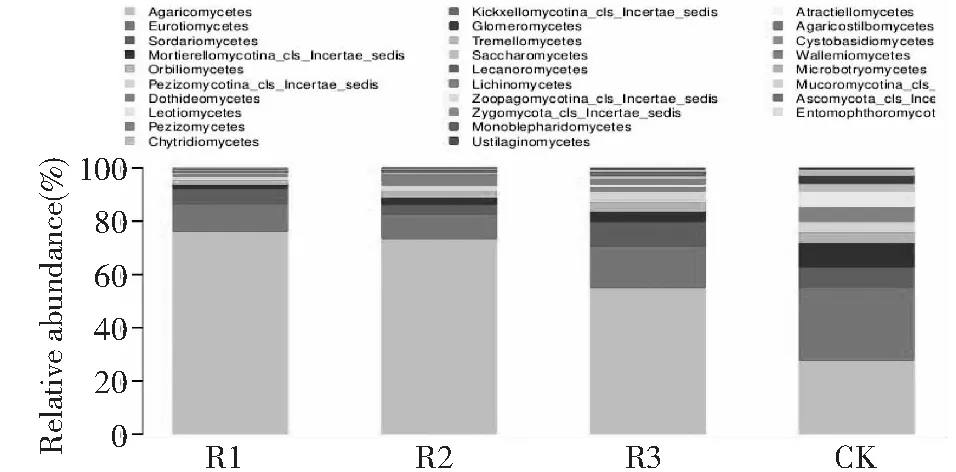
如图4所示,伞菌纲(Agaricomycetes)、散囊菌纲 (Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、圆盘菌纲(Orbiliomycetes)、座囊菌纲(Dothideomycetes)、锤舌菌纲(Leotiomycetes)、盘菌纲(Pezizomycetes)、壶菌纲(Chytridiomycetes)、等组成土壤真菌群落的真菌纲,伞菌纲为所有处理中的第一优势菌纲,所占比例表现为R1(深根型)>R2(浅根型) >R3(中根型)>CK,分别为72.60 %、69.81 %、46.99 %、22.92 %。但是第二优势菌纲散囊菌纲所占比例表现为R2(浅根型) 图3 同处理门水平真菌群落组成Fig.3 Fungal communities in different treatment at phylum level 图4 不同处理纲水平真菌群落组成Fig.4 Fungal communities at class level in different treatments 如图5所示,属水平丰度较高的有木耳属(Auricularia)、梨孢霉属(Coniosporium)、斜盖伞属(Clitopilus),R1(深根型)、 R2(浅根型)处理的优势菌属为木耳属(Auricularia),其中在R2(浅根型)所占的比例最高为35.12 %,R1(深根型)为7.91 %; R3(中根型)、CK处理的优势菌属梨孢霉属(Coniosporium),其中CK所占的比例最高为7.80 %,R3(中根型)比例为2.05 %。 多样性指数越高表明微生物群落多样性越丰富。本研究结果表明,种植苎麻的根际土壤的OUT数量、群落丰富度指数Chao1数、群落多样性指数Shannon和Simpson 都表现为R3(中根型)> R2(浅根型)> R1(深根型)>CK。这说明,①不同根型苎麻的根际土壤真菌群落丰度具有一定差异并表现出一定的规律。②没有种植苎麻的根际土壤真菌多样性较种植苎麻丰富。③种植苎麻的土壤中根型苎麻的根际土壤真菌多样性最为丰富。本研究支持了植物根系对根际定殖的土壤真菌具有一定的选择性这一结论[32-33], 并可以推测出不同根型苎麻对根际定殖的真菌类群仍存在选择性。 土壤真菌群落结构组成及其多样性对生态系统的平衡起着重要的作用。苎麻的根际土壤真菌包括担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota)及未分类的真菌(Fungiun-classified),担子菌门为第一优势门。这些门也分布在其他作物种植的根际土壤中[34]。伞菌纲为第一优势菌纲,属水平丰度较高的有木耳属(Auricularia)、梨孢霉属(Coniosporium)、斜盖伞属(Clitopilus)。这一方面说明苎麻对根际定殖的土壤真菌具有选择性,另一方面这些真菌在苎麻根际能大量定殖可能与该类真菌的生态功能有关。这支持了根系对土壤真菌的选择影响了植物与微生物的互作关系这一结论[35]。 图5 不同处理属水平真菌群落组成Fig.5 Fungal communities at genus level in different treatments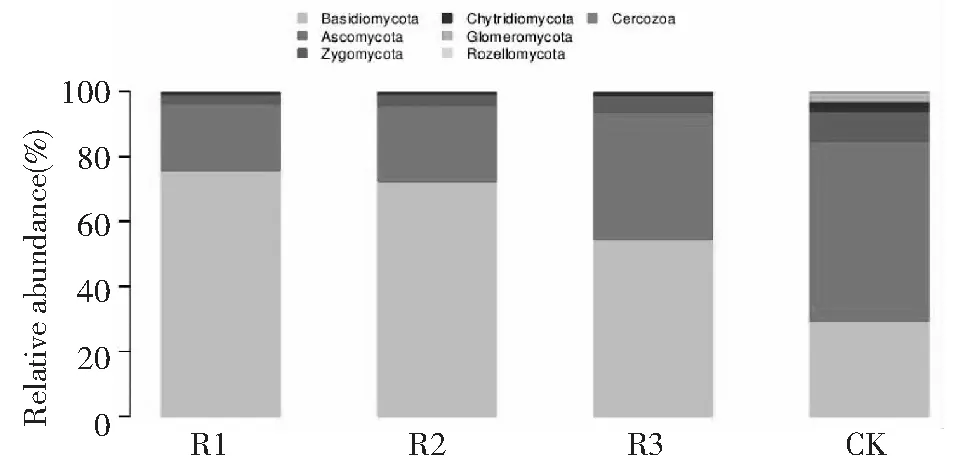
3 讨 论
3.1 种植不同根型苎麻对根际土壤真菌多样性的影响
3.2 种植不同根型苎麻对根际土壤真菌群落结构影响

