牛肉及其中式加工品中猪肉成分的定性、定量检测方法研究
2018-11-30朱扬刘永峰魏燕超申倩王一凡
朱扬,刘永峰,魏燕超,申倩,王一凡
牛肉及其中式加工品中猪肉成分的定性、定量检测方法研究
朱扬,刘永峰,魏燕超,申倩,王一凡
(陕西师范大学食品工程与营养科学学院,西安 710062)
【目的】建立牛肉及中式加工品中猪肉成分的定性、定量检测方法,保障牛肉产品的纯正性。【方法】提取猪肉及不同加工猪肉制品中的猪基因组DNA,通过DNA质量检测,PCR扩增,灵敏度试验,分析加工方式对猪DNA质量、灵敏度和检测限的影响;制备生牛肉和经干、蒸、煮、炖、煎、炸、烤制处理的牛肉制品中掺入不同比例(10%、5%、1%、0.1%)猪肉的二元混合肉,进行普通PCR和荧光定量PCR定性定量检测,探索DNA在掺假鉴别中的应用。【结果】不同加工方式下猪DNA质量检测结果显示,不同加工方式显著影响DNA纯度(<0.05),生猪肉及7种猪肉制品中DNA纯度(A260nm/A280nm)范围为1.893—1.977,高于理论值1.8;DNA含量范围为110—277 µg·g-1,经加工处理的猪肉制品的DNA含量显著高于生猪肉处理组(<0.05);琼脂糖电泳结果发现,放置6个月后生猪肉和7种肉制品的DNA严重降解,但生猪肉依然能获得一些不清晰的长片段DNA,而7种肉制品的猪DNA全部降解为小片段DNA,说明长时间放置和热处理明显影响了猪DNA的完整性;猪肉制品中DNA的降解虽然严重,经普通PCR扩增线粒体基因,所有样品的PCR产物均呈现为清晰且单一的条带,可见从加工肉制品中提取的DNA可以开展灵敏度试验和掺假检测试验;灵敏度试验结果显示普通PCR是高度敏感的,经10倍梯度稀释,8个试验组样品中提取的猪DNA最低检测限均为0.005 ng;荧光定量PCR扩增猪DNA所得Ct值形成的标准曲线也具有良好的线性关系,其标准曲线斜率处在-3.1—-3.7,决定系数2值均大于0.99,PCR扩增效率处在89%—100%,且定量PCR最低能够检测出0.005 ng的猪DNA。掺假样品定性定量PCR检测结果显示,除炸制混合肉(为1%)外,混合生肉及其他6种混合肉制品的定性检测试验最低检测限均为0.1%,说明普通PCR可检测微量的猪肉成分;混合肉的定量试验中根据不同掺假比例所建立的8个试验组标准曲线的决定系数2>0.99,斜率为-3.1—-3.6,各曲线均具有良好的线性关系,可以实现牛肉中猪肉成分的定量检测;对比生肉与肉制品的定量结果,混合生肉与混合肉制品的标准曲线的截距之间存在约0.01—0.6个循环数的差异。【结论】不同加工处理能够显著影响肉中DNA的含量、纯度和完整性,但不影响肉制品中DNA的检测限和灵敏度,普通PCR和定量PCR均可以检测到极微含量的掺假肉成分。可见,基于PCR技术的检测方法灵敏度高、速度快、特异性强,定量检测标准曲线有较高的线性相关性和扩增效率,可为肉类行业质量控制和检验计划以及验证标签声明提供可靠的依据,可应用于一些商业样品,以保证肉制品的纯正性。
牛肉;猪肉;加工工艺;PCR;定性定量;灵敏度
0 引言
【研究意义】近年来,食品行业的欺诈行为引起了人们对健康问题的关注。食品欺诈是指对食品配料或食品包装,标签,生产信息或产品进行故意的替代、添加、篡改或虚假陈述,以获得可能影响消费者健康的经济利益[1]。而肉类掺假主要是由低价值的肉类替代了高营养、高价值的肉类,添加未申报的物种或用植物蛋白质代替肌肉蛋白质[2]。除了经济问题外,人们对于肉类掺假所造成的健康问题的关注度也逐步增长[3-4]。由于制假产品人们在宏观方面不易辨别,因此,需要一种科学准确的方法对市面上的样品进行鉴定,为执法机关在打击制假的时候,提供确凿的证据[5]。【前人研究进展】目前已经提出了几种分析技术来鉴定混合样品中的肉类物种,其中包括基于蛋白质的方法,如高效液相色谱法,电泳技术和酶联免疫吸附测定[6]。这些方法在应用于加工肉类时是不精确的,因为蛋白质在加热,加压和脱水过程中会发生变性,且基于蛋白质的测定法,在交叉反应影响下,区分密切相关的物种时不够敏感[7-9]。基于DNA的PCR扩增序列分析可以使用线粒体或核基因DNA,与蛋白质相比,DNA更加稳定和特异,而且相对容易获得,这意味着它是分子检测方法的一个很好的选择。聚合酶链式反应(PCR)基于其速度,灵敏度,简便性和可靠性,已经发展成为一种成熟的食品掺假检测技术[10-11]。因此,PCR是理想的加工肉类和肉类产品的物种鉴定方法。而SYBR Green I实时PCR检测法不需要单独的设计探针,是最简单,最便宜和最直接的荧光系统[12]。2015年,Hou等[13]使用多重PCR技术建立了检测鸡鸭鹅DNA的方法;Iwobi等[14]建立了一种用于定量肉中牛肉和猪肉分量的多重实时PCR方法。林彦星等[15]和刘岑杰等[16]建立了肉制品中鸭源性成分的实时荧光PCR检测方法;张国华[17]建立了基于实时荧光PCR定量检测肉制品猪源性成分的研究方法。【本研究切入点】大多数研究都是基于不同物种鲜肉样品的掺假研究,关于深加工肉品的定量掺假检验的灵敏度和检测限研究较少,针对热加工肉样的定量掺假研究更是鲜有报道。【拟解决的关键问题】本研究采用干、蒸、煮、炖、煎、炸和烤等方法处理牛肉和猪肉,提取生猪肉及不同加工猪肉制品中的猪基因组DNA,通过DNA质量检测、PCR扩增、灵敏度试验,分析加工方式对猪DNA质量、灵敏度和检测限的影响;制备生牛肉和经干、蒸、煮、炖、煎、炸、烤制处理的牛肉制品中掺入不同比例(10%、5%、1%、0.1%)猪肉的二元混合肉,进行普通PCR和荧光定量PCR定性定量检测,探索DNA在掺假鉴别中的应用。从而,开发一种加工牛肉制品中猪肉成分的定性、定量检测方法,为肉类行业质量控制和检验计划以及验证标签声明提供可靠的依据,以保证某一畜禽肉制品的纯正性。
1 材料与方法
研究于2017年3月至2018年1月在陕西师范大学食品工程与营养科学学院进行。
1.1 试验材料及处理
本研究样品为猪肉和牛肉,采自西安华润万家超市,在-20℃冷冻储藏。试验时取适量猪肉于4℃冰箱中解冻24 h,分割为1 cm×1 cm×3 cm的块状。分别对猪肉、牛肉采用张兰[18]的干制、蒸制、煮制、炖制、煎制、炸制和烤制等传统中式加工方式处理,得到7种猪肉样品和牛肉样品。
对于单独的猪肉样品设置1个生肉对照组和7个加工处理组;制备干、蒸、煮、炖、煎、炸、烤制的牛肉样品和猪肉样品的混合肉样,以混合的生猪肉和生牛肉作为对照组,其中每个试验组中猪肉分别占10%、5%、1%和0.1%(w/w)的比例,最终各试验组样品重量为40 g。考虑到熟肉制品的掺假检测时间不确定,我们选择了肉制品货架期的中间时间(6个月),对所有熟肉样进行6个月的4℃冷藏放置,为保证时间统一,生猪肉和生牛肉在冰箱冷冻储藏6个月。
1.2 主要试剂与仪器
试剂:Tris Cl、NaCl、EDTA、苯酚、异戊醇、氯仿、无水乙醇、SDS,西安晶博生物科技有限公司;蛋白酶K、RNA酶、引物、TaqMan Universal PCR Master Mixture、2×Ultal SYBR Mixture、Marker DL 2000,西安励合生物科技有限公司。
仪器:Nanodrop ND-1000分光光度计、梯度PCR仪和荧光定量PCR仪,美国热电公司;凝胶成像仪,美国西盟公司。
1.3 肉中DNA提取
将所有肉样用研钵研磨成粉末用于DNA的提取,将约300 mg的组织与560 µL DNA缓冲液(pH 8.0,100 mmol·L-1Tris Cl、100 mmol·L-1NaCl和5 mmol·L-1EDTA),150 µL 5% SDS、18 µL的蛋白酶K(20 mg·mL-1)涡旋使溶液充分混匀,置于56℃水浴锅中加热消化4 h。然后将等体积的苯酚加入到消化的细胞浓缩物中,手摇10 min,然后以12 000 r/min离心10 min,得到上清液。将上清液用等体积的苯酚﹕氯仿﹕异戊醇(体积比为25﹕24﹕1)萃取1次,用等体积的氯仿﹕异戊醇(体积比为24﹕1)萃取1次。并在37℃下用10 mg·mL-1RNA酶将RNA降解30 min,用等体积的氯仿﹕异戊醇(体积比为24﹕1)再萃取1次,在1.5 mL离心管中以12 000 r/min离心10 min,得到上清液。最后,用冰的无水乙醇沉淀DNA,用乙醇﹕水(体积比为7﹕3)洗涤1次。加入100 μL TE(pH = 8.0,1 mmol·L-1Tris Cl和0.5 mmol·L-1EDTA)以溶解DNA。
1.4 猪肉及其肉制品中DNA含量、纯度、完整性和PCR扩增效果检测
使用分光光度计,测定样品中DNA含量,以260 nm和280 nm处的吸光度作为纯度指数。将猪DNA在100 V下用1%琼脂糖凝胶电泳40 min。电泳后,在紫外光成像分析仪下观察凝胶检测DNA完整性。通过PCR扩增,引物序列见表1,以验证所有分离物中可扩增线粒体DNA的存在,为消除样品之间DNA提取效率的差异,需要对PCR模板进行标准化处理(即每个PCR反应的DNA模板标准化为50 ng·μL-1)。
PCR扩增条件:在94℃预变性5 min,然后在94℃变性30 s,63℃退火30 s,35个循环,72℃延伸30 s,最后在72℃总延伸10 min。PCR扩增体系:3.4 μL Mixture,引物各0.3 μL(0.3 μmol·L-1),2 μL DNA模板,加入ddH2O至10 μL,PCR产物在 100 V下用1%琼脂糖凝胶电泳40 min,并在UV光下拍照。

表1 引物序列及扩增片段长度
1.5 猪肉及其肉制品中DNA的普通PCR灵敏度检测
将猪肉及其肉制品中猪DNA按10倍系列稀释,以检测热加工对猪DNA模板灵敏度的影响(范围为1﹕1—1﹕10 000,相当于DNA浓度为50 ng·μL-1— 5 pg·μL-1),使用上述PCR条件,在100 V下用1%琼脂糖凝胶电泳40 min,并在UV光下拍照。
1.6 猪肉及其肉制品中DNA的定量PCR灵敏度检测
将猪肉及其肉制品中猪DNA按照普通PCR灵敏度试验的稀释方法进行处理,用SYBR Green I染料进行实时PCR,测定的扩增效率和检测限(LOD)。通过绘制实时PCR分析的Ct值与DNA浓度的对数,进行每个稀释度的3次重复以构建标准曲线。使用以下等式从标准曲线的斜率计算扩增效率:
扩增效率(%)= [10(-1/斜率)- 1]×100
实时PCR在两步法热循环条件下进行。95℃10 min,95℃循环45次、30 s和65℃ 1 min,每个循环结束时收集荧光信号。制备包含5 μL 2×Ultal SYBR Mixture,上下游引物各0.3 μL(0.3 μmol·L-1),DNA模板1 μL(50 ng·μL-1),加入ddH2O至10 μL。对于熔解曲线数据,温度从65℃升高到94℃。
1.7 普通PCR定性检测牛肉中掺假猪肉成分
按照上述猪肉中DNA的提取方法,对牛肉中含有10%、5%、1%和0.1%(w/w)猪肉的二元混合肉进行DNA提取,以线粒体基因为目标基因,使用上述PCR条件进行扩增,在100V下用1%琼脂糖凝胶电泳40 min,并在UV光下拍照。根据PCR扩增结果,对不同掺假比例的混合肉最低检测限进行分析。
1.8 定量PCR检测牛肉中掺假猪肉成分
分别以和18S rRNA为目标基因和内参基因,以混合肉的DNA为模板进行定量PCR扩增,引物序列见表1。每个二元混合肉样品设置3个重复,使用上述定量PCR条件。为消除样品之间DNA提取效率的差异,同样也对模板进行标准化处理(即每个PCR反应的DNA模板为50 ng·μL-1)。比较目的基因和内参基因的Ct值来计算ΔCt,定量二元模型混合物中10%、5%、1%、0.1%(w/w)的猪肉。采用下述表达式构建标准曲线:
ΔCt=Ct(猪肉)-Ct(内参基因)
式中,Ct(猪线粒体基因)和Ct(猪内参基因)分别对应于猪和18S rRNA基因的周期阈值。
2 结果
2.1 猪肉及其肉制品中DNA含量、纯度和完整性的检测结果
2.1.1 DNA含量与纯度的检测 加工方式对猪肉样品DNA含量和纯度的影响结果见表2。基于分光光度计的测定,DNA含量范围为110—277 µg·g-1。单因素分析显示加工方法显著影响DNA含量(<0.05),且经热加工处理的肉制品的DNA含量显著高于生肉试验组(<0.05)。加工方法也显著影响了DNA纯度(<0.05),理论上DNA纯度(A260 nm/A280nm)高于1.8。试验组中DNA纯度范围为1.810—1.977,符合理论值。
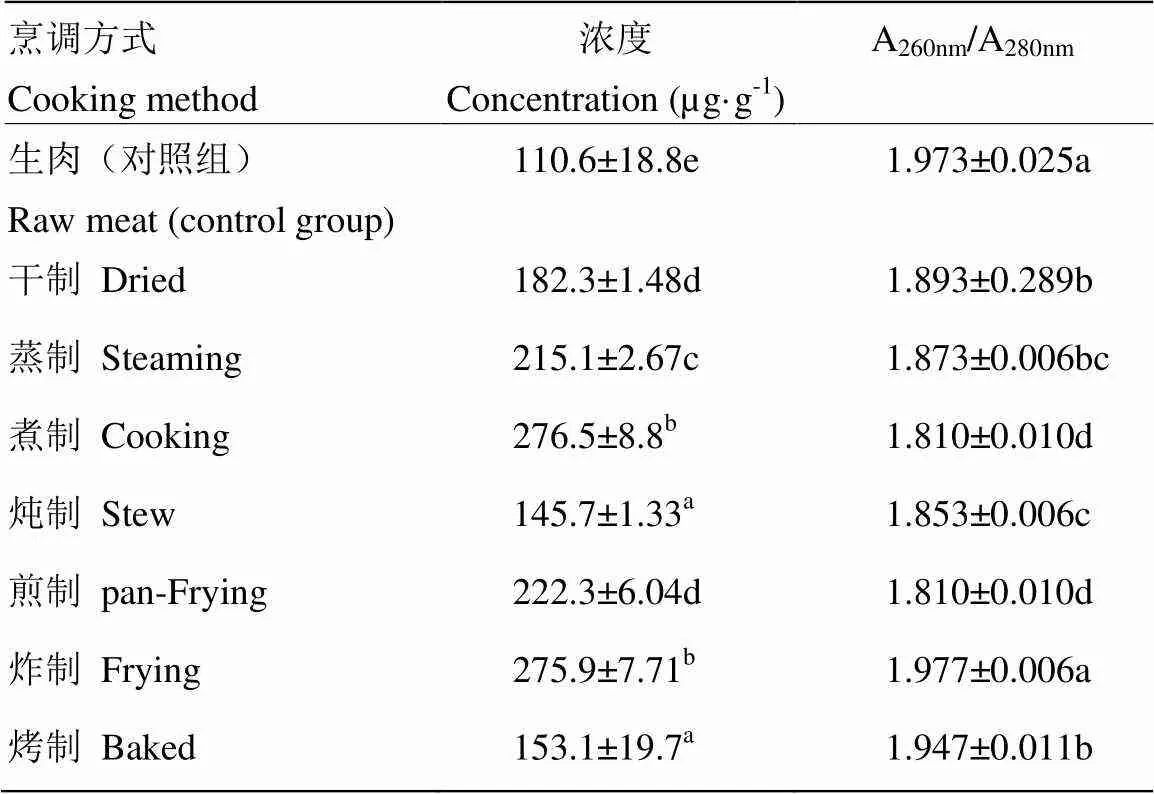
表2 猪肉及其肉制品中DNA的含量和纯度
数值以平均值±标准差表示;不同小写字母表示处理间差异显著(<0.05)
Values are expressed as mean±standard deviation;different small letters indicate significant differences at<0.05 under different treatments
2.1.2 DNA琼脂糖凝胶电泳检测 凝胶电泳结果如图1所示,放置6个月后生猪肉和7种肉制品的猪DNA虽然严重降解,但生猪肉依然能获得一些不清晰的长片段DNA,而7种肉制品经长时间放置后DNA全部降解为小片段DNA,说明放置时间和热处理会显著影响肉制品中DNA的完整性;PCR扩增线粒体基因的结果如图2所示,生肉组和7种不同加工处理组均可获得清晰且单一的扩增产物条带,表明猪肉及其制品中DNA虽然降解严重,但依然可以进行PCR扩增。可见从加工肉制品中提取的DNA可以开展后续的灵敏度试验和掺假检测试验。
2.2 猪肉及其肉制品中DNA的PCR灵敏度分析结果
2.2.1 猪肉及其肉制品中DNA的普通PCR灵敏度检测 将猪DNA提取物10倍梯度稀释,测定DNA浓度后,进行普通PCR扩增,评估普通PCR对猪DNA的检测灵敏度,结果如图3所示,从泳道1到用泳道5,目的条带亮度逐渐减小,说明PCR能够检测到的信号随DNA模板量的减少而减少。8个试验组的猪DNA模板的检测限均可达到0.005 ng,结果表明基于猪DNA的PCR测定是高度敏感的。
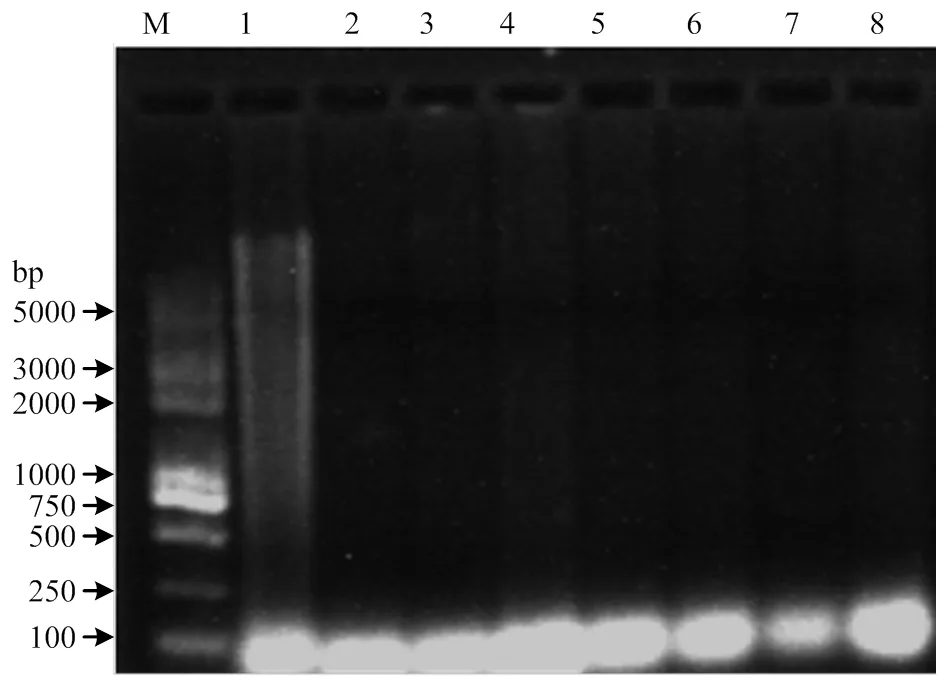
泳道1:生肉、2:干制、3:蒸制、4:煮制、5:炖制、6:煎制、7:炸制、8:烤制; M:DL2000 Marker
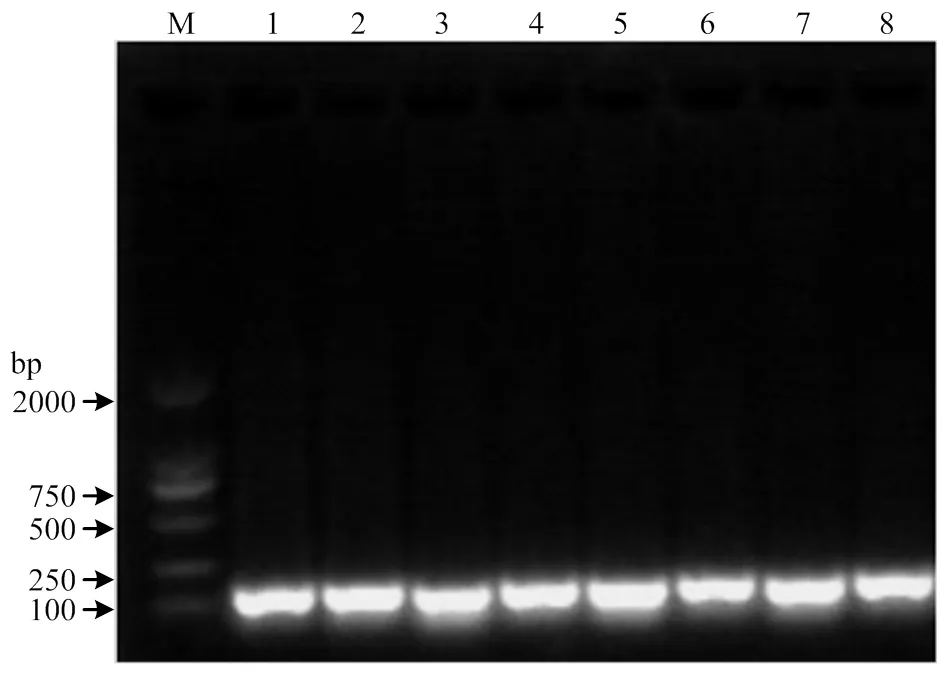
泳道1:生肉、2:干制、3:蒸制、4:煮制、5:炖制、6:煎制、7:炸制、8:烤制;M:DL2000 Marker
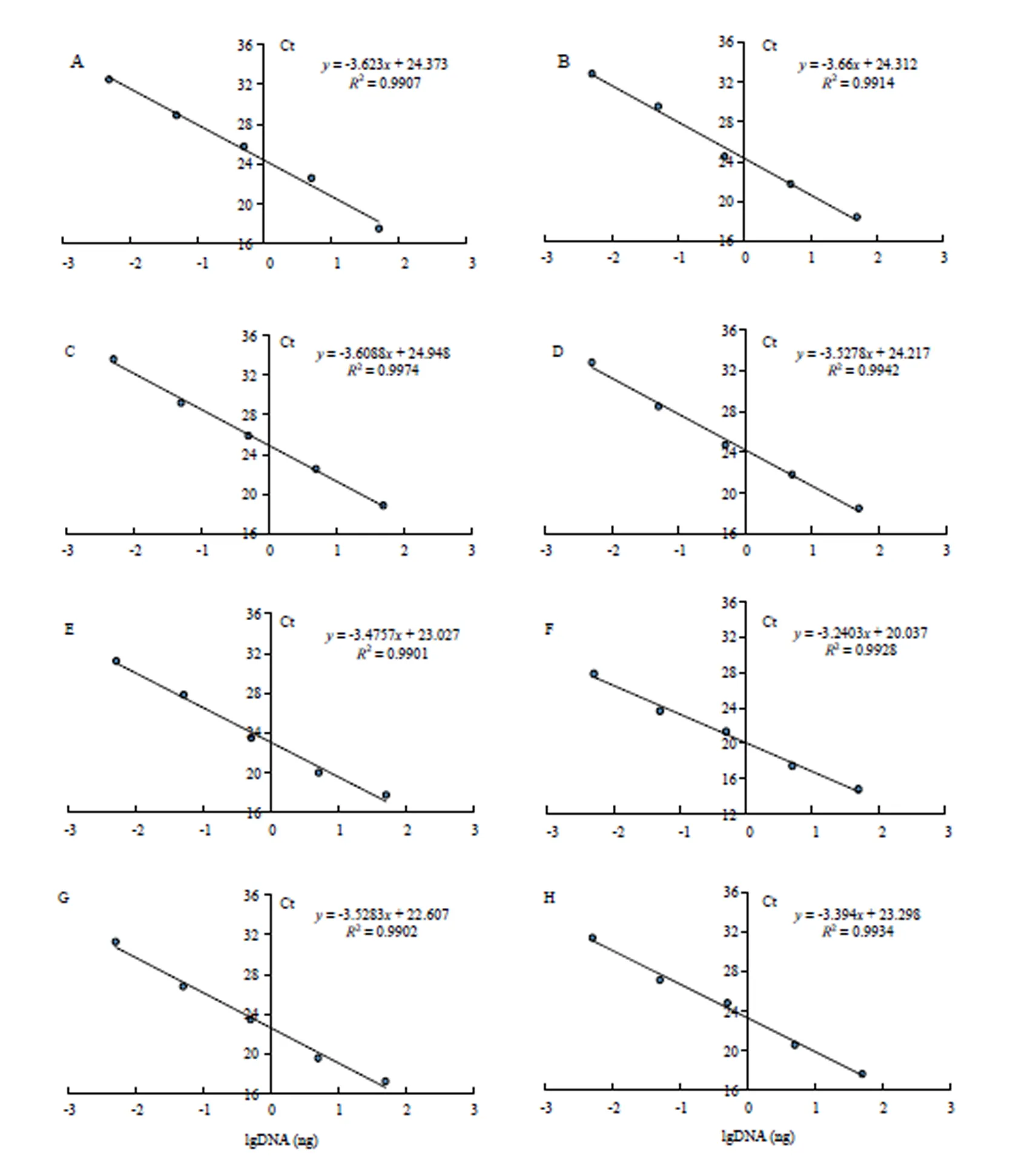
2.2.2 猪肉及其肉制品中DNA的定量PCR灵敏度检测 对猪DNA进行10倍梯度稀释,对5个数量级的DNA模板进行了定量PCR检测,获得的Ct值与初始DNA量的对数建立的8个标准曲线见图4。8个试验组的阈值循环方程分别为=-3.623+24.373、=-3.4897+22.953、=-3.66+24.312、=-3.6088+ 24.948、=-3.5278+24.217、=-3.4757+20.027、=-3.2403+20.037、=-3.5283+22.607、=-3.394+ 23.298,其斜率在-3.1—3.7。标准曲线的决定系数2分别为0.9907、0.9952,0.9914、0.9974、0.9942、0.9901、0.9928、0.9902、0.9934,2值均大于0.99,说明方程线性关系良好。经计算PCR扩增效率分别为0.89、0.93、0.88、0.89、0.92、0.94、0.92、0.97,PCR效率范围在89%—100%,说明具有较高的扩增效率。猪肉及其肉制品中DNA检测的最低水平均为0.005 ng,说明荧光定量PCR在此检验范围内结果较为可靠,能够进行下一步分析。
2.3 普通PCR定性检测牛肉中掺假猪肉成分的结果
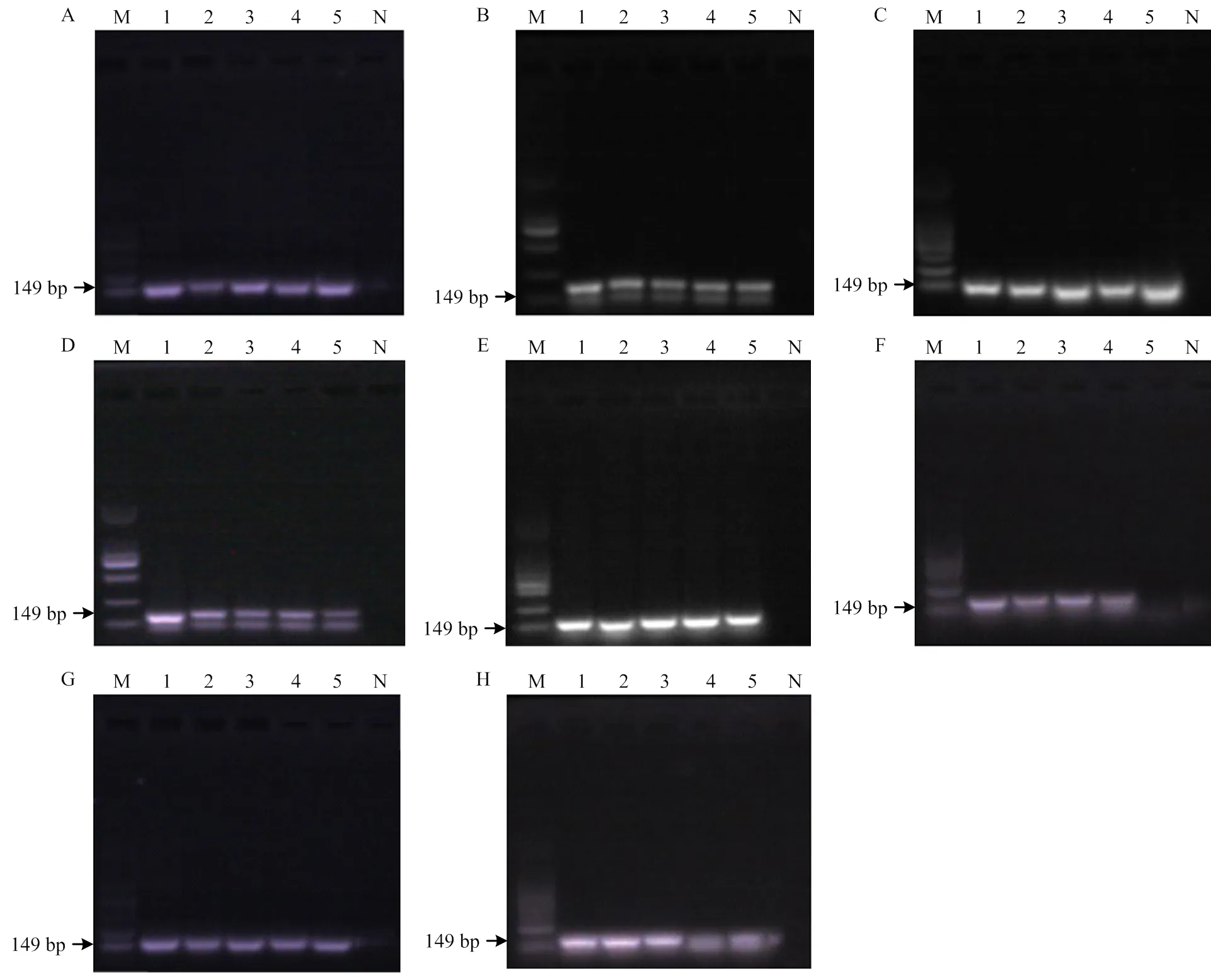
普通PCR定性检测牛肉中猪肉成分结果如图5所示,除炸制混合肉(为1%)外,混合生肉及其他6种混合肉制品的最低检测限均为0.1%,且随猪肉成分的减少,可以明显的观察到目的条带的亮度逐渐减小。试验表明普通PCR能够明确的检测到微量的猪肉成分,实现不同加工方式下掺假样品的定性检测。
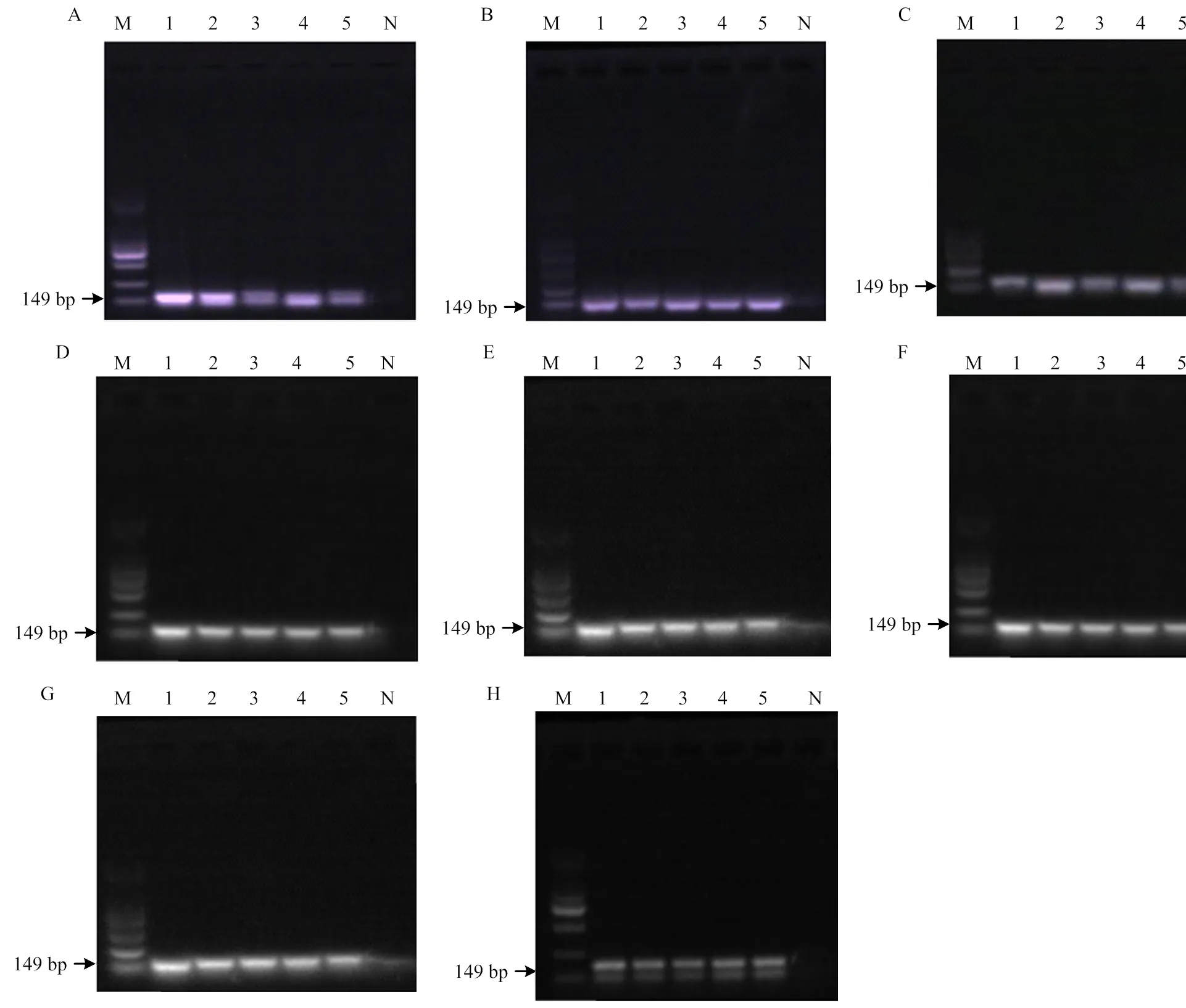
生肉(A)、干制(B)、蒸制(C)、煮制(D)、炖制(E)、煎制(F)、炸制(G)、烤制(H);M:DL2000 Marker,N:阴性对照;泳道1-5:50、5、0.5、0.05、0.005 ng
2.4 定量PCR检测牛肉中掺假猪肉成分的结果
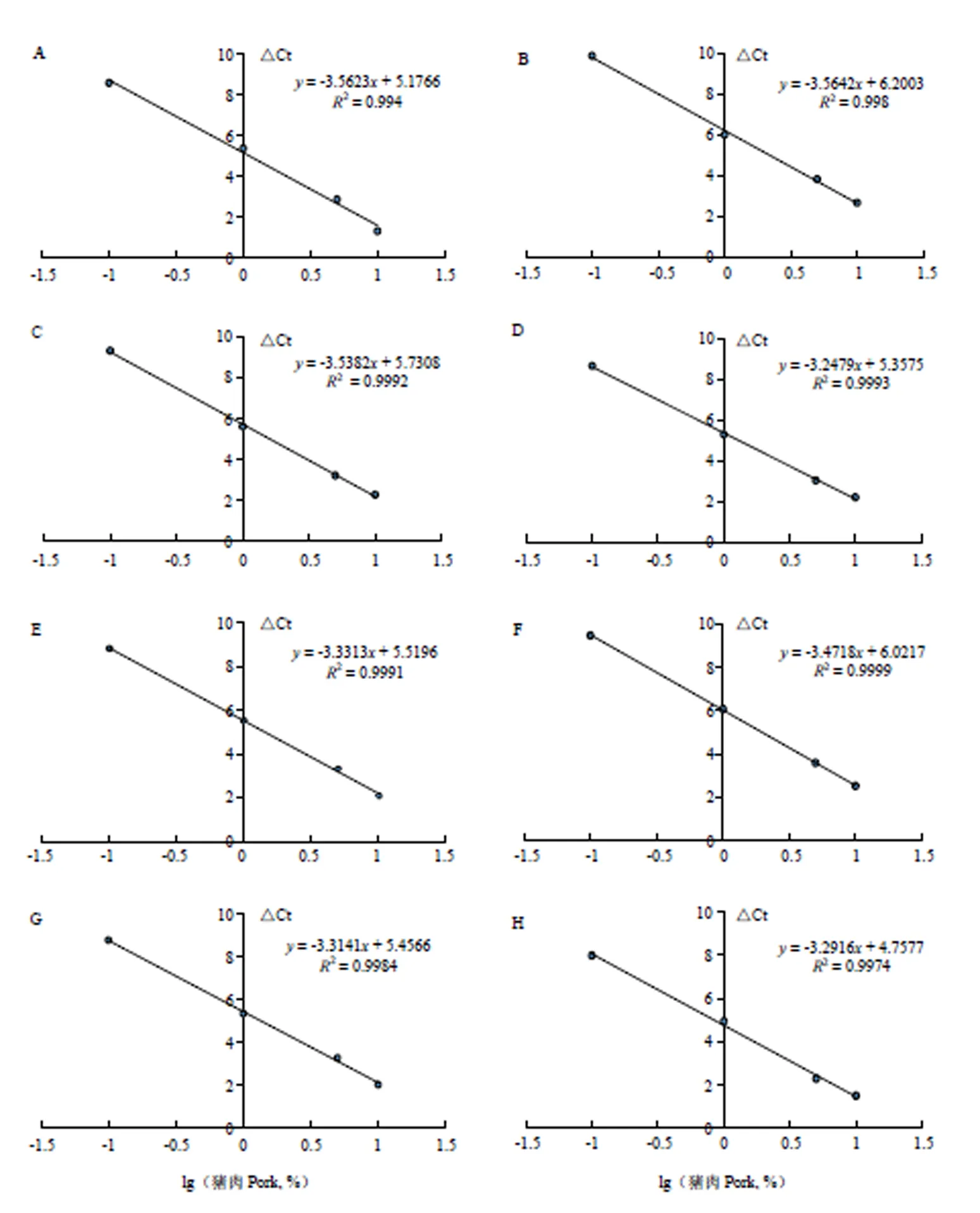
为了相对量化猪肉,基于定量PCR标准化扩增效率构建校准曲线是必需的。通过ΔCt与猪肉百分比的对数建立的8个定量校准曲线见图6。8个试验组的标准曲线均呈现出良好的线性关系,决定系数2分别为0.994、0.998、0.9995、0.9993、0.9991、0.9999、0.9984、0.9974,斜率在3.1—3.6。SYBR Green I定量PCR方法可以检测出牛肉中含量为0.1%—10%的猪肉,其覆盖至少3个数量级的线性动态范围,与Bustin等[21]PCR试验结果的范围基本一致。这8个试验组的标准曲线都可以达到相同的动态范围(0.1%—10%)和相对定量限(LOQ),相对LOQ为0.1%(w/w)。比较生肉组和其他试验组的数据发现,干、蒸、煮、炖、煎5个试验组的标准曲线比生肉组的标准曲线的截距分别高0.6、0.3、0.1、0.1、0.6个循环,而炸、烤试验组的标准曲线比生肉组的标准曲线的截距分别低0.1、0.4个循环,可见生肉的标准曲线与7种肉制品的标准曲线的截距之间存在约0.1—0.6个循环的差异,表明定量PCR 2个基因的扩增效率受热处理的影响有一定差异。
3 讨论
3.1 加工方式对猪肉及其肉制品中DNA质量的影响
商业肉制品一般都经过多道加工程序,肉质的理化性质发生很大变化,加工过程中添入的辅料和香辛料在很大程度上增加了物种检测的难度。在深度加工过程中,高温高压会导致原料DNA变性,遭到破坏。且在DNA提取过程中残留的酚类物质会抑制PCR反应,从而造成假阴性,影响后续试验的进行[22-23]。因此,从加工的肉制品中提取高质量的DNA模板是普通PCR和荧光定量PCR测定成功的关键步骤[24]。
生肉(A)、干制(B)、蒸制(C)、煮制(D)、炖制(E)、煎制(F)、炸制(G)、烤制(H)
生肉(A)、干制(B)、蒸制(C)、煮制(D)、炖制(E)、煎制(F)、炸制(G)、制烤(H);M:DL2000 Maker,N:阴性对照;泳道1-5:100%,10%,5%,1%,0.1%
本研究显示高温加工样品的DNA含量明显高于生肉样品。加工样品DNA的高含量可能与加工过程中高温处理有关,由于高温造成细胞膜通透性增加,从而使更多的DNA从个别的肌肉细胞释放;且DNA从双链到单链的变性会引起增色效应,该效应使得DNA溶液在UV光(260 nm)下的吸光度值增加,导致熟肉的DNA含量增加[25]。
DNA的完整性也是DNA质量的重要参数,可直接反映DNA片段的长度,而更长的片段可能有助于PCR扩增,因为它包含更多所需的扩增区域。琼脂糖凝胶电泳结果显示热处理明显影响DNA片段的完整性。有研究表明,将肉加热到100℃及其以上,会导致DNA片段大小减少72%以上[26],因此高温会严重影响DNA的完整性。虽然没有获得完整的DNA片段,但这些样品仍然可以用于PCR扩增。通过PCR扩增加工肉制品中所获DNA,也可以获得单一且清晰的PCR产物条带,从而为本研究后续运用PCR技术开展掺假检测研究奠定了基础。
3.2 加工方式对猪肉及其肉制品中PCR灵敏度的影响
对于热加工的产品,有研究表明高温导致DNA变性,被降解为小片段,推荐使用短扩增子[26]。与单拷贝或低拷贝核DNA基因相比,短扩增子可以增加DNA扩增的可能性,提高测定灵敏度[12]。因此,本研究中优化了PCR扩增条件,通过扩增肉中DNA,评估了热处理对敏感度的影响。普通PCR结果显示,加工肉产品受热处理的影响较大,随模板含量减少目的条带亮度也明显降低,且不同加工方式下的检测限均可达到0.005 ng,表明灵敏度检测可达到pg级。Kesmen等[27]试验结果显示,高压蒸后猪肉检测的灵敏度下降,而在烤熟肉制品中,灵敏度不受影响,与本研究结果基本一致,所以基于猪DNA模板的普通PCR反应是高度敏感的,可用于肉品掺假检测分析。
普通PCR凝胶电泳检测的结果不直观,而且容易产生假阳性[28]。与普通PCR比,实时荧光定量PCR具有准确性高、特异性强、灵敏度高等优点,在病原检测、食品卫生和物种测定等领域得到了广泛的应用,能有效避免交叉污染[29-30]。利用10倍连续稀释的猪肉DNA,进行定量PCR,以Ct值为纵坐标,以初始DNA 模板含量的lg值为横坐标建立标准曲线,8条标准曲线都具有良好的线性和相关性,PCR效率高。定量PCR检测结果与Sónia等[12]的研究结果一致,灵敏度最低检测限都达到了0.005 ng,说明该方法可用于肉制品的定量掺假检测。
生肉(A)、干制(B)、蒸制(C)、煮制(D)、炖制(E)、煎制(F)、炸制(G)、烤制(H)
3.3 牛肉制品中猪肉成分的定性定量检测
肉类掺假中经常出现用便宜的肉类和植物蛋白替代高价值的肉类,为了经济和健康的原因,防止使用较不理想的肉类物质掺入肉制品的研究是非常重要的[9]。我们使用基于DNA的普通PCR和定量PCR扩增来自线粒体基因的序列,评估热处理对掺假样品检测限的影响。普通PCR定性结果显示,除炸制(1%)外,其他试验组的最低检测限均为0.1%,在加工方式中,炸制具有最高的A260nm/A280nm值。然而,由紫外吸光度确定的这个结果可能由于增色效应而被高估。因此,与其他模板相比,炸制样品中提取的DNA产生的条带较弱,经验证,温度最高的炸制处理降低了由于DNA降解引起的敏感性,导致其扩增困难。除炸制外,其他几种热处理对普通PCR结果无明显影响,方法可以应用于肉制品的定性检测。
与普通PCR相比,定量PCR方法的主要优点是可以进行数据定量。为了开发一种较优的定量方法,物种特异性和内源性对照引物应联合使用。内源性对照的使用对于定量目的至关重要,特别是当考虑具有复杂组成的加工产品时。在本研究中,采用SYBR Green I染料的定量PCR方法,针对猪线粒体基因的内源片段(149 bp)与基于18S rRNA内参基因(140 bp)的内源对照组合扩增,有近似相同的效率。以ΔCt值为纵坐标,以猪肉百分比的对数为横坐标建立校准曲线,8条校准曲线均具有良好的线性关系,可以检测和定量分析0.1%—10%线性动态范围内的猪肉掺假,冯震等[31]和Sónia等[12]的最低检测限也为0.1%,与本研究结果一致。生肉与熟肉制品的标准曲线的截距之间存在约0.1—0.6个循环的差异,因此,相比于以生肉为例去鉴定种源成分,对于复杂工艺的肉制品,更建议使用热处理制成的标准曲线去定量。
4 结论
不同加工处理能够显著影响肉中DNA的含量、纯度和完整性,但不影响肉制品中DNA的检测限和灵敏度。定性PCR除炸制混合肉(为1%)外,混合生肉及其他6种混合肉制品的最低检测限均为0.1%,定量PCR的灵敏度均可达到0.1%,8种工艺的牛肉制品中均可检测到猪源性成分。本研究建立了牛肉及肉制品中猪源性成分的定性定量检测方法,两种方法都表现出高灵敏度和准确性,可应用于保障肉制品的纯正性。
[1] PRANDI B, LAMBERTIN F, FACCIN A, SUMAN M, LEPORATI A. Mass spectrometry quantification of beef and pork meat in highly processed food: Application on Bolognese sauce., 2017, 74: 61-69.
[2] 杨冬燕, 杨永存, 李浩, 杨小柯, 邓平建. 双重PCR鉴别牛、羊肉掺假. 中国卫生检验杂志, 2014, 24(23): 3379-3382.
YANG D Y, YANG Y C, LI H, YANG X K, DENG P J. Identification of adulteration in mutton and cattle by duplex PCR., 2014, 24(23): 3379-3382. (in Chinese)
[3] AMARAL J S, SANTOS G, OLIVEIRA M B P P, Mafra I. Quantitative detection of pork meat by EvaGreen real-time PCR to assess the authenticity of processed meat products., 2016, 72:53-61.
[4] 董洋洋. 实时荧光PCR对牛肉中掺入鸭肉和猪肉的定量检测研究[D]. 大庆: 黑龙江八一农垦大学, 2016.
DONG Y Y. Quantitative detection of duck and pork in beef by real- time fluorescence PCR [D].DaQing: Heilongjiang Bayi Agricultural University, 2016. (in Chinese)
[5] 王思伟, 张英杰. 利用动物肌肉组织进行物种鉴定方法的研究进展. 中国草食动物科学, 2014(S1): 42-45.
WANG S W, ZHANG Y J. Research progress in species identification using animal muscle tissue., 2014(S1): 42-45. (in Chinese)
[6] SOARES S, AMARAL J S, MAFRA I, OLIVEIRA M B P. Quantitative detection of poultry meat adulteration with pork by a duplex PCR assay., 2010, 85(3): 531-536.
[7] XIANG W, SHANG Y, WANG Q, XU Y C, ZHU P Y, HUANG K I. Identification of a chicken () endogenous reference gene () and its application in meat adulteration., 2017, 234: 472-478.
[8] IWOBIi A, SEBAH D, KRAEMER I, LOSHER C, FISCHER G, BUSCH U, HUBER I. A multiplex real-time PCR method for the quantification of beef and pork fractions in minced meat., 2015, 169: 305-313.
[9] CHENG J H, CHOU H T, LEE M S, SHEU S C. Development of qualitative and quantitative PCR analysis for meat adulteration from RNA samples., 2016, 192: 336-342.
[10] KIM M, YOO I, LEE S Y, HONG Y, KIM H Y. Quantitative detection of pork in commercial meat products by TaqMan® real-time PCR assay targeting the mitochondrial D-loop region., 2016, 210: 102-106.
[11] 侯东军, 杨红菊, 姜艳彬, 王海. PCR鉴定牛羊肉中搀杂猪肉的方法建立. 食品工业科技, 2009, 30(3): 328-330.
HOU D J, YANG H J, JIANG Y B, WANG H. Establishment of method for PCR detection of pig components in beef and mutton., 2009, 30(3): 328-330. (in Chinese)
[12] SOARES S, AMARAL J S, OLIVEIRA M B P, MAFRA I. A SYBR Green real-time PCR assay to detect and quantify pork meat in processed poultry meat products., 2013, 94(1): 115-120.
[13] HOU B, MENG X R, ZHANG L Y, GUO J Y, LI S W, HUI J. Development of a sensitive and specific multiplex PCR method for the simultaneous detection of chicken, duck and goose DNA in meat products., 2015, 101: 90-94.
[14] IWOBI A, SEBAH D, KRAEMER I, LOSHER C, FISCHER G, BUSCH U, HUBER I. A multiplex real-time PCR method for the quantification of beef and pork fractions in minced meat., 2015, 169: 305-313.
[15] 林彦星, 张彩虹, 阮周曦, 刘建利, 宗卉, 廖立珊, 孙洁, 杨俊兴, 吕建强, 花群义, 曹琛福. 实时荧光定量PCR检测畜禽肉制品中鸭源性成分. 动物医学进展, 2016, 37(11): 48-53.
LIN Y X, ZHANG C H, RUAN Z X, LIU J L, Zong H, LIAO L S, SUN J, YANG J X, LU J Q, HUA Q Y, CAO C F. A real-time fluorescent PCR for detection of duck-derived ingredients in meat products of livestock and poultry., 2016, 37(11): 48-53. (in Chinese)
[16] 刘岑杰, 刘彦泓, 杨滴, 夏元凤, 马颖颖, 贺峰, 赵辉. 肉制品中鸭源性成分的实时荧光PCR检测. 肉类工业, 2015(1): 51-53.
LIU C J, LIU Y H, YANG D, XIA Y F, MA Y Y, HE F, ZHAO H. Detection of components of duck origin in meat products with real- time PCR method., 2015(1): 51-53. (in Chinese)
[17] 张国华, 卢建雄, 蒲长宇, 王戊腾, 安得霞, 陈妍. 一种基于实时荧光PCR定量检测肉制品猪源性成分的方法: CN107043818A. 2017-08-15 [2018-05-10].
ZHANG G H, LU J X, PU C Y, WANG W T, AN D X, CHEN Y. A method for the quantitative detection of porcine-derived components of meat products based on real-time fluorescence PCR: CN107043818A. 2017-08-15 [2018-05-10]. (in Chinese)
[18] 张兰, 高天丽, 刘永峰, 赵晶, 廖晶, 库婷. 八种中式烹饪工艺对牛肉中多环芳烃、反式脂肪酸和亚硝酸盐的影响. 中国农业科学, 2017, 50(6): 1126-1138.
ZHANG L, GAO T L, LIU Y F, ZHAO J, LIAO J, KU T. Effects of eight Chinese style cuisine methods on polycyclic aromatic hydrocarbons, trans-fatty acids and nitrite of beef., 2017, 50(6): 1126-1138. (in Chinese)
[19] DOOLEY J J, PAINE K E, GARRETT S D, BROWN H M. Detection of meat species using TaqMan real-time PCR assays., 2004, 68(3): 431-438.
[20] FAJARDO V, GONZÁLEZ I, MARTIN I, ROJAS M, HERNÁNDEZ P E, GARCIA T, MARTIN R. Real-time PCR for detection and quantification of red deer (), fallow deer (), and roe deer () in meat mixtures., 2008, 79(2): 289-298.
[21] BUSTIN S A, BENES V, GARSON J A, HELLEMANS J, HUGGETT J, KUBISTA M, MUELLER R, NOLAN T, PFAFFL M W, SHIPLEY G L, VANDSOMPELE J, WITTWER C T. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments.,2009,55(4): 611-622.
[22] 宋君, 牛蓓, 王东, 游米沙, 尹全, 陶李, 刘勇, 雷绍荣. 两种蛋白质变性剂在转基因成分检测中的抑制作用. 西南农业学报, 2010, 23(5): 1770-1772.
SONG J, NIU B, WANG D, YOU M S, YIN Q, TAO L, LIU Y, LEI S R. Inhibiting effects of two types of protein denaturants in GMO detection., 2010, 23(5): 1770-1772. (in Chinese)
[23] SMITH D S, MAXWELL P W, DE BOER S H. Comparison of several methods for the extraction of DNA from potatoes and potato-derived products., 2005, 53(26): 9848-9859.
[24 ] LIAO J, LIU Y F, KU T, LIU M H, HUANG Y. Qualitative and quantitative adulteration identification of milk powder using the DNA with novel extraction method., 2017, 100(3): 1657-1663.
[25] MUSTO M, FARAONE D, CELLINI F, MUSTO E. Changes of DNA quality and meat physicochemical properties in bovine supraspinatus muscle during microwave heating., 2014, 94(4): 785-791.
[26] MUSTO M. DNA quality and integrity of nuclear and mitochondrial sequences from beef meat as affected by different cooking methods., 2011, 49(4): 523-528.
[27] KESMEN Z, GÜLLÜCE A, YILMAZ M, YETIMAN A, YETIM H. Taqman-Based duplex real-time polymerase chain reaction approach for the detection and quantification of donkey and pork adulterations in raw and heat-processed meats., 2014, 17(3): 629-638.
[28] 周云雷, 魏飞龙, 李健, 张小华, 蒋红霞. 鸡毒支原体实时荧光定量PCR检测方法的建立. 中国农业科学, 2011, 44(11): 2371-2378.
ZHOU Y L, WEI F L, Li J, ZHANG X H, JIANG H X. Development of real-time fluorescent quantitative PCR method for detection of.2011, 44(11): 2371-2378. (in Chinese)
[29] 孙炳剑, 陈清清, 袁虹霞, 施艳, 李洪连. SYBR Green I实时荧光定量PCR检测小麦纹枯病菌体系的建立和应用. 中国农业科学, 2015, 48(1): 55-62.
SUN B J, CHEN Q Q, YUAN H X, SHI Y, LI H L. Establishment of SYBR Green I real-time PCR for quantitatively detectingin winter wheat.,2015, 48(1): 55-62. (in Chinese)
[30] 李婷, 张益, 鲜思美, 包细明, 冯将, 李鹏飞. 山羊IFN-γ和TNF-α基因SYBR GreenⅠ实时荧光定量RT-PCR检测方法的建立及应用. 中国兽医科学, 2017, 47(10): 1292-1298.
LI T, ZHANG Y, XIAN S M, BAO X M, FENG J, LI P F. Establishment and application of SYBR GreenⅠreal-time fluorescence quantification RT-PCR for IFN-γ and TNF-α genes of goat.2017, 47(10): 1292-1298. (in Chinese)
[31] 冯震, 杨美成. 生鲜肉中牛源性和羊源性成分定量检测方法的建立. 食品安全质量检测学报, 2016, 7(3): 877-886.
FENG Z, YANG M C. Establishment of quantitative methods for detecting bovine-derived and ovine-derived materials in fresh meat.2016, 7(3): 877-886. (in Chinese)
(责任编辑 杨鑫浩)
Qualitative and Quantitative Detection Methods of Pork in Beef and Its Chinese Processing Products
ZHU Yang, LIU YongFeng, WEI Yanchao, SHEN Qian, WANG YiFan
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710062)
【Objective】The objective of this paper was to establish a qualitative and quantitative detection method for pork components in beef and Chinese processed products, so as to guarantee the purity of beef products. 【Method】The pig genomic DNA from pork and different processed pork products were extracted, and then effects of processing methods on pig DNA quality, sensitivity and detection limit were analyzed through DNA quality testing, PCR amplification and sensitivity test. The raw beef was prepared, and the dried, steamed, boiled fried, stewed and roasted beef products were mixed with the binary mixed meat of different proportions (10%, 5%, 1%, 0.1%) of pork, and then the qualitative and quantitative detections of common PCR and real-time PCR were carried out. The application of DNA in adulteration identification. 【Result】The DNA quality test results of different processing methods showed that different processing methods significantly affected the purity of DNA (<0.05). The DNA purity (A260nm/A280nm) ranged from 1.893 to 1.977 in raw pork and seven kinds of pork products, which were higher than the theoretical value of 1.8. The DNA content ranged from 110 to 277 µg·g-1, and the DNA content of the processed pork products was significantly higher than that of the raw pork treatment group (<0.05); Agarose electrophoresis showed that the DNA of raw pork and seven kinds of meat products was seriously degraded after 6 months of storage, but raw pork still obtained some unclear long-segment DNA, and the pig DNA of seven meat products all degraded into small fragments of DNA, indicating that long-term placement and heat treatment significantly affect the integrity of pig DNA; although the degradation of DNA in pork products was serious, the mitochondrial genes were amplified by ordinary PCR, and the PCR products of all samples were presented as clear and single bands. It could be seen that the DNA extracted from the processed meat product could be tested for sensitivity and adulteration; The sensitivity test results showed that the common PCR was highly sensitive. The 10-fold gradient dilution showed that the minimum detection limit of pig DNA extracted from the eight test group samples was 0.005 ng. The standard curve formed by fluorescence quantitative PCR amplification of pig DNA was also formed, which had a good linear relationship. The slope of the standard curve was between -3.1 and -3.7, the coefficient of determination2was greater than 0.99, the PCR amplification efficiency was between 89% and 100%, and the quantitative PCR could be detected 0.005 ng of pig DNA. Qualitative quantitative PCR test results of adulterated samples showed that the minimum detection limit of qualitative test for mixed raw meat and other six mixed meat products was 0.1% except for fried mixed meat (1%), indicating that ordinary PCR could detect trace amounts of pork composition. In the quantitative test of mixed meat, the coefficient of determination (2) of the standard curve of eight test groups established according to different adulteration ratios was more than 0.99, and the slope was -3.1--3.6. Each curve had a good linear relationship and could realize beef with quantitative detection of medium pork components. comparing the quantitative results of raw meat and meat products, there was a difference of about 0.1 to 0.6 cycles between the intercepts of the standard curve of mixed raw meat and mixed meat products. 【Conclusion】Different processing could significantly affect the content, purity and integrity of DNA in meat, but it did not affect the detection limit and sensitivity of DNA in meat products. Both ordinary PCR and quantitative PCR could detect the micro-content of adulterated meat. It could be seen that the detection method based on PCR technology had high sensitivity, high speed and high specificity, and the quantitative detection standard curve had high linear correlation and amplification efficiency, which could provide reliable quality control and inspection plan for meat industry and verification label declaration. The results could be applied to some commercial samples to ensure the purity of meat products.
beef; pork; processing technology; PCR; qualitative quantization; sensitivity
2018-05-10;
2018-07-25
国家自然科学基金(31372288)、陕西省科技统筹创新工程计划(2016KTCL02-36)、中央高校基本科研业务费专项(GK201805002)
朱扬,E-mail:393857602@qq.com。
刘永峰,E-mail:yongfeng200@126.com
10.3864/j.issn.0578-1752.2018.22.013