中药青天葵黄酮醇合成酶基因的克隆与生物信息学分析
2018-11-30黄琼林卓一南曾湘达詹若挺
黄琼林,卓一南,曾湘达,何 瑞*,詹若挺
(1.广东医科大学,广东 湛江 524023;2.广州中医药大学中药资源科学与工程研究中心,广东 广州 510006;3.岭南中药资源教育部重点实验室,广东 广州 510006)
【研究意义】岭南道地药材青天葵来源于兰科多年生植物毛唇芋兰Nerviliafordii(Hance) Schltr.,以叶片或全草入药,具有清肺止咳,清热解毒,散瘀消肿、镇静止痛等功效,在临床上治疗肺部疾病尤其是小儿呼吸道疾病的疗效显著[1]。青天葵萌发对环境要求苛刻,休眠期长(当年9月至次年4月),繁殖系数低,一颗球茎仅生长一片叶子,再加上人为的过度采挖,青天葵资源早已面临匮乏甚至濒危的困境,并在20世纪90年代被列入《中国南部石灰岩稀有濒危植物名录》[2]。青天葵的优质品种选育已成为当前青天葵资源可持续利用的重要课题。【前人研究进展】通过基因工程调控生物合成关键酶基因的表达来提高化学成分的积累被认为是植物或农作物品种选育和改善的有效途径之一,并已具有较为成熟的基础和广泛的应用。前期的化学分析和药理研究表明,黄酮类成分是青天葵的主要药效物质[3-4]。因此,调控参与青天葵黄酮生物合成的关键基因从而促进青天葵有效化学成分的合成,是改善青天葵品种、提高青天葵药用质量进而缓解青天葵资源严重短缺的可考虑途径之一。黄酮醇合成酶(flavonol synthase, FLS)是连接类黄酮合成途径和花青素合成途径的重要分支点和关键酶,它以二氢黄酮醇为底物,催化黄酮结构中的C3位发生羟基化,从而衍生一系列黄酮醇类化合物[5-6]。FLS基因的过表达可以有效地提高黄酮醇类化合物的积累。如,Zhou 等将茶树FLS基因在烟草中过量表达,转基因烟草中的槲皮素、槲皮素-3-O-葡萄糖苷和槲皮素-7-O-葡萄糖苷等黄酮醇及其衍生物、总黄酮含量均显著升高,而花青素的合成受到一定程度的抑制[7]。目前,FLS基因已从杜仲[8]、金银花[9]、葡萄风信子[10]等植物中克隆出来。在前期的青天葵转录测序研究中,作者曾挖掘得至1条长度为840 bp的黄酮醇合成酶的基因片段[11]。【本研究切入点】采用RACE-PCR技术克隆青天葵FLS基因,命名为NfFLS,并采用生物信息学分析此基因的序列特征以及预测其编码蛋白的和功能,【拟解决的关键问题】为NfFLS基因后续在青天葵植物中的功能鉴定并利用基因工程促进青天葵黄酮类成分的生物合成提供科学依据。
1 材料与方法
1.1 植物材料
青天葵植物样品由广西壮族自治区中药研究所黄云峰副研究员采摘于广西壮族自治区南宁市马山县,并鉴定为毛唇芋兰Nerviliafordii(Hance) Schltr.,移栽至广州中医药大学岭南中药资源教育部重点实验室栽培。
1.2 试剂
RNAiso Plus (total RNA提取试剂)、PrimeScript®RT reagent Kit with gDNA Eraser (Prefect Real Time)、SMARTer®RACE 5’/3’Kit、dNTPs Mixture、DNA 聚合酶和markers均购自宝日医生物技术公司;EZgeneTMGEL/PCR Extraction Kit购自美国Biomiga生物公司;pGEM-T克隆载体购自美国Promega生物公司;引物合成和测序由广州华大基因公司完成。
1.3 青天葵总RNA提取及cDNA合成
取适量的青天葵新鲜叶片置于灭菌研钵中,加液氮快速研磨成粉末状,按照RNAiso Plus试剂说明书提取总RNA,并采用琼脂糖凝胶电泳检测RNA完整性和纯度。根据实验目的,分别采用PrimeScript®RT reagent Kit with gDNA Eraser (Prefect Real Time)、SMARTer®RACE 5’/3’Kit制备用于NfFLS基因核心片段和编码区、RACE扩增所需cDNA。
1.4 引物设计
如表1所示,根据在转录组测序研究中获得的青天葵FLS基因片段的序列,设计本研究NfFLS基因克隆所需的引物。
1.5 NfFLS基因的核心片段扩增
PCR反应体系含10× ExTaqBuffer 10 μl,10 μM dNTPs Mixture 8 μl,10 μM FLSc-F 2.5 μl,10 μM FLSc-R 2.5 μl,5U/μl ExTaqDNA 聚合酶 1.2 μl,cDNA 4 μl,并用灭菌蒸馏水补充至100 μl。PCR扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸5 min。PCR产物经琼脂糖凝胶电泳检测和切胶回收后送样测序。
1.6 NfFLS基因的RCAE扩增
NfFLS基因的RACE扩增通过巢式PCR完成。5’端、3’端的第一轮RACE-PCR扩增分别以UPM Long/FLS5-1、FLS3-1/UPM Long为引物,反应体系和扩增程序均与核心片段的扩增相同。第二轮RACE-PCR扩增分别以相应的第一轮PCR产物为模板,以UPM short/FLS5-2、FLS3-2/UPM short为引物,反应体系与核心片段的扩增相同,扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。第二轮PCR产物经琼脂糖凝胶电泳检测后切胶回收。RACE-PCR产物与pGEM-T载体连接后,热击转化至E.coliTop10感受态细胞,采用载体通用引物对经菌液PCR筛选的阳性重组子进行测序。
1.7 cDNA全序列的拼接及编码区的克隆
采用DNAMAN软件比对拼接前面所获的NfFLS基因核心片段、5’端和3’端序列,得到该基因的cDNA全长序列。应用Omiga软件在cDNA序列中搜索开放阅读框(open reading fragment, ORF),并推导出氨基酸序列。将所获的氨基酸序列在NCBI的BLASTP(http://blast.ncbi.nlm.nih.gov/)工具中进行同源检索,检验其准确性和完整程度。
以FLSO-F/FLSO-R为引物扩增NfFLS基因的编码区,反应体系参考核心片段的扩增,但其中DNA聚合酶改用LATaq及其相应缓冲液替换ExTaq及其相应缓冲液进行反应,扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min。PCR产物与pGEM-T载体连接后,热击转化至E.coliTop10感受态细胞,采用载体通用引物对经菌液PCR筛选的阳性重组子进行测序。

表1 用于NfFLS克隆的引物信息
注:带*号引物为试剂盒自带,其他为自行设计。
Note: The primers labeled with * were originated from the kit, and the others were designed by authors.
1.8 NfFLS及其编码蛋白的序列分析和功能预测
使用ProtParam网站(http://web.expasy.org/protparam/)计算目的基因编码蛋白的氨基酸组成、相对分子量和等电点等理化;采用ProtScale网站(http://web.expasy.org/protscale/)分析蛋白质的亲/疏水性;通过SOPMA网站(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_ sopma.html)预测编码蛋白的二级结构;应用iPSORT网站(http://hc. ims.u-tokyo.ac.jp/iPSORT/)分析编码蛋白的亚细胞定位。使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)网站在线预测编码蛋白的跨膜结构域。利用NCBI进行编码蛋白的同源检索和功能域分析,并通过DNAMAN软件完成氨基酸序列的多重比对。
2 结果与分析
2.1 NfFLS基因的克隆和序列拼接
如图1所示,经PCR扩增出900 bp核心片段产物,通过巢式PCR分别扩增出约350和450 bp的5’端和3’端RACE-PCR产物。将上述PCR引物测得的序列进行拼接,获得1268 bp的NfFLS基因cDNA全长序列,其中包含48 bp的5’端非编码区,993 bp的ORF(即编码区)和198 bp的3’端非编码区,最后以polyA序列结尾。
图2所示,在获得的cDNA全长序列的基础上,设计用于扩增NfFLS基因编码区的引物FLSO-F/FLSO-R并进行扩增,得到与前述ORF大小相符的编码区产物。将该编码区产物克隆至pGEM-T载体并筛选阳性重组子进行测序,获得长度为993 bp的NfFLS编码区序列,并将其翻译成氨基酸序列。

1.核心片段扩增产物;2.5’端RACE-PCR扩增产物;3.3’端RACE-PCR扩增产物;4.编码区扩增产物;M.DL2000 marker,条带依上至下的大小分别为2000、1000、750、500、200、100 bp图1 NfFLS基因的PCR扩增Fig.1 Amplification of NfFLS gene

序列两端的ATG和TGA分别为编码区的启动密码子和终止密码子以及方框所示分别为引物FLSO-F、FLSO-R部分序列图2 NfFLS编码区核苷酸和氨基酸序列Fig.2 Nucleotide and amino acid sequence of NfFLS gene
2.2 NfFLS核苷酸及其编码氨基酸的理化性质分析
NfFLS编码区GC含量为54.2 %。编码蛋白含331个氨基酸,相对分子量为37.3 kDa。等电点为5.35,提示其属于酸性蛋白质。在氨基酸构成上,谷氨酸(Glu)和缬氨酸(Val)所占比例最高,分别达到10.3 %和10.0 %。蛋白质不稳定指数为35.56,小于40,说明其为稳定蛋白质。
2.3 NfFLS蛋白的亲/疏水性分析
NfFLS蛋白的亲/疏水性分析发现,NfFLS蛋白整体呈现为亲水性,并且不含明显的疏水区域,说明NfFLS为水溶性蛋白质。
2.4 NfFLS蛋白的保守功能域分析
NfFLS蛋白的保守功能域预测如图3所示,该蛋白(第1~331个氨基酸)包含1个黄酮醇合成酶(flavonol synthase)功能域,说明它具有黄酮醇合成酶的功能。此外,它还包含1个2OG-FeII_Oxy功能域(第194~292个氨基酸)和1个PcbC功能域(第39~308个氨基酸),表明NfFLS蛋白为α-同戊二酸依赖性双加氧酶(α-oxoglutarate-dependent dioxygenase)超家族和异青霉素N合成酶及相关双加氧酶(Isopenicillin N synthase and related dioxygenases)超家族成员。
2.5 NfFLS蛋白的跨膜结构域预测以及信号肽、转运肽分析
如图4所示,NfFLS蛋白的整条多肽链均位于细胞膜外,不含有跨膜结构域。亚细胞定位分析显示,NfFLS蛋白也不含信号肽、转运肽和目标肽,提示其为非分泌性蛋白质。

图3 NfFLS蛋白保守功能域Fig.3 Conserved domains of NfFLS protein
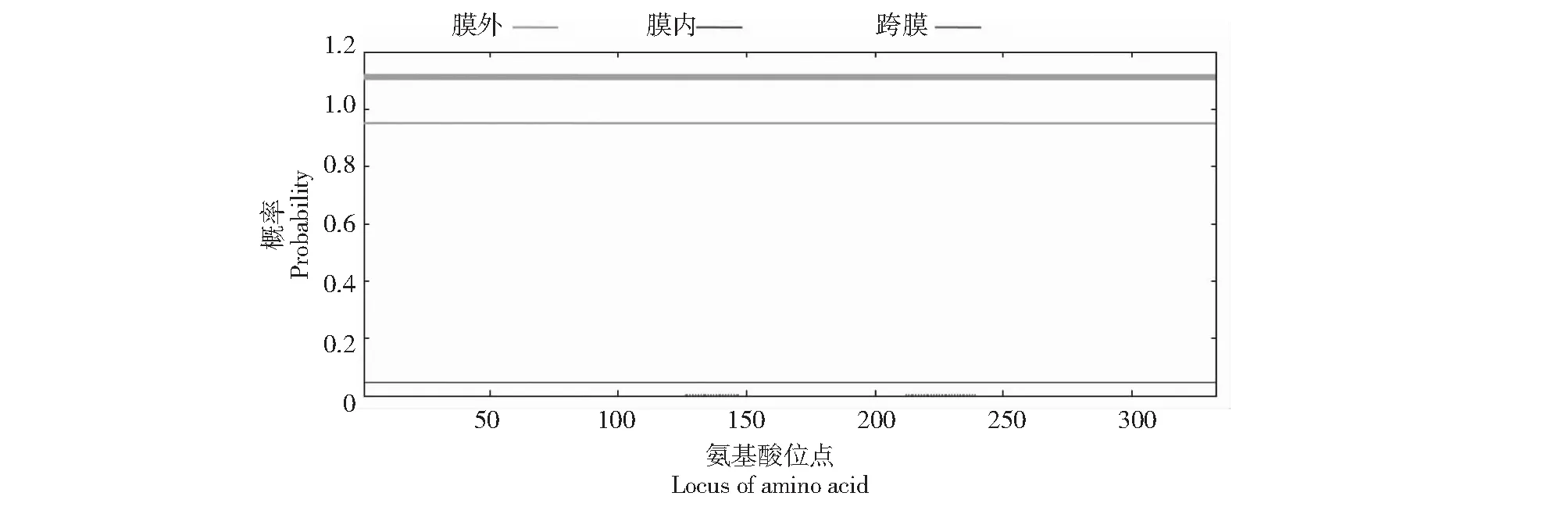
图4 NfFLS蛋白的跨膜结构域Fig.4 Transmembrane structural domain of NfFLS protein
2.6 NfFLS蛋白的二级结构分析
如图5(见封3)所示,NfFLS蛋白二级结构包含34.83 %的α-螺旋、36.04 %的随意卷曲、18.02 %的延伸链和的β-转角,表明NfFLS蛋白是由多种元件组成的混合结构型蛋白质。
2.7 NfFLS蛋白的同源比对和系统进化分析
如图6(见封3)所示,NfFLS与同科的铁皮石斛序列同源性最高,为82 %;与双子叶植物淫羊藿的同源性较低,序列相似度也达65 %,说明FLS蛋白在不同植物中的保守性较高,且从图中也可看见序列之间存在多处保守区域。
上述10种FLS蛋白的系统进化关系(图7),NfFLS与同为兰科植物来源的DcFLS、ChFLS首先聚在一起,然后再与单子叶植物来源的NtFLS和AcFLS形成一个分支,而其他双子叶植物来源的FLS则聚集成另外一个分支。10种FLS蛋白的系统进化关系与其来源植物的进化关系相一致,较好地反映了植物FLS的自然进化关系。
3 讨 论
目前,天然化学研究已经从青天葵中分离出30余种类黄酮化合物,主要为黄酮醇、黄酮及其苷,这些化合物是青天葵发挥抗肿瘤、抗炎、抗氧化和防治心血管疾病等药理活性的有效成分[12]。其中黄酮醇还参与抗紫外辐射、激素运输、花色性状等生理过程[13]。FLS作为类黄酮生物合成途径和调控黄酮醇化合物生物合成的关键酶,其编码基因的克隆和蛋白表达对青天葵黄酮类药效成分的积累以及品种优育具有重要的意义。转录组分析被认为是快速挖掘物种功能基因的高通量手段,尤其是无基因组参考物种[14-15]。本研究基于转录组测序挖掘到的青天葵FLS基因片段,设计高特异性引物和巢式PCR技术,经过一次实验就能得到NfFLS的核心片段并进而扩增出基因cDNA全长。相比传统的基因克隆方式,设计简并引物难度较大并需要多次PCR操作才能扩增出目的基因的核心片段,本研究通过转录组测序挖掘青天葵的功能基因具有较好的优势。本研究应用生物信息学方法分析发现,NfFLS基因编码包含331个氨基酸、分子量为35.3 KDa、不含有跨膜结构域和信号肽、定位于细胞质中的稳定性亲水性蛋白,NfFLS还具有植物黄酮醇所共享的保守结构域,并于其他植物来源的FLS蛋白具有较高的同源性。这些结论证实了NfFLS基因是青天葵黄酮醇合成酶的编码基因,并为后续青天葵FLS基因及其编码蛋白的功能鉴定和表达调控提供了理论依据。笔者曾对通过转录组测序获得的黄酮醇合成酶基因片段进行表达分析,采用RPKM(Read Per Kb per Million reads)[16]方法探讨该基因在青天葵叶片和球茎中的表达量差异。结果显示,该黄酮醇合成酶基因在叶片中的表达量高于在球茎中的表达量,提示黄酮醇合成酶基因倾向于在青天葵地上部分表达和发挥调控功能,这一组织表达特性也与烟草[17]、紫山药[18]等植物的FLS基因表达模式相同。由于本研究在此黄酮醇合成酶基因片段的基础上进行基因克隆,克隆得到NfFLS基因也完全包含该片段,再加上青天葵植物材料的短缺,因此,本研究没能够采用荧光定量PCR分析NfFLS在青天葵组织器官中的表达差异。
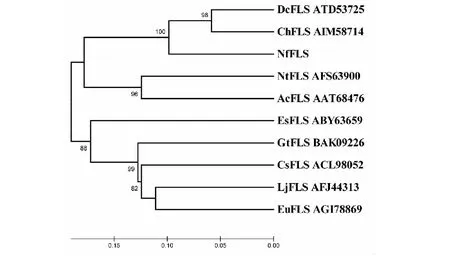
图7 10种植物FLS蛋白的系统进化树Fig.7 Phylogenetic tree of FLS proteins from 10 species
4 结 论
本研究成功克隆青天葵的类黄酮生物合成途径关键酶基因NfFLS,该基因编码区长度为993 bp,编码331个氨基酸,其编码蛋白具有黄酮醇合成酶保守功能域、与铁皮石斛等兰科植物来源FLS蛋白的同源性可达82 %。本研究为利用FLS基因调控青天葵黄酮类药效成分积累,从而改良青天葵的种质,促进濒危药材青天葵的可持续性利用奠定了基础。
