宫颈癌患者Th1/Th2细胞因子的表达及其预后意义
2018-11-29季菲,何艳,杨丽,丁岩,杜蓉
季 菲,何 艳,杨 丽,丁 岩,杜 蓉
(新疆医科大学第一附属医院妇科,乌鲁木齐 830054)
宫颈癌是目前女性患者易发的恶性肿瘤。目前研究认为高危型人乳头瘤病毒(HPV) 感染可促进宫颈癌病变发生,正常情况下患者具有一定的抵抗病毒感染的能力,但部分患者在HPV的刺激下会产生宫颈上皮内瘤变(CIN),并可能恶化发展为宫颈癌,这表明患者的免疫功能对宫颈癌的发病有重要的调控作用[1]。患者的临床症状主要表现为经期不调、接触性出血、阴道炎[2]。因此研究宫颈癌的特异性临床症状与影响临床预后的因素对患者的治疗有重要价值。已有研究表明,T淋巴细胞主导的细胞免疫对机体产生的肿瘤细胞有调控作用[3-4]。辅助性T淋巴细胞(Th)可分泌多种淋巴因子,能增强其他种类的免疫细胞活性,提升机体的整体免疫功能,可以协调细胞毒性T淋巴细胞对免疫反应的抑制作用[5]。本研究通过研究宫颈癌患者血清中Th1/Th2细胞因子与宫颈癌的临床相关性,以期为宫颈癌患者的临床治疗提供一定的指导,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2015年6月至2017年6月在本院接受治疗的90例宫颈癌患者,患者经术前宫颈活检证实且在术后通过病理切片分析确诊,年龄27~61岁,平均(42.5±9.7)岁。依据国际妇产科联盟(FIGO)分期标准[6],其中Ⅰ、Ⅱ、Ⅲ期的患者分别是31、37、22例,以患者的临床分期进行分组。纳入标准:(1)入选患者未经放疗及化疗治疗,均为首次在本院确诊并接受抗肿瘤治疗;(2)患者知情且签署同意书。排除标准:(1)患者在其他单位确诊并接受过抗肿瘤治疗;(2)患者合并其他重大代谢疾病,如肝功能异常、糖尿病、心血管疾病等。同时选取本院同期体检的30例健康女性作为对照组。
1.2主要试剂和仪器 人淋巴细胞分离液购自北京索莱宝科技有限公司;抗人白细胞介素(IL)-2、IL-4和抗人干扰素(IFN)-γ抗体购自美国eBioscience公司;HPV DNA引物购自上海生工生物公司;AccuriTMC6流式细胞仪购自美国BD公司;超纯水系统购自美国MILLIPORE公司;iMark酶标仪购自美国伯乐公司;超低温冰箱购自日本三洋公司;光学显微镜购自德国Leica公司;A550石蜡切片机购自德国MEDITE公司。
1.3方法
1.3.1HPV亚型检测 取宫颈癌患者的宫颈上皮细胞收集液1.2 mL,以12 000 r/min转速离心5 min后,加入细胞裂解液120 μL,混匀后100 ℃ 10 min,按照DNA提取说明书分离HPV DNA备用。依据待检的HPV基因特点(HPV16、HPV18、HPV31、HPV33)设计相应的PCR引物,采用PCR扩增不同的HPV基因片段,按照HPV分型试剂盒说明书与相应的分型探针杂交,判读宫颈癌患者感染的HPV亚型。
1.3.2流式细胞术检测宫颈癌患者外周血Th1/Th2细胞比例 对宫颈癌患者空腹静脉取血6 mL,并加入EDTA抗凝处理,以1 500 r/min离心10 min,取上清液冷冻保存备用。将离心后的血细胞加入等体积磷酸盐缓冲液(PBS),均匀稀释后加入淋巴细胞分裂液,1 500 r/min离心20 min,下层为血细胞,上层主要为血浆,中层液体呈白色雾状,即为单个核细胞层(PBMC),将其置于37 ℃含5% CO2培养箱培养5 h,分别采用IFN-γ-APC、IL-4-PE-cy5对其进行Th1细胞和Th2细胞表面标记,洗涤后弃上清液,用PBS洗涤2次后,PBS 200 μL重悬细胞,采用流式细胞仪检测。
1.3.3免疫组织化学试验 组织标本采用甲醛固定后进行石蜡包埋。对石蜡标本连续切片,厚度为4 μm,温水展开后置于玻片上,65 ℃烤片30 min,然后依次置于二甲苯和梯度浓度的乙醇中水化,加入抗原修复液后微波炉烘烤15 min,加入3%过氧化氢液阻断内源性过氧化物,最后采用二氨基联苯胺(DAB)溶液显色,最后中性树脂封片,由经验丰富的病理医师评估IL-2、IL-4、IFN-γ水平。
1.3.4酶联免疫吸附试验(ELISA)检测血清的相关淋巴因子 按照ELISA试剂盒说明书处理样品,每孔50 μL血清样品,将反应板在37 ℃孵育60 min。然后采用洗涤液清洗反应板3次后,加入相应酶标抗体试液50 μL孵育30 min,用洗涤液清洗后加入底物工作液50 μL反应20 min,最后加入60 μL终止液,操作酶标仪读取样品的吸光度值(A值)。
2 结 果
2.1宫颈癌患者HPV亚型分布 在诱发宫颈癌的前4位HPV亚型感染率方面,宫颈癌患者HPV亚型分布与对照组相比有明显差异(P<0.05)。不同FIGO分期患者HPV亚型分布有明显差异(P<0.05)。见表1。

表1 各组HPV亚型分布特点[n(%)]
a:P<0.05,与对照组比较;b:P<0.05,与Ⅰ期比较;c:P<0.05,与Ⅱ期比较

表2 各组外周血中Th1、Th2细胞的比例
a:P<0.05,与对照组比较;b:P<0.05,与Ⅰ期比较;c:P<0.05,与Ⅱ期比较

A:对照组;B:Ⅰ期;C:Ⅱ期;D:Ⅲ期;其中分析时采用CD4+细胞设门,FITC-CD4+和PE-IFN-γ+双阳性细胞即Th1细胞表示。A、B、C和D图中第1象限百分数表示对照组、Ⅰ期、Ⅱ期、Ⅲ期患者外周血中Th1细胞的频率

A:对照组;B:Ⅰ期;C:Ⅱ期;D:Ⅲ期;其中分析时采用CD4+细胞设门,FITC-CD4+和PE-IL-4+双阳性细胞即Th2细胞表示。A、B、C和D图中第1象限百分数表示对照组、Ⅰ期、Ⅱ期、Ⅲ期患者外周血中Th2细胞的频率
2.2患者外周血中Th1、Th2细胞比例 Th1与Th2细胞比例在Ⅰ期、Ⅱ期和Ⅲ期患者间比较均差异有统计学意义(P<0.05)。其中Th1细胞在Ⅰ期患者中比例较高(P<0.05)。Th2细胞比例在Ⅲ期患者中比例较高(P<0.05)。见表2,图1、2。
2.3免疫组织化学方法检测组织标本中免疫因子的表达 IFN-γ、IL-2在Ⅲ期患者中的阳性率为31.8%、36.7%,较对照组下降较大(P<0.05);Ⅲ期患者IL-4的阳性率为72.7%,与对照组相比上升较大(P<0.05),见表3、图3。

表3 各组标本组织中IFN-γ、IL-2、IL-4的表达水平检测[n(%)]
a:P<0.05,与对照组比较

图3 各组标本中IFN-γ、IL-2、IL-4表达的典型代表图(×200)
2.4不同FIGO分期患者中各免疫因子表达水平的比较 Ⅲ期患者IL-4水平高于Ⅰ期和Ⅱ期患者(P<0.05);Ⅱ期患者IFN-γ、IL-2水平低于Ⅰ期患者(P<0.05)。不同FIGO分期患者IFN-γ、IL-2水平均低于对照组(P<0.05),IL-4水平均高于对照组(P<0.05)。见表4。
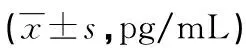
表4 ELISA检测各组血清中IFN-γ、IL-2、IL-4的表达水平
a:P<0.05,与对照组比较;b:P<0.05,与Ⅲ期比较;c:P<0.05,与Ⅰ期比较
3 讨 论
宫颈癌发病机制较为复杂,主要是患者的遗传背景和外界生活环境等因素在特定条件下诱发的。Th是可以合成多种免疫因子的淋巴细胞,近年来越来越多的研究关注Th在人体免疫系统发挥的功能。免疫因子在体内可以发挥多种细胞学功能,如促进相关的淋巴细胞分化和成熟[7]。同时各类免疫因子在体内可相互调节和制约,有效稳定体内免疫功能。有研究发现Th2细胞亚群细胞因子水平上升,可干扰体内的细胞免疫功能,使肿瘤细胞发生免疫逃逸。Th1细胞亚群分泌IFN-γ和IL-2,可有效刺激细胞免疫活力,当Th1功能较强时,机体的细胞免疫可有效抑制肿瘤细胞的活力[8]。Th2主要分泌IL-4等细胞因子,可参与体液免疫反应,体内分泌较多的Th2细胞因子后,细胞免疫的抗肿瘤能力受到削弱,Th1/Th2失衡可使肿瘤细胞发生逃避免疫监视,诱发患者病情恶化,通过检测Th1/Th2细胞因子分泌水平,可分析Th1/Th2细胞亚群功能状态[9]。因此,探讨宫颈癌患者相关淋巴细胞免疫活性的变化可为宫颈癌的治疗夯实理论基础。
目前临床研究表明,HPV感染和宫颈癌病变密切相关[10]。PENG等[10]发现,宫颈癌组患者高危型HPV感染率可达85.45%,HPV干扰淋巴细胞的正常功能,刺激宫颈上皮细胞的异常增殖。HANPRASERTPONG等[11]研究发现在胃肠道肿瘤患者不同Th细胞比例的变化与癌基因相关的特异转录因子表达有密切关系,进而参与调控肿瘤信号通路。孟建华[12]通过流式细胞术,检测了103例宫颈癌患者外周血中的Th1/Th2比例,发现分化等级较高的宫颈癌患者Th1比例下降,Th2比例上升。本研究发现,Th1细胞比例在Ⅰ期宫颈癌患者中较高,Th2细胞比例在Ⅲ期宫颈癌患者中较高,这与以往研究一致[13-14]。通过免疫组织化学试验发现IFN-γ、IL-2在Ⅲ期患者中的阳性率分别为31.8%、36.7%,较对照组下降明显,患者肿瘤分级上升,IFN-γ、IL-2阳性率逐步下降,IL-4阳性率逐步上升。BREBI等[15]在研究宫颈癌前病变和宫颈癌组织中IFN-γ、IL-2等淋巴因子表达水平变化时,发现其与患者病程变长和临床分期升高呈负相关,这与本研究一致。张晓姗等[16]发现Th1可合成并分泌IFN-γ、IL-2等细胞因子,可促使免疫功能紊乱,削弱免疫系统对癌细胞的杀伤能力;Th2可合成分泌IL-4因子,促使Th1/Th2细胞因子分泌失衡,引起宫颈上皮细胞分裂周期失控,与本研究结果一致。梁毓等[17]在胃癌患者的外周血中检测到IFN-γ、IL-2等细胞因子水平的降低,IFN-4水平的上升,刺激患者NK细胞水平下降,从而削弱患者的免疫功能,促进肿瘤细胞生长。有研究表明,IFN-γ、IL-2可调控促癌基因的异常表达,加速癌细胞的增殖[18]。本研究通过ELISA发现Ⅲ期宫颈癌患者血清中IL-4水平高于Ⅰ期和Ⅱ期患者(P<0.05);Ⅲ期患者IFN-γ、IL-2水平低于Ⅰ期和Ⅱ期患者(P<0.05)。已有研究发现患有肺癌、乳腺癌或胃癌等肿瘤的患者Th1/Th2比例异常,引起其分泌的免疫因子水平有较大的变化,对肿瘤细胞的生长有较大的刺激作用,可增强其免疫逃避的功能,这表明Th1、Th2分泌的细胞因子与肿瘤异常生长有内在联系,这与本研究一致[19]。本研究的数据表明,Th1/Th2细胞因子可反映患者的免疫功能状态,有助于患者的临床诊断。同时需研究Th1/Th2细胞因子影响肿瘤细胞免疫逃避的具体机制,为相关抗肿瘤药物开发提供试验支持。
综上所述,宫颈癌患者Th1/Th2比例异常,Th1分泌的IFN-γ、IL-2水平下降,Th2分泌的IL-4水平上升,与宫颈癌的病变关系密切,为进一步研究打下基础。
