丙泊酚对氧糖剥夺导致PC12细胞损伤的保护机制
2018-11-29祁爱花王爱忠
祁爱花,王爱忠,王 莉
(1.上海健康医学院附属第六人民医院东院麻醉科 201306; 2.上海交通大学附属第六人民医院麻醉科 200233)
大脑是体内对缺氧最敏感的器官之一,围术期缺氧缺血可能导致神经损伤和功能丧失。应激活化蛋白激酶 (SAPK)/Jun 氨基末端激酶 (JNK)被认为是一种应激活化蛋白激酶,可以活化caspase蛋白酶级联和激活c-Jun磷酸化,并可作为缺氧缺血性脑损伤的早期标志物[1]。因此,SAPK/JNK信号通路是神经药物保护氧糖剥夺(OGD)损伤细胞的重要靶点。某些药物(如褪黑素、五味子素A和小檗碱)通过SAPK/JNK信号通路保护OGD损伤的神经细胞[2-4];然而丙泊酚是否可以通过SAPK/JNK信号通路降低OGD导致的细胞凋亡,迄今仍不明确。本文用丙泊酚处理OGD损伤的神经元样鼠嗜铬细胞瘤(PC12)细胞,通过观察细胞活力和蛋白表达,探讨丙泊酚对神经元样PC12细胞的保护作用及机制。
1 材料与方法
1.1细胞培养 PC12细胞购自中国科学院上海细胞库。将细胞培养在含有5%胎牛血清(Gibco/Life Technologies Ltd.,苏格兰)和10%马血清(Gibco/Life Technologies Ltd.,苏格兰)的RPMI-1640培养基(Gibco/Life Technologies Ltd.,苏格兰)中,并将其放在37 ℃恒温、加湿的培养箱中。神经元样PC12细胞OGD模型:将培养物转移到无葡萄糖的RPMI 1640培养基中,并置于具有流入和流出阀门的无氧培养箱(S.E.Barburos Metalicos S.A,西班牙)中,然后将箱内注入0.5% O2、5% CO2和95% N2的混合气体长达48 h。在放入无氧培养箱前1 min,用3种浓度丙泊酚(1、5、10 μmol/L)和10%脂肪乳剂处理细胞。
1.2细胞活力测定 将细胞接种在96孔板中,并通过四基甲偶氮唑蓝(MTT)测定细胞活力。细胞在暴露于OGD后1、6、12、24、48 h后,在常规培养基中于37 ℃下与MTT(100 μg/mL)一起温育。4 h后,洗涤细胞,然后加入100 μL二甲亚砜(DMSO)溶解。使用酶联免疫吸附测定仪(Life Science)在570 nm监测产物形成。
1.3cleaved-caspase-3免疫细胞化学染色 处理后的细胞在室温下用4%多聚甲醛(Sigma,美国)固定20 min,并加入0.1%Triton X-100透化15 min。然后将细胞与cleaved-caspase-3抗体(1∶500,Cell Signaling,Danvers,MA)一起孵育1 h。最后用BX-51荧光显微镜(Olympus Corporation,日本)在5个随机选择的连续区域(5个区域/组)中计数的阳性细胞数目。
1.4Western blot 细胞处理后,4 ℃磷酸盐缓冲液PBS洗涤并裂解。将总蛋白提取物离心,收集上清液。 使用Bradford蛋白测定法测定蛋白质浓度。样品在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离,并转移到聚偏氟乙烯(PVDF)膜上。在5%的无脂牛奶中室温下封闭1 h;在4 ℃下用Bcl-2、cleaved-caspase-3、磷酸化SAPK/JNK和c-Jun的特异性抗体孵育过夜; 并在室温下与辣根过氧化物酶连接的山羊抗兔免疫球蛋白G孵育1 h。用增强的化学发光(ECL)检测蛋白质。用Quantity One密度分析软件(Bio-Rad)定量蛋白质条带。
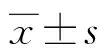
2 结 果
2.1PC12细胞形态变化 PC12细胞在未添加7S-NGF的培养液中,生长缓慢,树突短,见图1A;添加7S-NGF的细胞培养液将PC12细胞分化为神经元样细胞株,约95%的细胞新生树突为细胞体直径2倍以上,见图1B。
2.2神经元样 PC12细胞活性变化 神经元样PC12细胞OGD损伤12 h后,观察到约70%的细胞损伤,见图2A;OGD+5 μmol/L丙泊酚处理PC12细胞12 h后,细胞活力明显增加(P<0.05);OGD+10 μmol/L丙泊酚处理PC12细胞12 h后,细胞活力增加最为显著(P<0.01),见图2B。
2.3神经元样PC12细胞凋亡情况 OGD组凋亡细胞数高于正常对照组(P<0.01),OGD+丙泊酚组凋亡细胞数低于OGD组(P<0.01),见图3A、B。OGD组cleaved-caspase-3的表达明显高于正常对照组(P<0.05);OGD+丙泊酚组cleaved-caspase-3的表达明显低于OGD组(P<0.05),OGD组Bcl-2的表达明显低于正常对照组(P<0.05);OGD+丙泊酚组Bcl-2的表达明显高于OGD组(P<0.05),见图3C、D。

A:光镜下未添加7S-NGF培养的PC12细胞;B:光镜下添加7S-NGF培养的PC12细胞
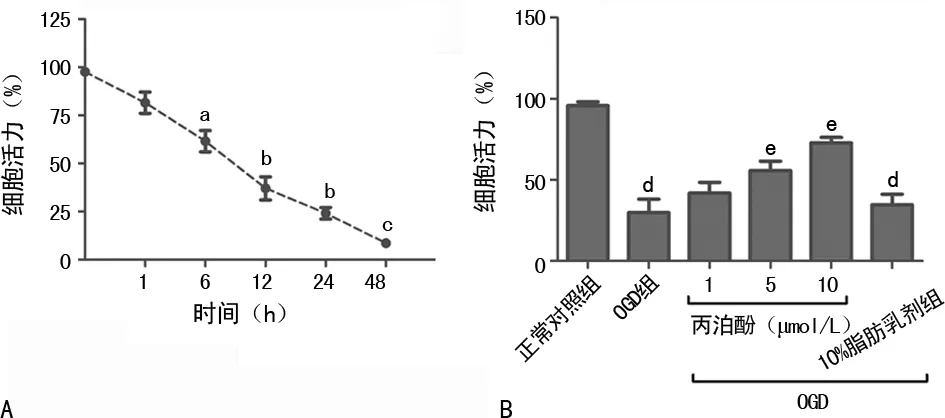
A:神经元样PC12细胞OGD损伤;B:药物处理OGD损伤的神经元样PC12细胞;a:P<0.05,b:P<0.01,c:P<0.001,与0 h组比较;d:P<0.01,e:P<0.05,与OGD组比较

A:免疫细胞化学染色法显示cleaved-caspase-3阳性细胞;B:随机选择的连续区域(5个区域/组)中计数的阳性细胞数目;C:Western blot检测;D:cleaved-caspase-3和Bcl-2蛋白组间比较;a:P<0.01,与正常对照组比较;b:P<0.05,与OGD组比较
2.4细胞磷酸化SAPK/JNK和c-Jun的蛋白表达水平 OGD组磷酸化SAPK/JNK和c-Jun的表达明显高于正常对照组(P<0.05);OGD+丙泊酚组磷酸化SAPK/JNK和c-Jun的表达明显低于OGD组(P<0.05),见图4。

A:Western blot检测;B:phospho-SAPK/JNK和phospho-c-Jun蛋白组间比较;a:P<0.05,b:P<0.01,与正常对照组比较;c:P<0.05,与OGD组比较
3 讨 论
本研究的主要发现是丙泊酚通过抑制SAPK/JNK-c-Jun信号通路在OGD诱导的PC12细胞损伤过程中发挥保护作用。
PC12细胞是研究神经保护药物的有效模型[5-6],本文用添加7S-NGF的细胞培养液分化PC12细胞为神经元样细胞株。95%的细胞新生树突为细胞体直径2倍以上,即为分裂后期的神经元样细胞株,用于实验。本研究结果表明,神经元样PC12细胞经OGD处理后细胞活力明显降低,呈时间依赖性;损伤12 h后,观察到约70%的细胞损伤,所以选择12 h用于实验。
本研究发现,丙泊酚显著降低OGD诱导的细胞损伤。SHU等[7]也发现高剂量丙泊酚可以减少脑梗死体积和脑水肿,该结果与本文的实验结果部分一致。但是,孙茫等[8]研究发现,低氧环境下丙泊酚可通过氧化应激损伤增加神经元样PC12细胞的凋亡,但其具体机制仍不清楚。所以,又进一步观察了凋亡蛋白caspase-3和抗凋亡蛋白Bcl-2的表达,结果发现,丙泊酚能明显抑制cleaved-caspase-3的水平和增强Bcl-2的表达。本研究也对丙泊酚的溶媒脂肪乳剂效应进行了观察,发现等同于最高浓度(10μmol/L)丙泊酚所含的脂肪乳剂没有明显降低OGD导致的细胞损伤,说明丙泊酚保护神经元样PC12细胞的效应是药物本身引起的,与脂肪乳剂无关。
本实验结果表明,丙泊酚降低了OGD诱导的磷酸化SAPK/JNK的表达,这与TABAKMAN等[9]的研究结果相似,他们发现药物可以通过SAPK/JNK通路阻止OGD诱导的神经元损伤。然而,也有研究报道,药物保护OGD导致神经元的损伤机制可能是阻断ERK和p38的激活,但不抑制JNK磷酸化[10]。以上研究显示,不同的药物对OGD诱导的细胞死亡发挥不同的保护机制,这些保护机制可能与激活不同转录因子有关,如激活转录因子2(ATF2)、Ets和c-Jun及胱天蛋白酶级联。本研究结果显示,用OGD+丙泊酚处理的细胞中,磷酸化c-Jun的表达水平低于OGD组。实验证据表明,丙泊酚保护神经元样PC12细胞的作用与SAPK/JNK-c-Jun有关。
综上所述,丙泊酚对OGD导致神经元样PC12细胞损伤的保护作用与SAPK/JNK-c-Jun信号通路有关。这一实验结果为进一步分析丙泊酚对缺血缺氧造成的神经元损伤的保护作用提供了理论依据。
