小电导钙激活钾通道在人心房中的增龄性变化
2018-11-29余奕言何容芳于风旭范学慧李妙龄
余奕言,何容芳,于风旭,范学慧,张 娟,李 涛,李妙龄△
(1.医学电生理学教育部重点实验室/医学电生理四川省重点实验室/西南医科大学心血管医学研究所,四川泸州 646000;2.西南医科大学附属医院心脏外科,四川泸州 646000)
心房颤动(atrial fibrillation,AF)已成为全球重大的公共卫生问题,据不完全统计,直到2010年,全球AF患者已达到33.5亿[1]。且除了AF自身的危害以外,还会增加卒中及心力衰竭的发病率以及致死率。AF是临床最为常见的持续性心律失常,一般人群发病率为1%~2%,80 岁以上可高达8%。在所有AF患者中,70%的AF患者年龄在65~85 岁。对1999-2001年我国AF住院患者病因分析显示,老年58.1%、高血压病40.3%、冠心病34.8%、心力衰竭33.1%、风湿性心脏病23.9%;阵发性AF占33.7%、持续性AF占16.7%、永久性AF占49.5%[2]。老年和高血压所占比例排前两位,是AF的独立危险因素。
小电导钙激活钾(SK2)通道是近期发现的一种对细胞胞内钙敏感的一类钙激活钾通道[3]。SK2通道主要在心房上表达,在心房复极末期发挥重要作用。众多研究支持SK通道的结构与功能变化与AF的发生与发展密切相关[4-7],参与了AF电重构过程。本课题组前期研究报道,AF时SK通道的功能明显增强[8]。AF的发生随年龄增加明显增加,因此本研究旨在探究是否随着年龄的增加,SK2通道功能会发生改变,进而增加AF的发生率,为阐明AF的发生和治疗提供新的思路和新的靶点。
1 材料与方法
1.1材料
1.1.1取材 选取在西南医科大学附属医院心脏外科进行体外循环的不同年龄段(<40岁、40~60岁、>60岁)窦性心律(SR)患者的新鲜右心耳组织。所有受试者均签署知情同意书,且获得西南医科大学伦理委员会的同意,所有程序均遵照国内相关法律法规。
1.1.2主要试剂 Ⅴ型胶原酶、ⅩⅩⅣ型胶原酶、牛血清清蛋白、Apamin均购于Sigma公司,Rever Tra Ace q RT-PCR Master Mix逆转录试剂盒购于Toyobo公司,SYBR Green定量PCR试剂盒购于Qiagen公司,其余试剂均为国产分析纯。
1.1.3主要仪器 低温高速离心机购于Thermo Fisher公司,PCR仪、Real-time PCR仪购于Applied Biosystems公司,全功能酶标仪购于NanoDrop公司,凝胶成像系统购于Bio-Rad公司。微管电极拉制仪(PC-10,Narishige,日本)用于拉制玻璃微电极、膜片钳放大器(EPC-10,HEKA,德国)用于全细胞膜片钳记录。
1.2实验方法
1.2.1人心房肌细胞急性酶分离方法 将手术室中快速取回的心房组织置于培养皿中氧饱和的心肌转运液(牛磺酸 10 mmol/L,腺苷 5 mmol/L,硫酸镁8 mmol/L,HEPES 10 mmol/L,磷酸二氢钾50 mmol/L,甘露醇100 mmol/L,葡萄糖140 mmol/L,用氢氧化钾调pH值至7.4)中清洗并将心房组织剪为约1 mm3的小块,再将组织块置于酶液Ⅰ(蛋白酶、胶原酶和牛血清清蛋白)于37 ℃水浴中消化约50 min,再将心房组织转移至酶液Ⅱ(胶原酶、清蛋白)中进行消化,随时观察细胞状态,一般约5~8 min,低倍视野下出现3~5个细胞即可终止酶液Ⅱ消化,重复酶Ⅱ消化3次。以上所有过程均保持组织处于持续充氧状态。收集3次消化的酶液并离心5 min (500 r/min),离心后去除上清液加入KB液 (牛磺酸10 mmol/L,β-羧基丁酸10 mmol/L,磷酸二氢钾10 mmol/L,氯化钾20 mmol/L,HEPES 10 mmol/L,EGTA 10 mmol/L,甘露醇5 mmol/L,葡萄糖 25 mmol/L,谷氨酸钾 70 mmol/L,清蛋白1 mg/mL,用氢氧化钾调pH值至7.4) 重悬后4 ℃保存,1 h后可用于电生理实验[9]。
1.2.2全细胞膜片钳技术 倒置相差显微镜下选取呈杆状、横纹清楚、无收缩且贴壁良好的心房肌细胞进行电生理的实验,实验电极选用硬质玻璃且用微管电极拉制仪通过两步法拉制而成,充灌电极后电极阻抗为2~5 Ω。采用膜片钳放大器(EPC-10,HEKA)记录电流信号,用Patch Master软件采集数据,采样频率为10 kHz,低通滤波频率为2 kHz。记录SK通道电流(ISK),电流保持电位-60 mV,指令电压从-130 mV到+60 mV,Ramp刺激时间持续500 ms。可记录到一内向整流特性的钾电流,在此基础上加入SK通道特异性阻断剂Apamin后电流明显减小,加药前后相减的电流为SK通道电流。记录电流的细胞外液(N甲基氨基葡萄糖 140 mmol/L,氯化钾 4 mmol/L,氯化镁 1 mmol/L,葡萄糖 5 mmol/L,HEPES 10 mmol/L,用盐酸调pH值至7.4);电极液 (葡萄酸钾144 mmol/L,氯化镁 1.55 mmol/L,HEPES 10 mmol/L,EGTA 5 mmol/L,用氢氧化钾调至7.2)。
1.2.3Western blot检测心房组织中SK2通道蛋白的表达
1.2.3.1总蛋白的提取 将获取的心房组织剪碎清洗,液氮研磨后加入RAPI裂解液(含蛋白酶抑制剂)在冰上裂解30 min,再用细胞破碎仪处理2 min。 4 ℃ 12 000 r/min离心15 min。用BCA法测蛋白浓度后加入5×Loading Buffer 99 ℃变性10 min 置于-20 ℃备用。
1.2.3.2Western blot 制备分离胶与浓缩胶,待胶凝固后上样、电泳、转膜、封闭。一抗4 ℃孵育过夜。第二天室温孵育二抗1 h。再用TBST清洗,Bio-RAD凝胶成像系统显影,采用Quantity One 软件进行数据分析。
1.2.4qRT-PCR检测心房组织中KCNN2基因的表达
1.2.4.1组织RNA提取 将获取的心房组织剪碎清洗,加入Trizol后用液氮研磨,加入氯仿后涡旋振荡混匀,室温静置5 min后离心。离心后取出上层水相并加入异丙醇离心后沉淀RNA。弃上清液,加入75%乙醇清洗后挥干,加入DEPC水吹打混匀,用全功能酶标仪检测mRNA水平。
1.2.4.2引物的设计 根据GenBank中KCNN2、β-actin的引物序列来设计引物,引物序列见表1。

表1 KCNN2及β-actin引物序列
1.2.4.3逆转录获得cDNA的第一链 将RNA统一标化为500 ng/μL,用Toyobo逆转录试剂盒进行逆转录,取1 μL总RNA,反应体系为10 μL,反应条件为37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min,4 ℃保存。
1.2.4.4实时荧光定量PCR 荧光定量采用SYBR Green(QIAGEN公司)试剂盒,反应体系为20 μL,反应条件为95 ℃预变性3 min,95 ℃变性10 s,57℃退火10 s,72 ℃延伸10 s,共40个循环。

2 结 果
2.1病历资料 本研究中<40岁组患者22例,40~60岁组患者34例和>60岁组患者18例,<40岁组的患者中主要以先天性心脏病(简称先心病)为主,而40~60岁组和>60岁组患者主要以二尖瓣或主动脉瓣病变为主,各组心脏的基础性疾病及用药的差异,见表2。

表2 患者资料

续表2 患者资料
相同年龄段患者心房组织存在共用情况,故导致不同实验中例数不完全一致
2.2急性酶分离的心肌细胞 两步酶法分离出的人心房肌细胞在显微镜下呈杆状,细胞膜光滑,折光性好,横纹清楚,不收缩,活性好(图1A);细胞表面光滑平整或有一处多处小凹陷(图1B),但并不影响封接破膜,均适宜做下一步的膜片钳实验。

A:横纹清晰的人心房肌细胞;B:细胞有凹陷的人心房肌细胞

A:<40岁组加入Apamin 前后电流原始记录图; B:40~60岁组加入Apamin 前后电流原始记录图;C:>60 岁组加入Apamin 前后电流原始记录图;D:各组电流密度-电压关系曲线(Ⅰ~Ⅴ曲线);加药前后电流相减即为SK2通道电流
2.3老年患者心房肌细胞SK2通道电流的变化 记录SK2通道电流的电极内液的游离钙离子浓度为5×10-7mol/L,保证SK通道的充分激活。<40岁组 (n=16个细胞,来自8例患者心房)与40~60岁组(n=20个细胞,来自8例患者心房)比较差异无统计学意义(P>0.05),<40岁组与>60岁组(n=18个细胞,来自10例患者心房)比较,在多个膜电位水平(电压从-130 mV到-80 mV、+50 mV到+60 mV)电流幅度明显增加(P<0.01或P<0.05)。40~60岁组(n=20)与>60岁组(n=18)比较,在多个膜电位水平(电压从-130 mV到-80 mV、+50 mV到+60 mV)电流幅度均明显增加(P<0.01或P<0.05)。见图2。
2.4人心房组织SK2蛋白的表达 与<40岁组(n=12)比较,40~60组(n=18)和>60岁组(n=10)SK2通道蛋白的表达均有所增加,但只有与>60岁组比较蛋白表达差异有统计学意义(P<0.05);40~60组(n=18)与>60岁组(n=10)比较差异也有统计学意义(P<0.05)。见图3。
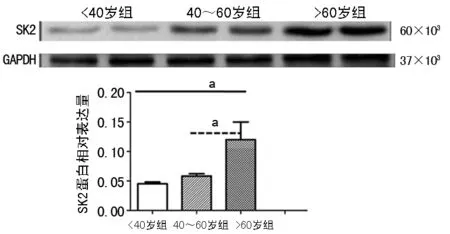
a:P<0.05
2.5荧光定量PCR检测心房组织KCNN2基因的表达变化 荧光定量PCR结果显示,与<40岁组(n=12)比较40~60岁组(n=18)和>60岁组(n=10)KCNN2基因表达均有所增加,但只有>60岁组KCNN2基因表达上调差异有统计学意义(P<0.05);40~60岁组(n=18)和>60岁组(n=10)比较KCNN2基因表达差异也有统计学意义(P<0.05)。见图4。

a:P<0.05
3 讨 论
AF是临床最为常见的心律失常,心房电重构和结构重构是AF发生和维持的重要病理基础。这些异常是由不同的病理生理学机制引起的,而AF发生的机制至今还未清楚。流行病学资料显示AF的发生与患者的年龄密切相关,老龄很有可能是易于导致AF的重要原因,研究老龄患者的心房电重构,对临床上指导老龄患者用药具有重要的参考价值。统计资料显示,因心律失常住院的患者中,约1/3的人是因为AF。对大多数人来说,40岁以后发生AF的风险接近25%[10],而且随着年龄的增加风险指数也随之增加。尽管AF没有带来毁灭性的伤害,但是它会大大降低人们的生活质量及增加脑卒中的风险[11-13]。多种临床危险因素如高龄、高血压、糖尿病、吸烟、心衰、肥胖等,还有一些心电图和超声心动图的特性变化及一些生物化学的标志蛋白的变化都与发生AF风险增加有关。而在2014年美国心脏协会心AF动治疗指南中,将高龄列为AF发生的第一危险因素[14]。有研究表明,在<60岁的受试者中,AF的发生率男性为0.78%、女性为0.76%。而在≥60岁的受试者中,男性、女性AF的发生率均增加为1.83%[15]。
小电导钙激活钾通道是一类对细胞内游离钙离子敏感而对膜电位不敏感的钾通道[16]。2007年OZGEN等[17]发现快速电刺激可导致SK通道蛋白从细胞内向膜上转运导致心肌复极加速,第一次提出SK参与心房电重构。2009年LI等[18]研究发现,SK2基因敲除小鼠易发生AF,但却没有出现室性心律失常。2010年DINESS等[19]在乙酰胆碱结合电刺激诱发的AF模型上发现,AF发生后给予SK通道的阻滞剂可预防和终止AF的发生,且对心房具有明显的靶向性。这些研究表明,SK通道在AF的发生中发挥重要作用,小电导钙激活钾通道是新近发现在心脏中发挥重要功能作用的一类钾通道。近年来,越来越多的人关注这类通道,因为它可能作为心房特异性选择的靶点。所以抑制SK通道的表达可能作为AF治疗的新靶点[10]。
本研究结果表明,在急性酶分离的细胞中记录到Apamin敏感的SK2电流。老年患者心房肌的SK2通道电流明显增加,并伴随着基因和蛋白的表达同时上调,表明随着年龄的增加,SK2通道的功能明显增强。从而为增龄与AF发生间的相关性提供了新的依据。随着年龄的增加,心房SK2通道表达增加,可能是引起AF发生存在的底物,其具体的机制还有待进一步的探索。本研究未选取动物模型作为实验对象,而是直接选取临床上3个年龄阶段(<40岁、40~60岁和>60岁)窦性心律患者的心房组织,更具有临床指导意义。为探究高龄与AF间关系的机制提供新的思路,为AF的治疗和预防提供新的方向。
