紫草素对银屑病T淋巴细胞增殖、活化的影响
2018-11-29赵京霞
刘 欣 赵京霞 王 燕 李 萍
(首都医科大学附属北京中医医院/北京市中医研究所,北京,100010)
银屑病中医称之为“白疕”,是一种临床常见的难治性疾病,该病属于具有一定遗传背景的自身免疫性疾病,异常活化的T淋巴细胞及其释放的细胞因子是银屑病发病的核心环节。中医认为,“血分蕴毒、热毒入血伤络”是银屑病发病的主要病机[1],治疗上多以凉血解毒为法,凉血活血胶囊就是在该思想指导下由首都医科大学附属北京中医医院创制的治疗银屑病血热证的院内制剂。前期工作证明,凉血活血胶囊不仅能够显著改善患者的红斑、浸润及瘙痒等症状、降低外周血炎性反应递质水平,其全方及拆方组分还可显著抑制体外T淋巴细胞的过度增殖、活化,体现出明显的免疫抑制及抗炎作用。紫草为凉血活血胶囊中的君药,具有凉血活血解毒的多重作用。为进一步研究凉血解毒类药物对银屑病的治疗作用机制,本研究选择紫草的主要活性成分紫草素作为研究对象,试图观察其对活化T淋巴细胞增殖、活化、释放细胞因子的影响,并利用中药单体对相关信号转导通路做初步研究。
1 材料
1.1 细胞 Jurkat E6-1 T淋巴细胞株:中国医学科学院协和细胞资源中心,37 ℃、5%CO2常规培养条件下用含10%的胎牛血清(Fetal Bovine Serum,FBS)的PRIM 1640培养基培养,连续培养3 d进行传代。
1.2 试剂 紫草素(shikonin)标准品(中国药品生物制品鉴定所);佛波醇酯(phorbol 12,13-dibutyrate,PDB)(美国Sigma公司,货号P8139);离子霉素(Ionomycin,IM)(美国Sigma公司,货号I9657);CCK-8检测试剂盒(日本同仁化学研究所,货号JG659);CD69抗体(美国BD公司,货号341652);白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)Instant ELISA检测试剂盒(美国Bender公司,货号分别为:BMS221HS,BMS228HS,BMS223HS);BCA蛋白定量试剂盒(美国Thermo Fisher公司,货号:23227);山羊抗兔IgG(H+L)、山羊抗小鼠IgG(H+L)远红外标记二抗(美国KPL公司,货号分别为:072-07-15-06,072-07-18-06);p-c-Jun(Ser 63)、p-核因子-κB p65单克隆抗体(美国Cell Signaling Technology公司,货号分别为:9261P,3033)。
1.3 PCR引物 引物均由上海生工合成。见表1。
1.4 仪器 超净工作台(北京东联哈尔仪器制造有限公司),CO2培养箱(MCO-20AIC型SANYO日本),流式细胞仪(FACSCalibur,美国BD公司),荧光定量PCR仪(美国ABI7500应用生物系统公司),电泳仪、电转仪(美国Bio-Rad公司),细胞破碎仪(HD3100型,德国Bandlin公司),酶标仪(美国Multiskanspeetrum Thermo公司),Odyssey双色红外扫描仪(美国Gene Company Limited)。
2 方法
2.1 药品制备 紫草素先用二甲基亚砜(Dimethylsulphoxide,DMSO)溶解,然后用乙醇进行稀释,临用前以磷酸盐缓冲液(phosphate buffer solution,PBS)将溶液中DMSO含量稀释至1‰以下,乙醇含量稀释至10%以下,如在稀释过程中出现紫草素析出,采用超声使其完全溶解。
2.2 紫草素浓度筛选 CCK-8法检测。将细胞浓度调至1×105/mL接种于96孔板中,每孔100 μL;以终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM刺激活化细胞,同时加入终浓度分别为0.25 μg/mL、0.5 μg/mL、1 μg/mL、2 μg/mL和4 μg/mL的紫草素置于37 ℃、5%CO2培养箱中48 h;检测前4 h,每孔加入10 μLCCK-8,酶标仪450 nm波长处检测吸光度值。选择对正常细胞无毒性且具有一定药效学作用的浓度范围作为后续实验的应用剂量。
2.3 紫草素对活化的T淋巴细胞活性的影响 CCK-8法检测。将细胞浓度调至1×105/mL接种于96孔培养板中,每孔100 μL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM刺激活化细胞,同时加入由2.2确定剂量的紫草素。37 ℃、5%CO2条件下培养48 h,检测前4 h,每孔加入10 μLCCK-8,酶标仪450 nm波长处检测吸光度值。每组设6个复孔,实验重复3次。
2.4 紫草素对活化的T淋巴细胞表达CD69的影响 流式细胞术检测。将细胞浓度调至2×105/mL接种于12孔板中,每孔1.5 mL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM,同时加入由2.2确定剂量的紫草素,37 ℃、5%CO2培养24 h。收集细胞并每组加入10 μL anti-CD69-PE,4 ℃冰箱避光孵育30~40 min。流式细胞仪检测CD69阳性细胞表达率。每组设2个复孔,实验重复3次。
2.5 紫草素对活化的T淋巴细胞分泌白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)的影响 酶联免疫吸附试验(ELISA)检测。将细胞浓度调至1×106/mL加入12孔板中,每孔1 mL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM,同时加入由2.2确定剂量的紫草素,37 ℃、5%CO2条件下培养至48 h;离心收集细胞上清液,严格按ELISA试剂盒说明书步骤操作。每组设2个复孔,实验重复3次。
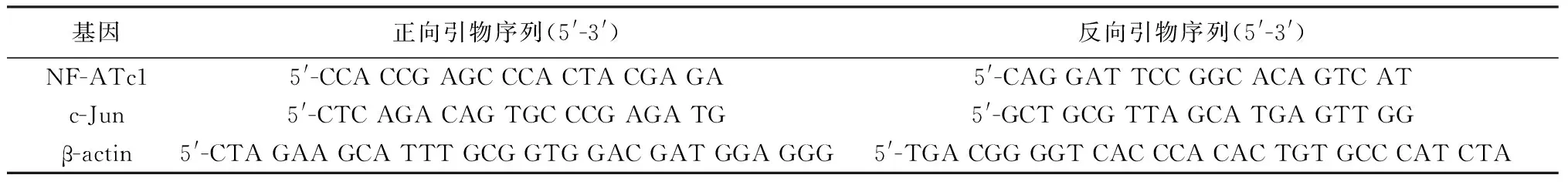
表1 引物序列及产物大小
2.6 紫草素对活化的T淋巴细胞内游离[Ca2+]i的影响 流式细胞术检测。将细胞浓度调至5×105个/mL接种于6孔板中,每孔1.5 mL;加入终浓度分别为2×10-7mol/L PDB和5×10-7mol/L的IM,同时加入由2.2确定剂量的紫草素,37 ℃、5%CO2条件下培养16 h;收集细胞并加入浓度为5 μmol/L的Fluo-3AM 100 μL,37 ℃避光孵育30 min;洗去未结合染料,流式细胞仪检测细胞内游离Ca2+的荧光强度。每组设2个复孔,实验重复3次。
2.7 紫草素对活化的T淋巴细胞内蛋白激酶C(PKC)磷酸化蛋白水平的影响 ELISA检测。将细胞浓度调至1×106/mL接种于6孔板中,每孔3 mL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM刺激活化细胞,同时加入由2.2确定剂量的紫草素,37 ℃、5%CO2条件下培养24 h,裂解细胞提取蛋白。ELISA操作步骤严格按照试剂盒说明书进行。每组设2个复孔,实验重复3次。
2.8 紫草素对核转录因子NF-AT和AP-1组分c-Jun mRNA表达的影响 q-PCR法检测。将细胞浓度调至1×106个/mL接种于6孔细胞培养板中,每孔3 mL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM及确定剂量的紫草素,37 ℃、5%CO2条件下培养24 h。收获细胞,提取细胞总mRNA并进行逆转录,实验操作按产品说明书进行。采用SYBR Green标记,ABI 7500型荧光定量PCR仪检测40个循环,采用2-△△CT法进行目的基因的相对定量分析。每组设2个复孔,实验重复3次。
2.9 紫草素对核转录因子AP-1组分c-Jun及核因子-κB蛋白表达的影响 Western blotting法检测。将细胞浓度调至1×106/mL接种于细胞培养瓶中,每瓶7 mL;加入终浓度分别为2×10-7mol/L的PDB和5×10-7mol/L的IM,及由2.2确定剂量的紫草素,37 ℃、5%CO2条件下培养24 h。离心收集细胞,裂解、提取总蛋白,BCA法蛋白定量。将聚丙烯酰胺凝胶中的蛋白质电泳转移到聚偏氟乙烯(PVDF)膜上,分别与p-c-Jun(1∶500)/p-核因子-κB-p65(1∶2000)/β-actin(1∶2000)一抗4 ℃孵育过夜。再与羊抗兔或羊抗鼠远红外标记的二抗(1∶10000稀释)室温孵育1.5 h。Odyssey双色红外扫描仪进行条带扫描。实验重复3次。

3 结果
3.1 紫草素对活化的T淋巴细胞活性的影响 实验结果显示,4 μg/mL的紫草素将T淋巴细胞的活性降低至正常水平以下,与对照组比较,差异有统计学意义(P<0.05),表现出对细胞具有杀伤毒性;2~0.5 μg/mL的紫草素均可显著抑制经PDB+IM刺激活化的T淋巴细胞的活性,降低细胞增殖率,抑制率分别达到31.51%、26.45%和26.45%,与模型组比较,差异有统计学意义(均P<0.05);而浓度为0.25 μg/mL的紫草素对活化的T淋巴细胞未表现出抑制作用,与模型组比较,差异无统计学意义(P>0.05),显示不出药效。见表2。
因此,后续实验选择2~0.5 μg/mL作为紫草素的应用浓度。
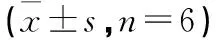
表2 紫草素对活化T淋巴细胞活性的影响
注:与模型组比较,*P<0.05;与对照组比较,△P<0.05
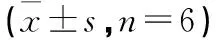
表3 紫草素对T细胞活化标志CD69表达的影响
注:与模型组比较,*P<0.05;与对照组比较,△P<0.05
3.2 紫草素对T细胞活化CD69表达的影响 本实验用0.5~2 μg/mL的紫草素作用于经PDB和IM活化的T淋巴细胞,结果显示各浓度紫草素均可显著降低T淋巴细胞表面CD69的表达率,与模型组比较,差异有统计学意义(P<0.05),其抑制率分别为38.44%、61.18%和65.7%,平均降幅达55%。其中,以2 μg/mL的抑制作用最为明显,其次为1 μg/mL,0.5 μg/mL的紫草素抑制率最低,呈现一定的量效关系。见图1、表3。
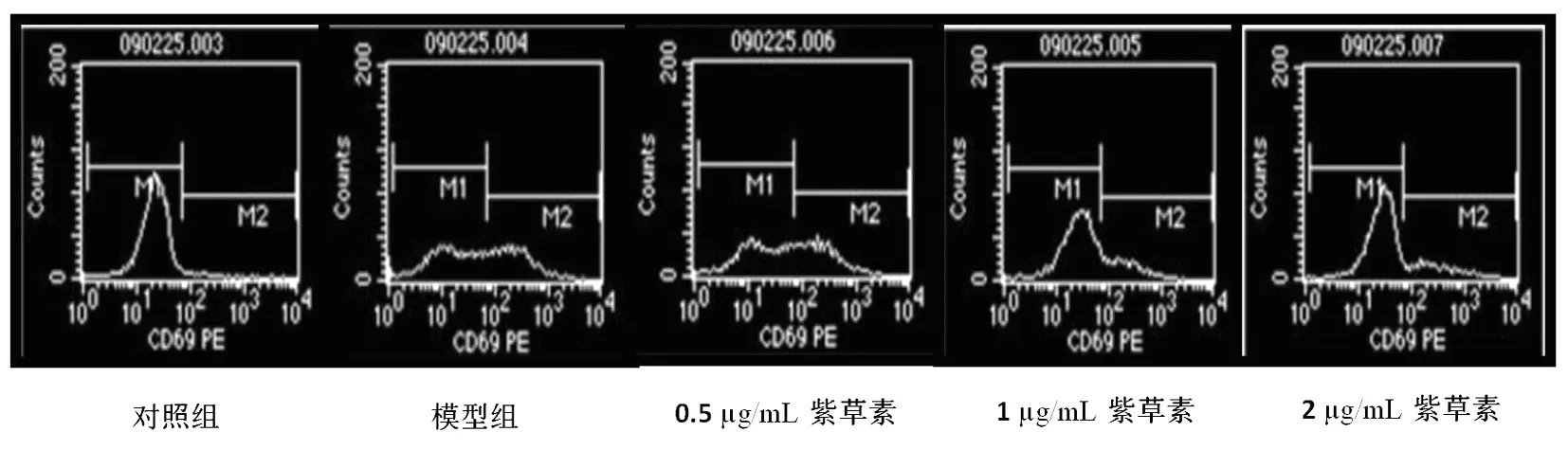
图1 紫草素对T细胞活化标志CD69表达的影响
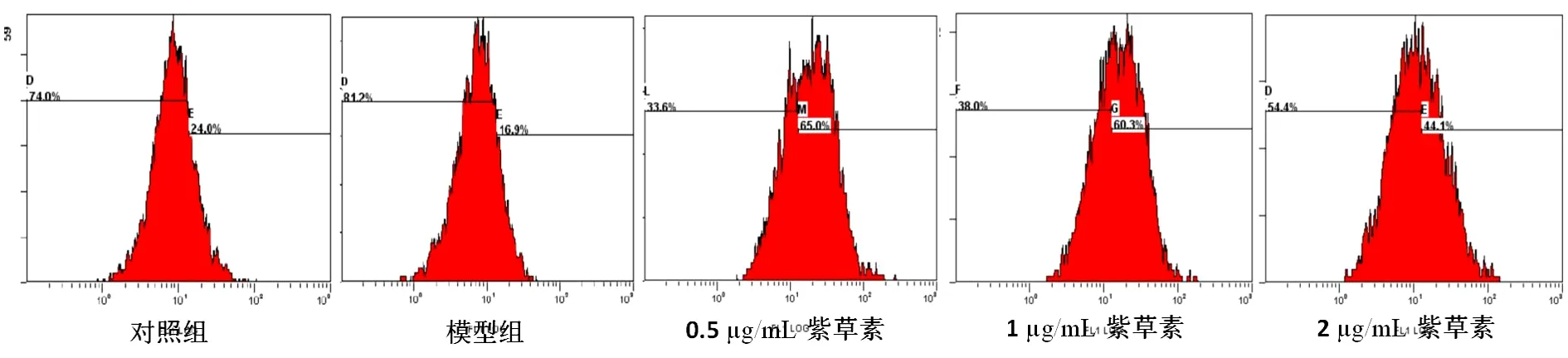
图2 紫草素对活化的淋巴细胞中[Ca2+]i的影响
3.3 紫草素对活化T细胞分泌INF-γ的影响 以0.5~2 μg/mL的紫草素作用于活化的T淋巴细胞,均可显著降低其INF-γ的分泌,分别为41.88%、61.51%、68.63%,与模型组比较,差异有统计学意义(P<0.05),表现出一定的量效关系;其中以2 μg/mL紫草素的下调作用最为显著,但其水平仍高于未活化细胞,与对照组比较,差异有统计学意义(P<0.05)。见表4。
3.4 紫草素对活化T细胞分泌IL-2的影响 本实验中,0.5 μg/mL、1 μg/mL和2 μg/mL的紫草素均可显著降低活化T淋巴细胞分泌IL-2的能力,与模型组比较,差异有统计学意义(P<0.05);以2 μg/mL的下调作用最为明显,其抑制率可达74.74%,有效地抑制了细胞因子的过度释放;0.5 μg/mL和1 μg/mL的紫草素对IL-2的抑制率分别为40.82%和50.83%,均不及2 μg/mL的作用,可见药物浓度越高抑制作用越强。见表4。
3.5 紫草素对活化T细胞分泌TNF-α的影响 本实验所用0.5 μg/mL、1 μg/mL和2 μg/mL的紫草素均可显著抑制活化的T淋巴细胞分泌TNF-α,其抑制率分别为19.63%、23.55%、49.34%,与模型组比较,差异有统计学意义(P<0.05),药物浓度越高则抑制率越高。其中2 μg/mL紫草素的抑制作用最为明显,该组TNF-α的水平与对照组水平相当,与对照组比较,差异无统计学意义(P>0.05),说明该浓度药物具有很好地抑制TNF-α分泌的功效,可将细胞调节至活化前水平;0.5 μg/mL和1 μg/mL的紫草素虽也可有效降低T淋巴细胞分泌TNF-α的水平,但与对照组比较其水平仍过高,与对照组比较,差异有统计学意义(P<0.05)。见表4。
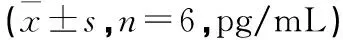
表4 紫草素对活化T细胞分泌TNF-α和IL-2、INF-γ的影响
注:与模型组比较,*P<0.05;与对照组比较,△P<0.05
3.6 紫草素对活化T淋巴细胞内游离[Ca2+]i变化的影响 结果显示,活化后的T淋巴细胞内Ca2+荧光强度明显升高,Ca2+峰明显右移,活化后胞内游离Ca2+浓度较静息状态提高近300%,与对照组比较,差异有统计学意义(P<0.05)。0.5 μg/mL、1 μg/mL和2 μg/mL紫草素组细胞的Ca2+浓度较模型组均有所降低,其抑制率分别为18.18%、31.11%和64.84%,与模型组比较,差异有统计学意义(P<0.05),降幅与药物浓度正相关。见图2、表5。
3.7 紫草素对胞质PKC磷酸化蛋白水平的影响 实验结果表明,经活化后T淋巴细胞内的PKC磷酸化蛋白水平明显上升,比对照组提高62.28%,与对照组比较,差异有统计学意义(P<0.05)。1 μg/mL和2 μg/mL的紫草素作用于细胞后,均可明显降低其PKC磷酸化蛋白的水平,降幅分别为16.82%和21.4%,与模型组比较,差异有统计学意义(P<0.05);而0.5 μg/mL紫草素组的磷酸化蛋白的水平仅比模型组降低9.65%,与模型组比较,差异无统计学意义(P>0.05)。见图2、表5。
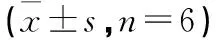
表5 草素对活化T淋巴细胞中[Ca2+]i及PKC磷酸化蛋白水平的影响
注:与模型组比较,*P<0.05;与对照组比较,△P<0.05
3.8 紫草素对T淋巴细胞核转录因子NF-AT mRNA表达的影响 本实验中模型组核转录因子NF-AT的mRNA大量表达,比对照组表达量提高2倍多(P<0.05)。经不同浓度紫草素作用后的细胞,mRNA表达量均显著下降,其降幅分别为31.71%、32.40%和47.74%,与模型组比较,差异有统计学意义(P<0.05);其中0.5 μg/mL和1 μg/mL剂量组的作用相近;2 μg/mL组的抑制作用最为明显,表现出高浓度药物作用明显的趋势。见表6。
3.9 紫草素对T淋巴细胞核转录因子c-Jun mRNA表达的影响 实验表明,模型组细胞c-Jun mRNA表达量明显高于对照组,比对照组提高52.05%(P<0.05)。经0.5~2 μg/mL紫草素处理后的细胞c-Jun mRNA表达均有所下降,降幅分别为12.28%、18.13%、25.73%,与模型组比较,差异有统计学意义(P<0.05),且与药物浓度相关。见表6。
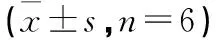
表6 草素对活化T淋巴细胞核转录因子NF-AT和c-Jun mRNA表达的影响
注:与模型组比较,*P<0.05;与对照组比较,△P<0.05
3.10 紫草素对T淋巴细胞核转录因子c-Jun蛋白表达的影响 结果显示,模型组蛋白表达水平明显高于对照组,0.5~2 μg/mL紫草素组的蛋白与模型组比较均有不同程度的降低。见图3。

图3 紫草素对活化的T淋巴细胞c-Jun蛋白表达的影响
3.11 紫草素对T淋巴细胞核因子-κB蛋白表达的影响 结果显示,模型组核因子-κB蛋白表达水平明显高于对照组;经0.5~2 μg/mL紫草素处理后的细胞,其核因子-κB蛋白表达量均受到抑制,以1 μg/mL紫草素的作用最明显。见图4。

图4 紫草素对活化的T淋巴细胞NF-κB蛋白表达的影响
4 讨论
凉血活血胶囊是首都医科大学附属北京中医医院的院内制剂,该方是在赵炳南、张志礼等皮外科名家治疗银屑病常用有效方剂凉血解毒汤的基础上经过改进工艺研制而成,充分体现中医对于银屑病血热证治疗以“清热凉血、活血解毒”为法的辨证思想,是“凉血、解毒”治则指导下治疗银屑病的有效方剂。本课题组对凉血活血胶囊治疗银屑病的临床疗效做了长期且深入的验证和研究,证明该药治疗寻常型银屑病血热证安全有效,且凉血活血不留瘀,解毒养阴不伤正[2]。临床研究证实,凉血解毒汤可明显改善患者皮损处红斑、浸润面积、瘙痒等症状,总有效率达69.23%[3];并且可明显下调银屑病血热证患者外周血中IL-17、IL-1β、IFN-γ、IL-6、TNF-α和血管内皮生长因子(VEGF)的水平[4-6],表现出一定的免疫抑制和调控作用。前期基础研究表明,高、中、低剂量的凉血活血胶囊均可显著抑制T淋巴细胞的异常活化,从而调控炎性反应进程,具有一定的免疫抑制功效[7];其凉血、解毒拆方组分虽然在一定程度上也可抑制炎性反应,但总体作用不如全方[8]。
本课题组在对凉血活血胶囊的拆方研究中发现,组方中的凉血类与解毒类药物在划分时存在一个交叉点,即单味中药紫草。紫草是凉血活血胶囊中的君药,始载于《神农本草经》,列为中品。味苦,性寒。有凉血、活血、解毒、透疹之功[9]。可见,一味紫草身集凉血、解毒双重功效,是凉血解毒中医治则的典型代表。临床研究表明,以紫草为君药的紫草汤治疗寻常型银屑病总有效率达85.71%[9-10]。外用紫草乳膏可有效改善银屑病皮损处的干燥、脱屑、瘙痒等症状,总有效率达75.86%[9,11]。实验研究表明,紫草素可降低咪喹莫特诱导的银屑病样小鼠皮损的表皮层厚度,并可降低血清中IL-17、IL-6、TNF-α、IL-22的水平[12];可抑制角质细胞的过度增殖、诱导凋亡[13-14];并可抑制树突细胞成熟、分化,从而抑制其促淋巴细胞增殖的能力,从而改善银屑病样小鼠的皮损程度[15-16]。
本研究继续观察紫草素对T淋巴细胞活化及相关信号转导通路的影响。结果显示0.5~2.0 μg/mL不同剂量的紫草素均可明显降低T淋巴细胞的增殖、显著抑制细胞表面活化分子CD69的表达和T细胞分泌Th1类细胞因子的功能,且有剂量依赖性,表现出一定的免疫抑制作用。
T淋巴细胞的活化是受到严格调控的。其中,PKC的激活和细胞内Ca2+浓度的升高是活化的早期事件,也是调控T细胞活化的中心步骤。PKC活化后一方面可通过经典的DAG、Ras、Raf和MAPKKK途径激活Fos和Jun蛋白结合形成的异源二聚体AP-1,另一方面通过BCL-10、Carma1、MALT1等信号分子直接激活核因子-κB[17]。胞内持续的Ca2+脉冲信号可诱导CaN磷酸化,导致核转录因子NF-AT脱磷酸而被活化,并移位入核[18]。活化的核转录因子NF-AT与由PKC途径生成的AP-1结合形成转录复合物,与靶基因的调控元件结合,共同对靶基因的表达进行调控。而活化的核因子-κB与其抑制蛋白IκBα解离后转位入核,其序列上有IL-2、INF-γ、TNF-α等多种基因的结合位点,可直接调控多种细胞因子的表达。
紫草素对T细胞活化信号转导通路的研究结果显示,0.5~2.0 μg/mL紫草素均可显著降低细胞内游离Ca2+的浓度和PKC磷酸化蛋白的水平,说明紫草素可对信号转导通路上游的第二信使及关键节点激酶发挥抑制作用。由此提示,紫草素可能对信号转导通路的下游同样具有调节作用,从而调控炎性反应的进程。实验对信号通路下游的核转录因子NF-AT、AP-1、核因子-κB mRNA和蛋白表达的研究结果证实:1)不同剂量的紫草素均对核转录因子NF-AT mRNA的表达产生明显的抑制作用,浓度越高抑制作用越明显。2)各剂量紫草素均可有效降低AP-1主要组分c-Jun的mRNA表达,并对其蛋白表达也均有明显的抑制趋势。对c-Jun蛋白表达的抑制可有效抑制AP-1异源二聚体的形成,从而抑制AP-1的生物活性,使其无法与核转录因子NF-AT在细胞核内结合,进而遏制需二者共同启动的靶基因的表达。3)各组紫草素均可抑制核因子-κB蛋白的表达,其中以1 μg/mL紫草素的作用最明显。
综上所述,本研究证明紫草素可以显著抑制T淋巴细胞增殖、活化及细胞因子的释放,具有一定的免疫抑制作用;同时还证明,紫草素可以通过下调信号转导通路中的第二信使Ca2+浓度和关键节点激酶PKC的水平,抑制核转录因子NF-AT、AP-1和核因子-κB等核转录因子的mRNA及蛋白表达,从而对T淋巴细胞活化的信号转导通路进行调控。本研究为紫草素作为免疫抑制剂用于银屑病的治疗提供了实验依据。
