人血清哇巴因UPLC-MS/MS 检测方法的建立和方法比对
2018-11-29赵银霞欧美贤陆优丽张美微李水军
赵银霞,欧美贤,曲 毅,陆优丽,张美微,李水军
(1.上海市徐汇区中心医院中心实验室,上海 200031;2.上海市徐汇区中心医院老年科,上海 200031)
1961年,de Wandener等发现扩容引起尿钠排泄增加,提出这种利钠作用可能由一种未知的体液物质调节,这是内源性哇巴因首先以一种利钠因子的概念被提出。随着研究的进一步深入,发现哇巴因是由下丘脑和垂体分泌的肾上腺皮质激素,在体内发挥着重要的生物学作用[1]。哇巴因主要作用于Na+泵,与原发性高血压和心脏肥大有关[2-3]。与健康受试者相比,高血压患者[4-5]和心力衰竭患者[6-7]血浆哇巴因水平明显升高。最近又有研究结果显示,尿毒症患者和妊娠期高血压患者血清哇巴因水平也明显升高[8-9]。这些研究结果均是基于免疫学测定方法得出的。哇巴因的免疫检测方法存在特异性和稳定性差等问题,检测结果往往无法重现[10-11]。超高液相色谱串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)利用化合物的母离子和特征碎片的质荷比进行检测,具有特异性强、交叉干扰小、重现性好的特点,尤其适用于内源性小分子标志物的检测。本研究拟建立检测血清哇巴因的UPLC-MS/MS方法,并与酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)进行比对,探讨两者的相关性和可比性,以期为后续哇巴因的研究提供可靠的技术手段。
1 材料和方法
1.1 研究对象
选取2013年6—12月上海市徐汇区中心医院高血压患者40例,其中男21例、女19例,年龄(81.7±3.0)岁,血压>18.62/11.97 kPa(140/90 mmHg)。另选取同期上海市徐汇区中心医院体检中心体检健康者20名,其中男9名、女11名,年龄(34.3±3.8)岁。本研究所用血清样本均为上述研究对象进行常规检测后的剩余血清。本研究获得了上海市徐汇区中心医院伦理委员会的批准。
1.2 仪器与试剂
5500QTRAP串联四极杆-线性离子阱质谱仪及Analyt1.5.1数据采集与处理软件购自美国Applied Biosystem公司,LC-30超高效液相色谱仪购自日本岛津公司。Phenomenex kinetex色谱分析柱(100 mm×2.1 mm,2.6 μm)及C18保护柱(4.0 mm×3.0 mm,5 μm)购自美国Phenomenex公司。哇巴因(C29H44O12·8H2O,纯度为99%)购自美国Sigma公司,哇巴因-d3(批号为8-QFY-118-1,纯度为97%)购自加拿大TRC公司。哇巴因ELISA试剂盒购自上海联硕生物有限公司。固相萃取柱(Evolute ABN 25 mg 1 mL Array wells)购自英国Biotage公司。
1.3 UPLC-MS/MS
1.3.1 检测条件 采用Phenomenex Kinetex色谱分析柱(100.0 mm×2.1 mm,2.6 μm),流动相为超纯水和乙腈,15%乙腈等度洗脱,流速为0.2 mL/min,进样量为20 μL。质谱条件为电喷雾电离源(electrospray ionization,ESI),负离子多反应离子监测(multiple reaction monitoring,MRM)模式扫描分析,母离子选择[M-H]-峰,哇巴因及其内标的离子对分别为m/z 583.3→419.1及m/z 586.3→422.1。质谱参数:雾化器(GS1)压力为60 psi,辅助器(GS2)压力为75 psi,气帘气为10 psi,碰撞气为12 psi,电压为-4 500 V,温度为550 ℃。
1.3.2 标准曲线及质控品的制备 将储备液用生理盐水逐级稀释为5.0、2.0、0.5、0.2、0.1、0.05、0.02 ng/mL的标准曲线工作液。另取1瓶储备液用生理盐水逐级稀释为4.0、0.6、0.06 ng/mL的质控品。
1.3.3 样本前处理 在2 mL离心管中分别加入300 μL不同水平的标准曲线工作液、质控品工作液或血清样本,加入10 μL内标(120 ng/mL哇巴因-d3),再加入900 μL超纯水进行稀释,混旋30 s后待上样。固相萃取柱需先用1 mL甲醇活化及1 mL水平衡后才能上样。取1 mL稀释后的标准曲线样本或血清样本上样后用1 mL水清洗,然后再用1 mL甲醇进行洗脱。洗脱液于60 ℃用氮气吹干后用100 μL 20%甲醇水溶液重组,震荡5 min,25 150×g离心5 min后取上清液,采用UPLC-MS/MS进样分析。
1.3.4 方法学验证 采用柱后推注法(色谱柱后连接针泵)观察蛋白直接沉淀、液液萃取、固相支撑液液萃取(solid phase supported liquidliquid extraction,SLE)、ABN固相萃取小柱萃取4种前处理方法的基质效应。通过比较直接提取后与空白提取后加入的分析物的峰面积比值观察回收率。对低值(0.06 ng/mL)、中值(0.6 ng/mL)、高值(4 ng/mL)质控品分别检测3次,连续检测3批,观察准确度和批内、批间精密度[变异系数(coefficient of variation,CV)]。取6份新鲜血清样本,3份添加0.1 ng/mL哇巴因标准品,另3份添加2 ng/mL哇巴因标准品,观察样本室温过夜放置16 h及样本前处理后室温放置自动进样器48 h的稳定性。最低定量检测限(lower limit of quantification,LLOQ)为标准曲线的最低点,满足2个条件:(1)信噪比 ≥10;(2)批内和批间精密度均≤±20%。标准曲线范围应尽量覆盖预期浓度范围,包括正常值、异常值及医学决定水平,并且至少包含6个非零浓度点。标准曲线通过最小二乘法原理,经线性回归后得到,权重因子为1/X,线性方程为Y=aX+b,r>0.99。标准品可接受标准为浓度偏差≤±15%,LLOQ≤±20%。所有方法学验证和样本测定批次的标准曲线均满足以上要求。
1.3.5 样本检测
采用UPLC-MS/MS检测20名正常对照者、40例高血压患者的血清样本。另随机收集10例患者当天采集的新鲜血清和血浆样本,并立即采用UPLC-MS/MS检测。
采用ELISA检测UPLC-MS/MS检测过的12名正常对照者、12例高血压患者的血清样本。用酶标仪在450 nm波长下测定吸光度(A)值,通过标准曲线计算样本哇巴因的水平,ELISA试剂盒检测范围为0.005~0.06 ng/mL。所有样本均稀释5倍并采用复孔检测。
在新鲜血清样本中添加终浓度分别为0.02、0.05、0.10、0.20、0.50 ng/mL的哇巴因标准品,同时采用UPLC-MS/MS和ELISA检测。
2 结果
2.1 UPLC-MS/MS方法学验证
2.1.1 基质效应及回收率 蛋白直接沉淀、液液萃取、SLE、ABN固相萃取小柱萃取4种前处理方法的回收率分别为45%、70%、60%、85%。
2.1.2 准确度和批内、批间精密度 LLOQ和低值(0.06 ng/mL)、中值(0.6 ng/mL)、高值(4 ng/mL)质控品的准确度分别为108.0%、89.2%、101.0%、103.0%。3个水平质控品的批内CV分别为2.87%、1.95%、0.56%,批间CV分别为5.98%、1.90%、0.75%。
2.1.3 稳定性 样本室温过夜放置16 h及样本前处理后室温放置自动进样器48 h的检测结果与0 h检测结果的偏差均<15%,结果稳定。
2.1.4 标准曲线范围及LLOQ 标准曲线范围为0.02~5.0 ng/mL,LLOQ为0.02 ng/mL。
2.2 样本检测
采用UPLC-MS/MS检测20名正常对照者、40例高血压患者的血清样本及10例患者当天的新鲜血清和血浆样本,均未检测到哇巴因水平高于LLOQ(0.02 ng/mL)。UPLCMS/MS检测样本中哇巴因的色谱图见图1。
ELISA检测12名正常对照者血清哇巴因水平为0.062 ng/mL,12例高血压患者血清哇巴因水平为0.096 ng/mL。
在新鲜血清样本中添加终浓度分别为0.02、0.05、0.10、0.20、0.50 ng/mL的哇巴因标准品,采用2种方法同时检测。UPLC-MS/MS检测结果与对应的哇巴因标准品水平呈正相关,且线性较好(r2>0.99),准确度较高。ELISA检测5个水平的哇巴因标准品,测定结果均很接近(0.024 9~0.029 6 ng/mL),无明显差异。见图2。
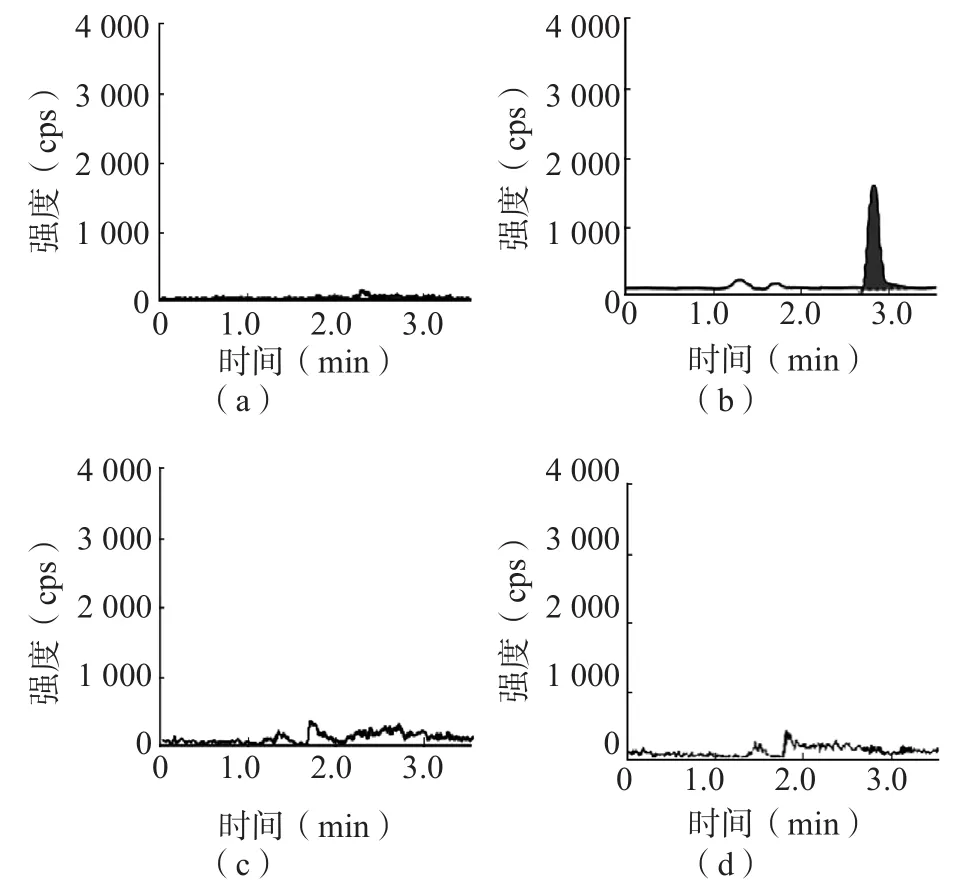
图1 哇巴因色谱图

图2 血清样本添加哇巴因标准品后结果
3 讨论
目前,关于利用液相色谱质谱法检测哇巴因的文献极少,多为定性或半定量研究,其中一些研究检测的是PC12细胞中的哇巴因[12-14]。本研究建立了检测人血清哇巴因的UPLC-MS/MS方法并进行了方法学验证。ABN固相萃取小柱处理后的基质效应较小,且回收率较高。本方法的线性范围为0.02~5.0 ng/mL,准确度和精密度均较好。稳定性结果表明样本室温过夜放置16 h及样本前处理后室温放置自动进样器中48 h均稳定。采用本方法检测正常对照者和高血压患者的血清哇巴因水平,结果显示二者的血清哇巴因水平均低于本方法的LLOQ。本研究结果还显示,UPLC-MS/MS检测结果与ELISA的差异较大,ELISA不但可检出血清中的哇巴因,且检出的正常对照者与高血压患者的血清哇巴因水平有明显差异。
液相色谱串联质谱技术具有特异性高、准确度好、抗干扰能力强的优势。本研究建立的UPLC-MS/MS检测哇巴因的方法在临床应用中得到阴性的检测结果。但这种阴性结果并非首次报道。早在1994年,LEWIS等[9]的研究结果显示高效液相色谱检测不到人血浆中的哇巴因。BAECHER等[16]采用UPLC-MS/MS在人血浆中也未能检测到内源性哇巴因。上述方法的检测结果均未与免疫法进行比较。为此,本研究采用UPLC-MS/MS和ELISA同时检测血清哇巴因水平并作比较,2种方法的检测结果均与文献报道[9-10]一致。
为了研究2种方法检测结果的差异,本研究检测了新鲜血清和血浆样本,结果显示UPLCMS/MS仍未检测到哇巴因,排除了因血清久置而导致的哇巴因降解以及血清与血浆的差异。在血清中添加哇巴因标准品后采用ELISA检测,结果显示检测结果并未随着哇巴因添加水平的升高而升高,而同一批样本采用UPLC-MS/MS检测则可准确地检出添加的哇巴因。考虑到2种方法检测原理的差异,液相色谱串联质谱法的检测特异性更强,免疫法检测小分子生物标志物容易受到类似物的干扰,且方法的重复性受到诸如制备抗体的差异等多种因素的影响。综上所述,我们认为内源性结构类似物的交叉反应可能是导致ELISA产生阳性结果的主要原因,UPLC-MS/MS产生阴性检测结果的原因可能受制于其检测限,但鉴于本研究检测结果与BAECHER等[10]的研究结果一致,因此推测人血清中可能不存在哇巴因这一物质,具体原因有待于更进一步的深入研究。
