冠状动脉微循环阻力指数与传统心血管危险因素、Hcy及LP-PLA2的相关性研究*
2018-11-29岑锦明杨希立郭军张爱东熊卿圆梁茜张健瑜李健蔡炜标梅百强许兆延
岑锦明 ,杨希立 ,郭军 ,张爱东 ,熊卿圆 ,梁茜 ,张健瑜,李健,蔡炜标,梅百强,许兆延
(1.广东省佛山市第一人民医院 心血管内科,广东 佛山 528000;2.暨南大学附属第一医院 心血管内科,广东 广州 510632;3.广东省佛山市禅城区中心医院检验科,广东 佛山 528031)
心血管领域的研究一直聚焦于对心外膜病变的诊断和治疗,然而心外膜冠状动脉(以下简称冠脉)狭窄或阻塞并不能解释所有心绞痛的发生。越来越多的证据表明冠脉微循环结构和功能异常是冠心病不良预后的独立预测因素[1-2]。目前,国内外心肌微循环障碍评估方法各有一定的局限性,且结果的分析主观因素影响较大,部分指标特异性及敏感性有待于循证医学的进一步验证。冠脉微循环阻力指数(index of microcirculatory, IMR)对微循环功能评估具有独特的优势,IMR测定时不受心率、血压及心肌收缩力等血流动力学参数变化的影响,且不受心外膜冠脉狭窄程度的影响[3-4],是一种定量特异性评估冠脉微循环的有创方法。
心肌微循环系统受到多种危险因素的影响会发生结构和病理性改变,这是一个较新的研究领域,相关临床证据明显不足。近年来生物标志物被认为是传统危险评估的重要补充手段。其中同型半胱氨酸(homocysteine, Hcy)和血浆脂蛋白相关磷脂酶A2(lipoprotein associated phospholipase A2, LP-PLA2)是近期研究较热的冠心病风险预测因子,并认为Hcy水平升高是冠心病的一个新危险因素[5-6]。本文旨在初步探索IMR与Hcy及LP-PLA2的相关性,以及微循环障碍发生、发展的危险因素。
1 资料与方法
1.1 研究对象
回顾性分析2014年8月-2017年4月广东省佛山市第一人民医院住院提示心肌缺血患者63例。其中,男性47例,女性16例;年龄34~82岁,平均(62.8±9.6)岁;以中位数21.3 u分为两组:IMR正常组(31例,IMR<21.3 u)和IMR升高组(32例,IMR≥21.3 u)。均接受冠脉造影和多普勒压力-温度导丝检测。纳入标准:冠脉造影显示3支主要血管(LAD、LCX、RCA)狭窄40%~70%,且测量冠脉血流储备分数(fractional flow reserve, FFR)>0.8。排除标准:入院前急性心肌梗死或冠状动脉旁路移植术史、经皮冠脉介入治疗史、致命性心律失常或控制不良的高血压,且肝、肾功能正常;入院前3个月内接受外科手术、创伤或感染性疾病、血栓栓塞性疾病、瓣膜性心脏病、心肌病、心脏移植、充血性心力衰竭或左心室功能不全(左心室射血分数<40%)及左心室肥厚(心脏B超示室间隔厚度<12 mm)。
1.2 研究方法
1.2.1 术前准备 63例患者在冠脉造影前均接受指南推荐的标准药物治疗5~7 d。包括:拜阿司匹林0.1 mg(1次 /d),氯吡格雷75 mg(1次/d),阿托伐他汀钙 20 mg(1次 /d),贝那普利片 10 mg(1次 /d),无禁忌证加用β受体阻滞剂倍他乐克,并根据个体情况调整剂量。合并高血压患者控制收缩压≤150 mmHg和(或)舒张压≤100 mmHg。合并糖尿病患者血糖控制在正常范围内。
1.2.2 生化指标及标志物检测 所有患者均于冠脉造影前测定总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)、空腹血糖、(FBG)、低密度脂蛋白(LDL-C)、糖化血红蛋白(HbA1c)、Hcy及LPPLA2浓度。
1.2.3 冠脉造影及IMR检测 所有入选对象选择6 F造影管行常规冠脉造影后,采用冠脉造影分析系统分析图像,并接受FFR、冠脉血流储备(coronary flow reserve, CFR)及IMR值测定。首先在体外将压力导丝浸润在室温生理盐水中调零。然后将压力导丝的温度-压力感应器通过6 F的冠脉指引导管送至左主干开口处,校正导丝头端感受器压力与指引导管所测定的主动脉压力,并同时校正温度。校零成功后即可将压力导丝送至罪犯血管狭窄病变远端至少2/3处(距指引导管开口 >5 cm),以 140 μg/(kg·min)的速度泵入三磷酸腺苷(adenosine triphosphate, ATP)使冠脉血管达到最大充血状态,在压力导丝分析仪上读取FFR值,对FFR>0.8的病变,进一步测量CFR和IMR,经指引导管向冠脉内快速(<0.25 s)注射3~5 ml室温生理盐水1次,压力导丝杆轴温度感受器会根据温度的变化记录到一条温度曲线,当生理盐水到达导丝头端的压力-温度感受器时,会记录到第二条温度曲线,重复3次取其平均传输时间。再经前臂静脉以140 μg/(kg·min)的速度泵入腺苷使冠脉血管达到最大充血状态,然后经导管向冠脉内法射3~5 ml室温生理盐水,将指引导管内的温暖液体和残留造影剂冲掉,重复上述操作3次,得到冠脉血管最大充血状态下的平均压(Pd)和平均传输时间(Tmn),IMR=Pd×Tmn。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)或以中位数Q(P25,P75)表示,比较用t检验或秩和检验;计数资料以率(%)表示,比较用χ2检验;相关分析连续变量采用Pearson法,二分类变量采用Spearman法;影响因素的分析采用logistic回归模型,单因素Logistic回归分析中P≤0.20的变量进入多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组一般临床资料比较
成功完成63例IMR测量,IMR范围:6.5~42.3 u,IMR 均值(19.8±8.9)u,中位数:21.3 u(11.0,26.9)u。两组年龄、HDL-C及Hcy比较,差异有统计学意义(P<0.05),而性别、门静脉高压、糖尿病、吸烟、体重指数、HbA1c、FBG、TC、TG及LDL-C比较,差异无统计学意义(P>0.05)。见表1。
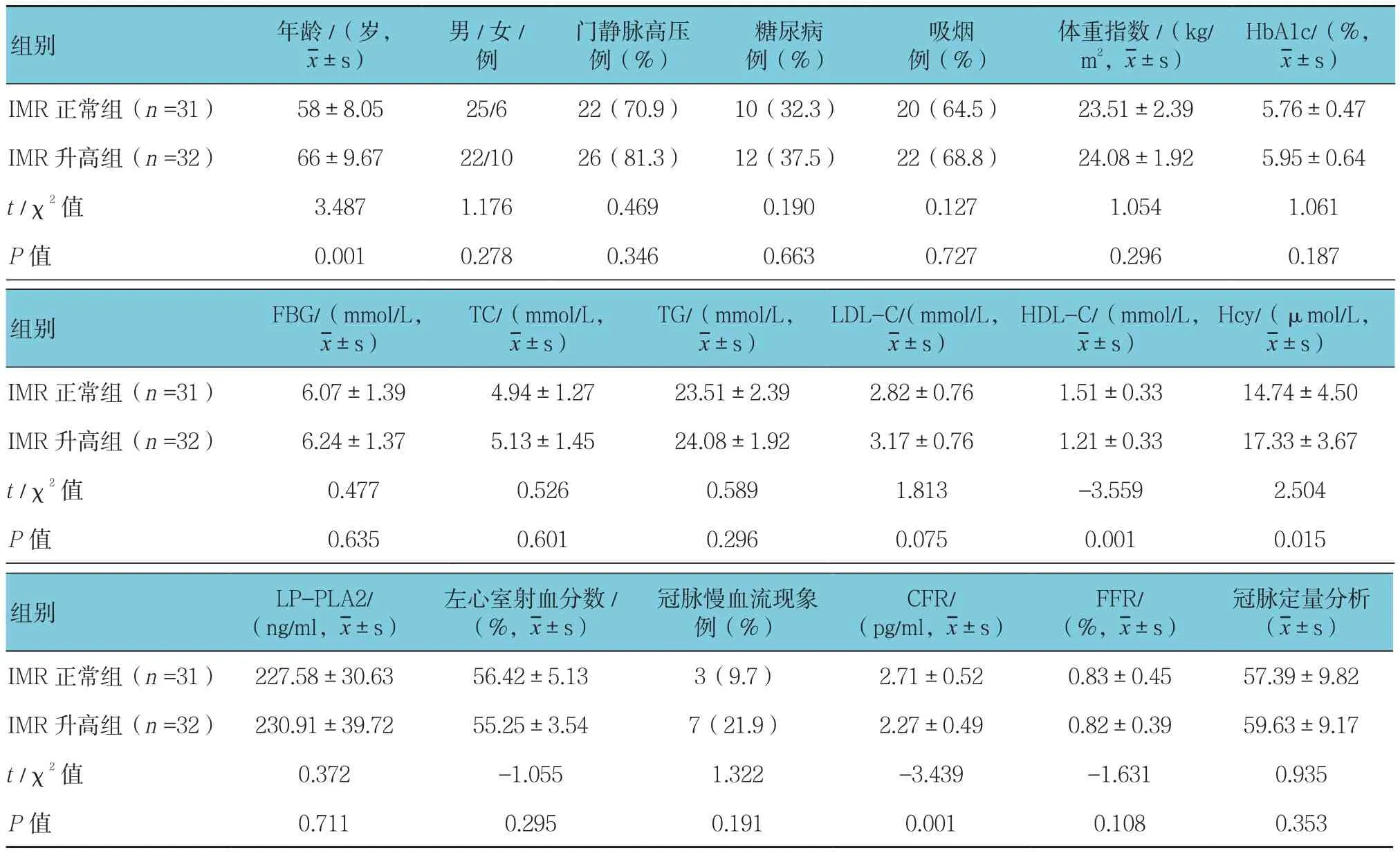
表1 两组一般临床资料的比较
2.2 IMR与Hcy、LP-PLA2、CFR相关性分析
IMR与Hcy呈正相关(r=0.510,P =0.000),IMR与LP-PLA2无相关性(r=0.148,P=0.127),IMR与CFR呈负相关(r=-0.520,P =0.000)。见图1~3。
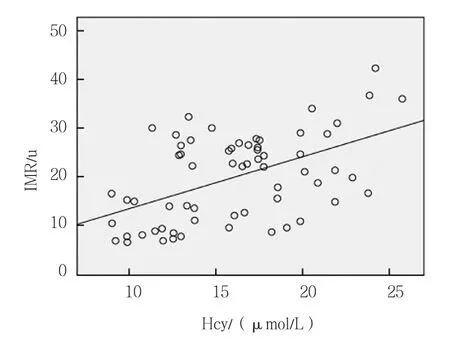
图1 IMR值与Hcy的相关散点图
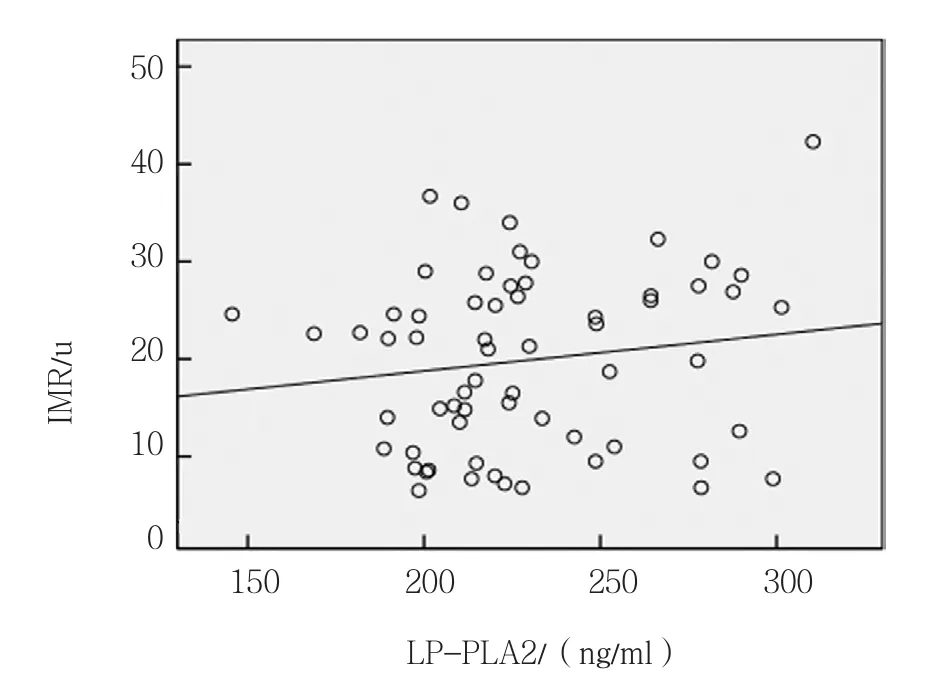
图2 IMR值与LP-PLA2的相关散点图
2.3 IMR与冠心病危险因素的相关性分析
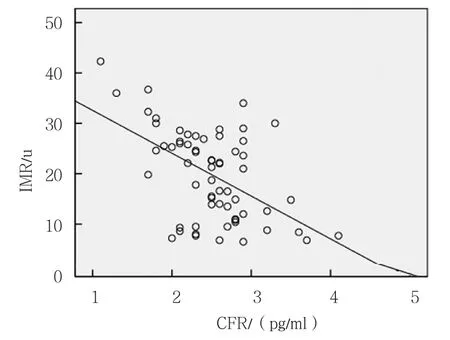
图3 IMR值与CFR的相关散点图
结果显示,IMR值与年龄呈正相关,与LDL-C呈正相关,IMR值与HDL-C呈负相关,IMR值与男性、高血压病、糖尿病、吸烟、BMI、HbA1c、FBG、TC及TG无相关性。见表2。
2.4 IMR升高的多因素Logistic回归分析
以年龄、男性、高血压病、糖尿病、吸烟、BMI、HbA1c、FBG、TC、TG、LDL-C、HDL-C、Hcy、CFR及LP-PLA2为影响因素,探讨各因素对IMR升高的影响。行单因素logistic回归分析P≤0.20的变量进入多因素logistic回归分析,结果显示年龄、Hcy是IMR升高的危险因素,而HDL-C、CFR是IMR升高的保护因素(P<0.05)。见表3、4。
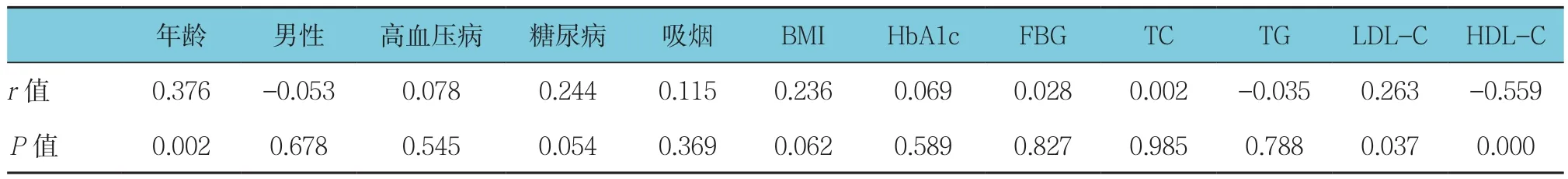
年龄 男性 高血压病 糖尿病 吸烟 BMI HbA1c FBG TC TG LDL-C HDL-C r值 0.376 -0.053 0.078 0.244 0.115 0.236 0.069 0.028 0.002 -0.035 0.263 -0.559 P值 0.002 0.678 0.545 0.054 0.369 0.062 0.589 0.827 0.985 0.788 0.037 0.000
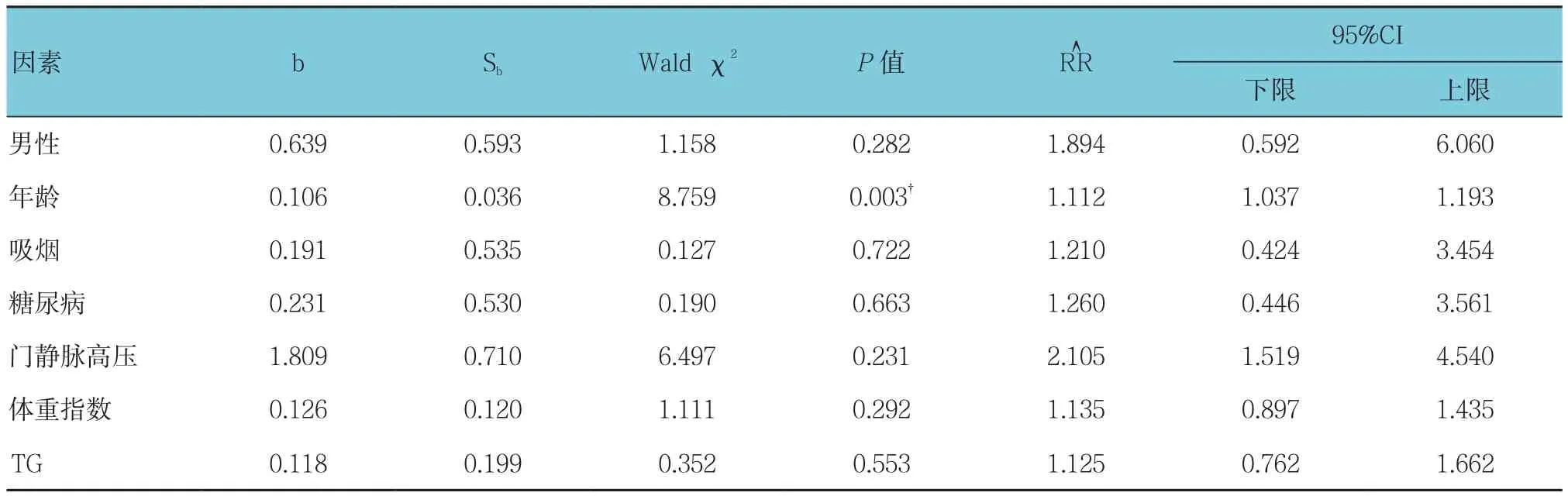
表3 单因素Logistic回归分析参数
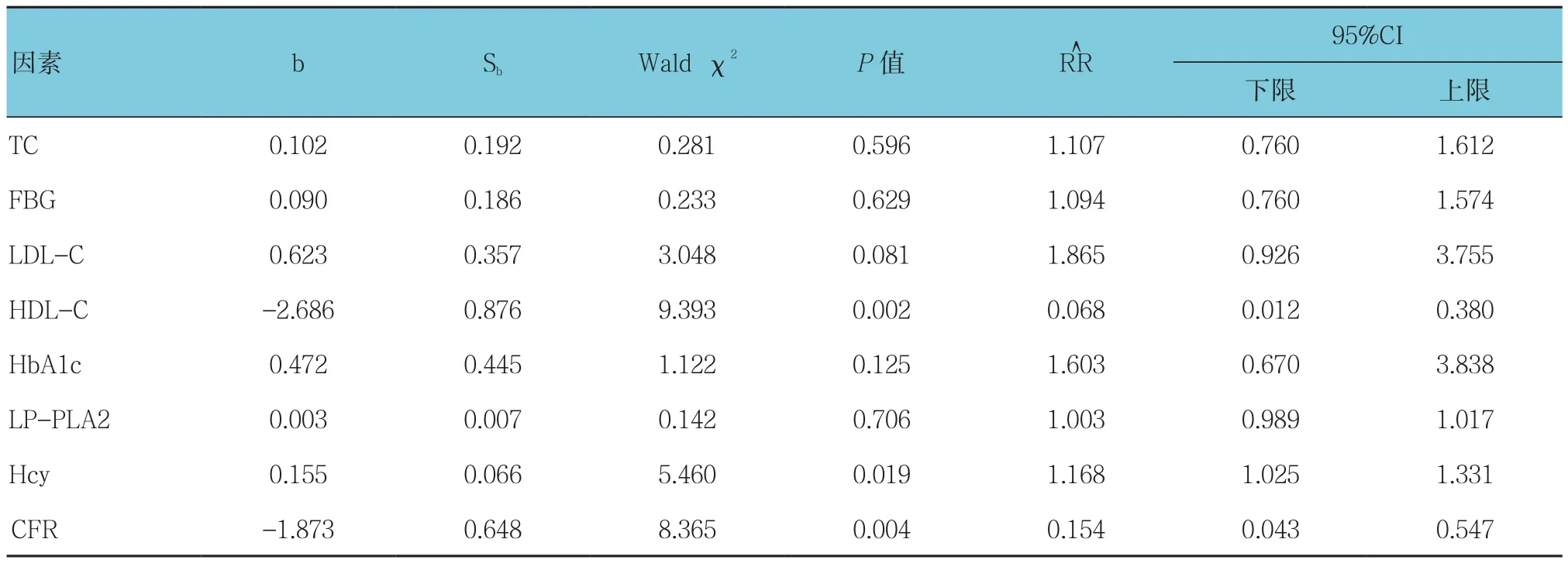
续表3
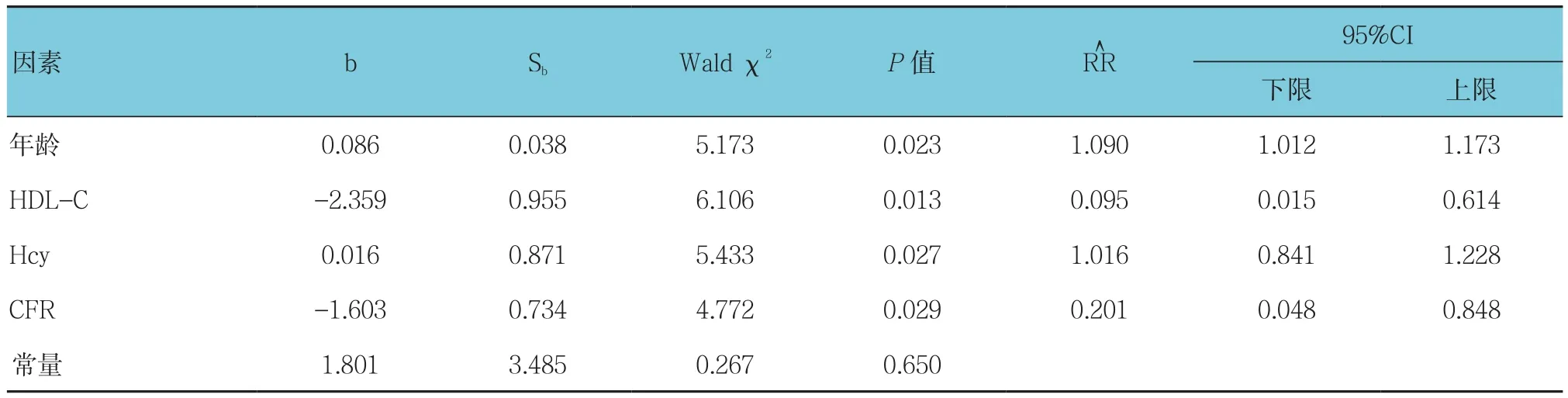
表4 多因素Logistic回归分析参数
3 讨论
冠脉微循环障碍是指多种致病因素作用下,冠状前小动脉和小动脉的结构和(或)功能异常所致的劳力性心绞痛或心肌缺血客观证据的临床综合征[7]。本研究结果显示,全体测试患者的IMR与CFR呈负相关,说明CFR在冠脉非限制性血流的病变(FFR>0.8)情况下,可作为评价微循环的方法之一,结果与国外相关研究一致,CFR能反映冠脉系统的血流储备(包括心外膜血管和冠脉微循环系统)。在没有严重冠脉狭窄的情况下,CFR<2被认为存在心肌微循环障碍[8]。但CFR受患者心率、血流动力学及冠脉狭窄的影响,限制其评估心肌微循环障碍的应用[9]。LP-PLA2能介导局部炎症反应、刺激转化生长因子β等,以致动脉中层弹力纤维膜的破坏或异常增生,从而影响血管的弹性和传导[10-11],IKONOMIDIS I等[12]发现Lp-PLA2浓度升高与内皮功能障碍,冠脉血流储备减少和动脉僵硬度增加等冠心病不良结果相关,但本研究发现全体患者LP-PLA2与IMR无相关性,或者由于本研究例数太少未能发现两者相关性。如单一分析IMR升高组患者,两者关系也紧存在较弱的相关性,提示LP-PLA2可能并不能反应冠脉微循环情况,近年来同型半胱氨酸水平升高被认为是冠心病的一个新危因素[13]。
本研究发现IMR值与Hcy呈现相关性,考虑Hcy对冠脉微血管有以下几个方面的作用,Hcy通过自身氧化生成超氧化物和H2O2,这些物质可直接引起血管内皮及脂质过氧化,损伤内皮功能,同时降解内皮细胞的硫酸乙酰肝素蛋白多糖,降低内皮细胞外过氧化物相关酶对内皮细胞表面的黏附,影响内皮细胞对氧化损伤的拮抗能力[14-15]。Hcy代谢过程中生成的活性硫醇化合物可进入内皮细胞导致其DNA双链结构破坏,抑制DNA合成[16]。Hcy亦可增加血管平滑肌细胞的DNA合成,使处于静止期的平滑肌细胞开始有丝分裂,过度增殖使血管壁加厚,舒张功能进一步受损,Hcy自身氧化可以引起低密度脂蛋白氧化修饰,减少一氧化氮(NO)的生成,抑制前列醇合成,造成血管舒缩功能减弱[17];影响纤溶酶原激活物的结合位点,改变内皮细胞表型,启动内皮细胞的凋亡程序[18];Hcy可改变肝脏脂质代谢,增加巨噬细胞对氧化修饰LDL的摄取,引起血管壁内TC和TG的聚集[19]。Hcy患者血浆S-腺苷蛋氨酸浓度升高可反馈性抑制甲基转移酶活性而引起DNA低甲基化,影响基因表达,导致平滑肌细胞迁移和增殖[20],而这一过程是冠心病发生机制的重要组成部分。Hcy可以抑制蛋白C活性和血栓调节蛋白表达,增加血栓素A2的合成,而高同型半胱氨酸能使血小板黏附性和聚集性增加。5Hcy可通过激活单核细胞,引起促炎细胞因子的分泌。包括单核细胞引诱蛋白1、白细胞介素8、核因子kB、细胞黏附分子等,促进炎症发生[21]。
本研究显示,年龄与IMR值呈正相关,HDL-C与IMR值呈负相关,经多因素Logistic回归分析亦发现年龄和Hcy是IMR升高的危险因素,HDL-C水平升高是微循环功能不全的保护因素。提示随着年龄的增长,冠脉微循环自我调节功能可能有所下降。HDL-C对微循环的保护作用机制可能是HDL介导的胆固醇逆向转运、抗氧化、促纤溶、抗血栓等作用。在LUPATTELLI等[22]研究指出,HDL-C水平降低可导致细胞间黏附分子和脉管细胞黏附分子等炎症因子的过度表达,以及血管内皮功能紊乱[23]。本研究发现IMR升高提示微循环障碍时,HDL-C水平会降低,殷培明等[24]研究发现冠脉慢血流患者中HDL-C水平偏低,而冠脉微循环功能障碍是导致冠脉慢血流原因之一。因此有理由认为,在微循环障碍发生过程中,低水平HDL-C可能参与其中。
综上所述,结合HDL-C的保护机制,提升HDL-C水平有利于改善冠脉微循环障碍,为制定冠脉微循环障碍的治疗策略提供一个研究方向。本研究是一个单中心、小样本量的临床研究,研究中的数据测量可能存在一定的误差,对影响冠脉微循环障碍的危险因素及生物标志物需要大样本量及更长时间的研究来进一步证实。
