Cu2+诱导的Aβ40种子的特性及其对Aβ40聚集的影响
2018-11-29董晓燕齐凤娟赵彦娇
董晓燕,齐凤娟,张 焕,赵彦娇
Cu2+诱导的Aβ40种子的特性及其对Aβ40聚集的影响
董晓燕,齐凤娟,张 焕,赵彦娇
(天津大学化工学院,天津 300354)
淀粉样β蛋白(amyloid β-protein,Aβ)的二次成核机制认为Aβ聚集体可作为种子加速Aβ聚集.而Cu2+与Aβ结合也会加剧Aβ聚集,因此了解Cu2+诱导的Aβ种子对Aβ二次成核的影响具有重要意义.本文考察了不同浓度Cu2+诱导的Aβ40种子对Aβ40聚集过程、聚集体形貌、二级结构以及细胞毒性的影响.结果表明,随着Cu2+浓度增加,Aβ40种子形貌由纤维状转变为球形.并且,两种形貌的Aβ40种子均可促进Aβ40二次成核并形成富含β-折叠结构的纤维状聚集体.其中,纤维状种子比球形种子的促进作用更强并具有浓度依赖效应.值得注意的是,两种形貌的种子诱导的Aβ40聚集体细胞毒性具有明显差异.对比发现:球形种子诱导的Aβ40聚集体比纤维状种子诱导的聚集体毒性显著加剧.本文明确了Cu2+诱导产生的种子对Aβ聚集的促进作用,可为开发有效的Aβ聚集抑制剂提供理论依据.
阿尔茨海默病;淀粉样β蛋白;铜离子;种子;二次成核
阿尔茨海默病(Alzheimer’s disease,AD)是一种大脑原发性退行性疾病,也是老年痴呆症最主要发病形式,其主要病理学特征是淀粉样斑块(amyloid plaques)和神经纤维缠结(neurofibrillary tangles)[1-2].研究发现,淀粉样斑块是由大量含39~43个氨基酸残基的淀粉样β蛋白(amyloid β-protein,Aβ)聚集而成[3-4].由于在AD的发病过程中Aβ扮演着重要的致病作用,因此研究者针对Aβ的聚集过程进行了广泛的研究[5-7].随着对Aβ聚集过程研究的深入,大家普遍接受Aβ的“二次成核”机制[8].该机制认为,在溶液中Aβ会首先形成少量但能达到一定浓度的纤维,这些纤维随后充当一种催化剂,可以通过结合单体快速形成有毒的寡聚体.这个过程既能使不可溶性纤维生长也能产生可扩散的寡聚体.在没有纤维存在时,所有的寡聚体只能通过一次成核过程形成纤维.但二次成核可以越过一次成核过程,这样就加快了纤维聚集形成的过程.
另外,研究还发现,在AD患者脑内的淀粉样斑块中,Aβ周围的金属离子浓度也大大增加,并且会与Aβ结合在一起[9-11],影响Aβ聚集动力学以及纤维的产生[12-14].若加入金属螯合剂则可以逆转金属离子引起的Aβ聚集[15-16].在众多金属离子中,由于Cu2+具有活跃的氧化还原性质和催化活性而被广泛关注[17].但由于Cu2+与Aβ结合方式的多样性和复杂性[18-19]以及受实验条件(缓冲液,Cu2+浓度和Aβ多肽的种类等)的影响,Cu2+对Aβ的作用并没有一致的结论.有研究表明,Cu2+与Aβ单体结合形成金属-蛋白复合物,抑制Aβ的聚集,改变Aβ聚集体的β-折叠结构和形貌,使Aβ聚集体呈球形[20];也有研究表明,Cu2+可以与Aβ结合,诱导产生ROS并造成神经毒 性[21];且Aβ-Cu复合物可以影响Aβ聚集的一次成核过程,并与细胞内氧化压力有关[22];大脑海马区谷氨酸受体介导的突触后膜Cu2+释放异常,使得Cu2+平衡被打破,浓度升高,也能影响Aβ的聚集成核过程[23].另外,在加入不同浓度Cu2+时,Aβ聚集的动力学以及聚集体的形貌并不相同,其影响Aβ聚集的机制也不相同[24].但已有报道中鲜有针对Cu2+的存在是如何影响Aβ聚集的二次成核过程的报道.
相比于Aβ42等其他类型单体,Aβ40具有明显的聚集延滞期,可用于表征淀粉样蛋白聚集成核过程.因此,本研究选用Aβ40为模型,深入研究不同浓度Cu2+诱导形成的Aβ40种子及其对Aβ40聚集成核过程的影响.首先,利用ThT荧光、原子力显微镜(AFM)、圆二色光谱(CD)、酪氨酸(Tyr)内源荧光、粒径分析和电感耦合等离子体质谱(ICP-MS)考察了不同浓度Cu2+诱导形成的Aβ40种子的特性;然后利用ThT荧光、AFM、CD以及MTT实验对这些种子是如何影响Aβ40聚集二次成核进行了分析.研究成果为进一步阐明Cu2+对Aβ聚集过程的影响增添更多的实验数据.
1 材料和方法
1.1 试剂与仪器
1.1.1 实验试剂
Aβ40(>95%,)购自吉尔生化有限公司(上海,中国);1,1,1,3,3,3-六氟-2-丙醇(HFIP)购自萨恩化学技术有限公司(上海,中国);硫磺素T(ThT)以及3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自Sigma公司(圣路易斯,密苏里州,美国);HEPES以及CuSO4·5,H2O购自生工生物工程股份有限公司(上海,中国);DMEM/F12培养基和胎牛血清购自Gibco公司(加利福尼亚州,美国);SHSY-5Y细胞购自中国科学院细胞库(昆明,中国).
1.1.2 实验仪器
冷冻干燥仪(Labconco FreeZone,Labconco,美国);粒径测量仪(Zetasizer 2000,Malvern,英国);荧光分光光度计(LS55,PerkinElmer,美国);电感耦合等离子体质谱仪(Agilent 7700X,Agilent,美国);酶标仪(Infinite M200,Tecan,瑞士);原子力显微镜(CSPM5500,本原纳米仪器有限公司,中国);圆二色光谱仪(JASCO-J810,JASCO,日本).
1.2 Aβ40的预处理
Aβ40单体的制备方法参考文献[25].首先,将购买的Aβ40粉末从-80,℃冰箱中取出,以1,mg/mL溶于HFIP中,超声2,min,使Aβ40充分溶解,然后于4,℃静置2,h,以破坏溶液中预先存在的Aβ40聚集体.随后在4,℃、16,000,下离心20,min,取75%,的上清液置于-80,℃超低温冰箱中过夜,之后快速放入冷冻真空干燥仪中冷冻干燥24,h以去除HFIP.最后,将得到的白色絮状Aβ40单体置于-20,℃保存备用.
1.3 Aβ40种子的制备
首先,用20,mmol/L的NaOH溶解一定量的Aβ40单体,得到浓度为275,μmol/L的母液,之后按1∶10的体积比加入溶有不同浓度CuSO4·5,H2O的HEPES缓冲液(20,mmol/L HEPES,100,mmol/L NaCl,pH=7.4),使得溶液中Aβ40的终浓度均为25,μmol/L,Cu2+终浓度分别为6.25,μmol/L、12.5,μmol/L、25,μmol/L、50,μmol/L、100,μmol/L(对应的(Cu2+)/(Aβ40)分别为1/4、1/2、1/1、2/1、4/1).然后将各溶液置于37,℃、150,r/min下培养72,h.将培养后的溶液在4,℃、16,000下离心30,min,弃上清,得到的沉淀用等量的HEPES缓冲液重悬,相同条件下再次离心重悬以除去溶液中游离的Cu2+,得到的溶液为Cu2+诱导的Aβ40种子液,分别记为S1、S2、S3、S4和S5,备用.
利用上述相同方法得到无Cu2+诱导的Aβ40种子液,记为S(Aβ40),备用.
1.4 动态光散射实验
采用动态光散射实验分析不同浓度Cu2+诱导的Aβ40种子的粒径分布.将第1.3节所述的种子各取1.2,mL,加入光程为1,cm的DTS0012可抛弃型聚苯乙烯样品池中,在25,℃下进行测定,散射光为单角度173°.每个样品连续扫描3次,取其平均值.
1.5 酪氨酸荧光检测
Aβ中Tyr10的荧光强度与Aβ和Cu2+的结合程度有关.Aβ40与Cu2+结合越多,Aβ40样品产生的荧光淬灭现象越明显.本研究使用荧光分光光度计检测了第1.3节中制备的Aβ40种子的Tyr10内源荧光光谱,从而定性分析Aβ40与Cu2+的结合情况.荧光分光光度计参数设为激发波长274,nm、发射波长307,nm,然后在280~360,nm波长下进行扫描.
1.6 电感耦合等离子体质谱实验
将第1.3节中培养制备好的5种不同浓度Cu2+诱导形成的Aβ40种子液各取4.85,mL,加入250,μL的硝酸以破坏Aβ40与Cu2+的相互作用,使Cu2+成为游离状态,以保证检测的准确性.然后使用电感耦合等离子体质谱仪检测不同浓度Cu2+诱导的Aβ40种子中,Aβ40与Cu2+的结合情况.
1.7 ThT荧光实验
利用原位ThT荧光实验考察不同浓度Cu2+诱导的Aβ40种子的聚集动力学以及这些种子对Aβ40聚集二次成核的影响.
将Aβ40母液(275,μmol/L)按1∶10的体积比加入溶有27.5,μmol/L ThT以及不同浓度CuSO4·5,H2O的HEPES缓冲液,使得最终溶液中Aβ40单体及ThT的终浓度均为25,μmol/L,(Cu2+)/(Aβ40)分别为1/4、1/2、1/1、2/1、4/1.再将每个样品以200,μL/孔分装于96孔板,放入酶标仪,37,℃条件下培养检测.期间每隔10,min检测一次,每次检测前摇晃混匀5,s,波幅3,mm,频率452.1,r/min;激发波长440,nm,激发带宽9,nm;发射波长480,nm,发射带宽20,nm;手动增益值90.实验结束后绘制荧光强度随时间的变化曲线.每个样品至少重复3次,取其平均值.得到Cu2+诱导的Aβ40种子的聚集动力学.
向Aβ40母液(275,μmol/L)中加入第1.3节所述的种子和ThT溶液,使得溶液中Aβ40单体、种子和ThT的终浓度分别为25,μmol/L、2.5,μmol/L和25,μmol/L,并以不含种子液的Aβ40纯样品(25,μmol/L)为参照.之后按照相同方法测定种子对Aβ40聚集二次成核的影响.
1.8 原子力显微镜测定
利用原子力显微镜观察不同浓度Cu2+诱导的Aβ40种子的形貌特征以及这些种子诱导形成的Aβ40聚集体的形貌特征.吸取第1.7节中所述培养72,h的样品各100,μL,滴在洁净的云母片上,静置2,min,待各样品成分吸附在云母片上之后,用过膜水滴洗2~3次,每次1,mL,于高纯N2下吹干备用.所有样品均使用CSPM5500原子力显微镜在轻敲模式下扫描,共振频率为30,kHz,调制强度为1.5,V.每个样品至少扫描4个不同的部位.
1.9 圆二色光谱实验
采用圆二色光谱测定不同浓度Cu2+诱导的Aβ40种子的二级结构以及这些种子诱导形成的Aβ40聚集体的二级结构.
将第1.3节所述的Aβ40种子加入光程为1,mm的石英皿中,在远紫外波长(190~260,nm)下进行扫描得到不同浓度Cu2+诱导的Aβ40种子的二级结构.扫描速度为50,nm/min,扫描带宽为1,nm,响应时间为1,s.每个样品连续扫描3次,取平均值.
向Aβ40母液(275,μmol/L)中加入第1.3节所述的Aβ40种子和HEPES缓冲液,使得Aβ40单体和种子的终浓度分别为25,μmol/L和2.5,μmol/L,并以不含种子液的Aβ40纯样品为参照.然后将各溶液置于37,℃、150,r/min下培养72,h.在培养终点对各样品取样,按照相同方法测定种子诱导形成的Aβ40聚集体的二级结构.
1.10 MTT实验
MTT实验是一类检测细胞活性的比色分析实验.本研究利用MTT实验考察不同浓度Cu2+诱导的Aβ40种子的细胞毒性以及这些种子诱导形成的Aβ40聚集体的细胞毒性.实验中,将细胞按每孔80,μL培养液,8,000个细胞的密度加入到96孔板中.培养24,h后,每孔加入20,μL老化72,h的Aβ40以及Aβ40与不同种子共培养的样品(样品按第1.9节所述方法在无菌环境下制备)继续培养24,h,并以种子以及稀释10倍的种子(种子按第1.3节所述方法在无菌环境下制备)作为对照.然后在每孔中加入10,μL MTT 溶液(5.5,mg/mL),继续培养4,h.检测时,1,500,r/min离心10,min除去培养基,然后在每孔中加入100,μL DMSO.于37,℃、150,r/min条件下振荡培养10,min,使紫色晶体充分溶解,然后使用酶标仪在570,nm下测定吸光度,计算细胞活性.以不含细胞的样品作为空白组,以仅含有细胞而不含Aβ40的样品作为对照组(100%,),对细胞活性数据进行归一化.
2 结果与讨论
2.1 不同浓度Cu2+诱导的Aβ40种子的特性
2.1.1 Aβ40种子的聚集动力学
首先利用原位ThT荧光实验考察了不同浓度Cu2+诱导的Aβ40种子的聚集动力学,如图1所示.由图1可看出,在没有Cu2+存在的情况下,Aβ40单体经过21,h的延滞期之后,进入快速生长期,在34,h达到荧光值最大的稳定成熟纤维期(S0);但当加入6.25,μmol/L Cu2+后,明显促进了Aβ40的聚集过程,延滞期缩短至12,h,生长速率大大提高,在18,h便进入稳定期(S1);如继续加大Cu2+浓度(12.5,μmol/L),Aβ40的延滞期虽同样大大缩短,聚集速率也同样加快,但最大荧光值却明显下降(S2);若将Cu2+浓度增加至25,μmol/L以上,Aβ40均不再发生荧光值的增长(S2~S5),说明此时Aβ40形成了β-折叠含量较低的聚集体.这些结果证明,Cu2+可以改变Aβ40的聚集路径,且在低浓度下可以缩短Aβ40的延滞期,促进Aβ40的一次成核,加速Aβ40的聚集过程.这与Sarell等[26]的研究结果相一致.
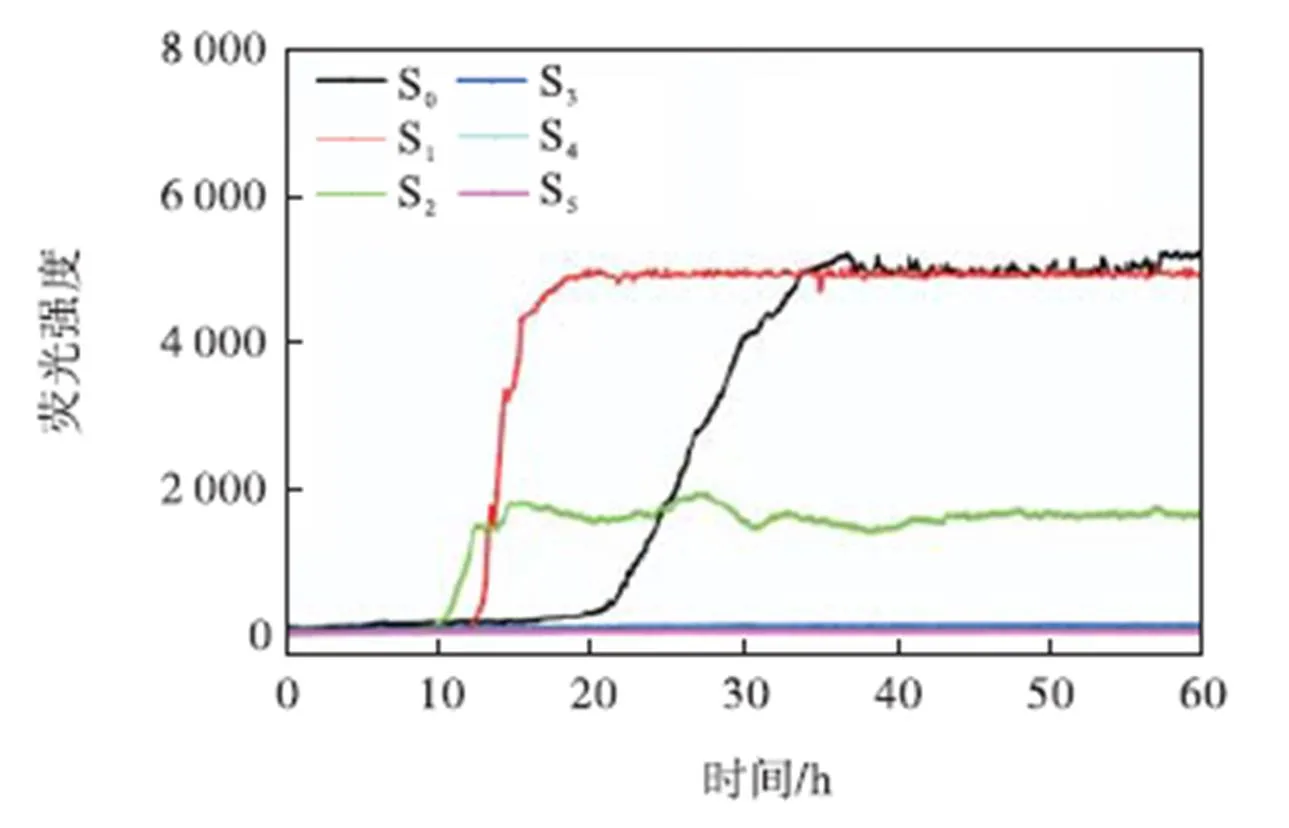
图1 不同浓度Cu2+诱导的Aβ40种子的聚集动力学
2.1.2 Aβ40种子的形貌
图2为利用AFM观察的不同浓度Cu2+诱导培养72,h形成的Aβ40种子的形貌特征.可以看出,单独的Aβ40种子(S0)生成细长纤维的结构,且生成的纤维量较多;而Cu2+诱导产生的Aβ40种子的形貌产生了显著的变化,随着Cu2+浓度的增加,纤维逐渐减少、纤维长度逐渐变短并逐渐出现球形聚集体,与图1中对应的β-折叠含量逐渐降低相一致;当Cu2+浓度增加至25,mmol/L以上时,Aβ40种子(S3~S5)中仅能观察到一些球形的聚集体,这与图1中对应的表征β-折叠含量的ThT荧光不再增长相一致.进一步说明,不同浓度Cu2+可以诱导产生不同形貌特征的Aβ40种子;且随着Cu2+浓度的增加,Cu2+诱导形成的Aβ40种子形貌从纤维状转变为球形.Pedersen等[24]通过研究也得到了相似结果.

图2 不同浓度Cu2+诱导形成的Aβ40种子的AFM图像
2.1.3 Aβ40种子的粒径分布
为了进一步考察不同形貌的Aβ40种子的粒子大小,实验中运用DLS分析了不同种子的粒径分布,结果如图3所示.由图3可见,无Cu2+诱导的Aβ40种子(S0)生成了粒径在1,600~1,800,nm之间的较大聚集体,低浓度Cu2+诱导产生的Aβ40种子(S1,S2),其粒径比单独的Aβ40种子稍小,约在1,300~1,500,nm之间;而高浓度Cu2+诱导产生的Aβ40种子(S3~S5)粒径明显减小,Cu2+诱导产生的最小种子粒径(约400,nm)约为单独Aβ40种子粒径(约1,700,nm)的0.24倍.此结果与AFM实验(见图2)一致,说明不同浓度Cu2+诱导生成Aβ40种子的粒径不同,纤维状种子粒径较大,而球形种子粒径明显减小.

图3 不同浓度Cu2+诱导形成的Aβ40种子的粒径分布
2.1.4 Aβ40种子的二级结构
进一步采用CD测定Cu2+诱导的不同形貌Aβ40种子的二级结构,结果如图4所示.可以明显看出单独Aβ40种子在培养72,h后,其CD光谱在216,nm左右有一负峰,为表征β-折叠结构的特征峰,表明单独Aβ40种子在培养72,h后形成的聚集体为β-折叠结构.观察Cu2+诱导形成的Aβ40种子的CD光谱发现,随着Cu2+浓度的增加,在216,nm左右的负峰逐渐减小,当Cu2+浓度增至Cu2+/Aβ40=1/1以上时,在216,nm左右的负峰基本消失,与图1中对应的表征β-折叠含量的ThT荧光不再增长以及图2中种子形貌由纤维状向球形转变相一致.结合图1~图3结果进一步表明Cu2+可以改变Aβ40的聚集路径,诱导形成不同形貌结构的Aβ40种子,且随着Cu2+浓度的增加,种子由粒径较大的富含β-折叠结构的纤维状转变为粒径较小的无β-折叠结构的球形.
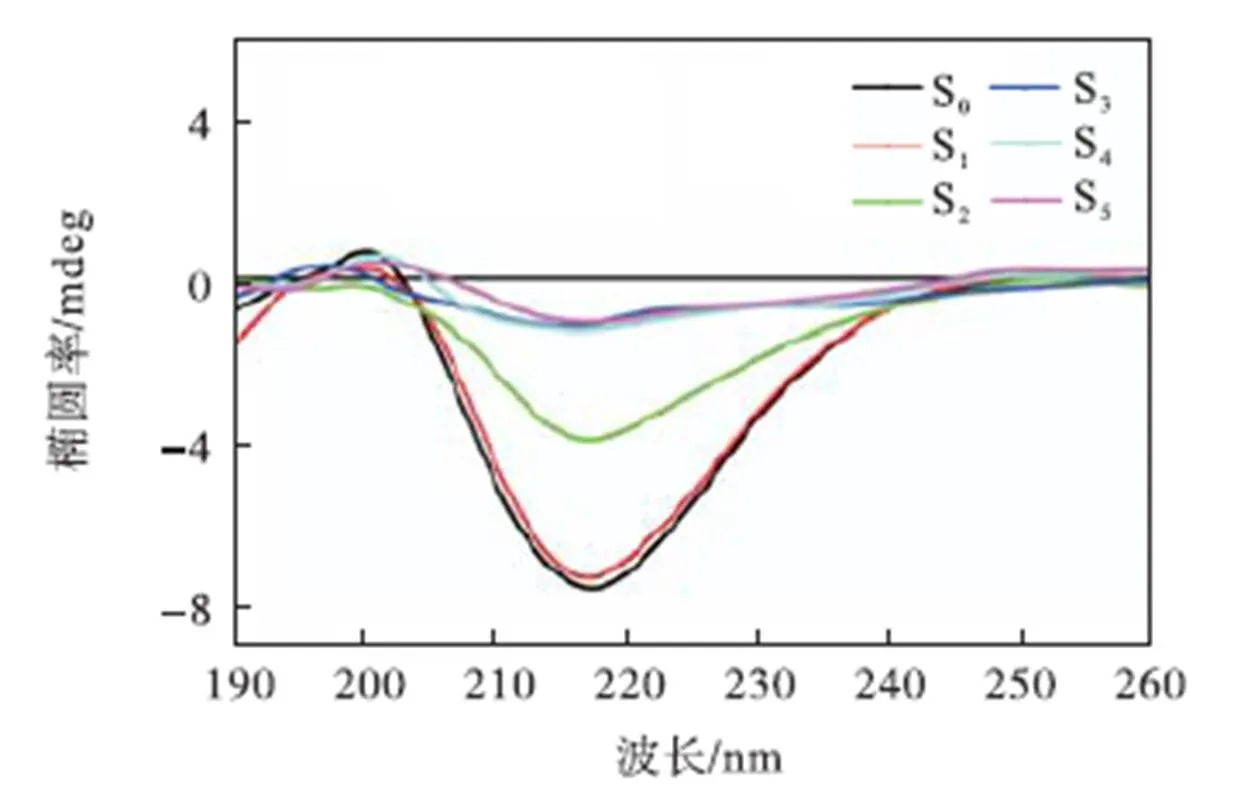
图4 不同浓度Cu2+诱导形成的Aβ40种子的二级结构
2.1.5 Aβ40种子的内源荧光
由于Aβ40中His6、His、His14和Tyr10与Cu2+发生络合后,Tyr10会发生荧光淬灭现象,且随着Aβ40与Cu2+结合量的增多,荧光淬灭现象越明显.因此通过检测酪氨酸(Tyr)荧光淬灭情况,可以进一步考察不同结构形貌的Aβ40种子中Cu2+和Aβ40的结合情况(见图5).可以看出,没有添加Cu2+的Aβ40种子(S0),在307,nm左右具有较高的Tyr10荧光;但加入Cu2+后,荧光不断下降,且Cu2+浓度越大,荧光越小.这说明,Cu2+和Aβ40发生络合作用,这与Brzyska等[27]研究所得结果相符.并且随着Cu2+浓度的增大,Cu2+诱导生成的Aβ40种子中Cu2+与Aβ40结合量也增加.

图5 不同浓度Cu2+诱导形成的Aβ40种子的内源荧光
2.1.6 Aβ40种子中Cu2+与Aβ40的结合量
为详细了解不同结构形貌的Aβ40种子中Cu2+与Aβ40的结合量,利用Agilent 7700,X的ICP-MS测定了Cu2+诱导的Aβ40种子中Cu2+的含量.结果如表1所示.可以看出,Aβ40与Cu2+的结合量与Cu2+浓度成正比.当Cu2+浓度为100,mmol/L时,1个Aβ40可与1.48个Cu2+结合(S5),此时1个Aβ40是可以与多个Cu2+结合的,这与Damante等[28]的研究结果相似.结合图5进一步表明,随着Cu2+浓度的增大,Cu2+诱导的Aβ40种子中Cu2+与Aβ40结合量也增加.
表1 不同浓度Cu2+诱导形成的Aβ40种子中Cu2+与Aβ40的结合量

Tab.1 Proportion of Cu2+ in Aβ40 seeds mediated by dif-ferent concentrations of Cu2+
2.2 Cu2+诱导的Aβ40种子对Aβ40聚集二次成核的影响
由上面结果可知,不同浓度Cu2+诱导的Aβ40种子特性不同,因此,其对Aβ40聚集过程的影响可能也不相同.为此,本研究通过原位ThT荧光实验考察了不同种子对Aβ40二次成核的影响,结果如图6所示.
与单独Aβ40(延滞期21,h)相比,加入不含Cu2+的Aβ40种子后,Aβ40的延滞期大大缩短至3,h;而加入不同浓度Cu2+诱导形成的Aβ40种子(S0)时,Aβ40延滞期同样也有所缩短.表明种子的加入均可促进Aβ40的二次成核,促使其快速达到成核浓度,加快其聚集进程.值得注意的是,随着Cu2+浓度增加,种子(S1~S3)形态由纤维状向球形转变(图2(b)~2(d)),其对Aβ40二次成核的促进作用逐渐减弱,并且纤维状种子(S1,S2)对Aβ40二次成核的促进作用与单独Aβ40种子(纤维状)的促进作用相近,远高于球形种子S3对Aβ40二次成核的促进作用.这一结果说明,纤维形态的种子对Aβ40二次成核的促进作用较强并且具有浓度依赖效应,而球形种子的促进作用较弱.继续增加Cu2+浓度,形成的种子(S4,S5)对Aβ40二次成核的促进作用又小幅度增大,这是因为Aβ40带负电荷,而Cu2+带正电荷,种子中的Cu2+与Aβ40配位结合,中和了Aβ40的部分负电荷,使得种子所带净电荷更接近电中性,从而降低了种子和Aβ40单体之间的静电排斥作用,有利于单体在种子上的延伸生长,进而促进Aβ40的二次成核.并且随着Cu2+浓度的增加这种促进作用也增大,特别是,S5种子中携带的Cu2+最多,平均1个Aβ40与1.48个Cu2+结合,此时种子净电荷最接近0,对Aβ40二次成核的促进作用也最大.综上可以初步认为,纤维状和球形种子均可缩短Aβ40单体聚集生长的延滞期,加速Aβ40聚集纤维化的过程,促进Aβ40的二次成核,但种子对Aβ40二次成核的影响具有形貌依赖性.
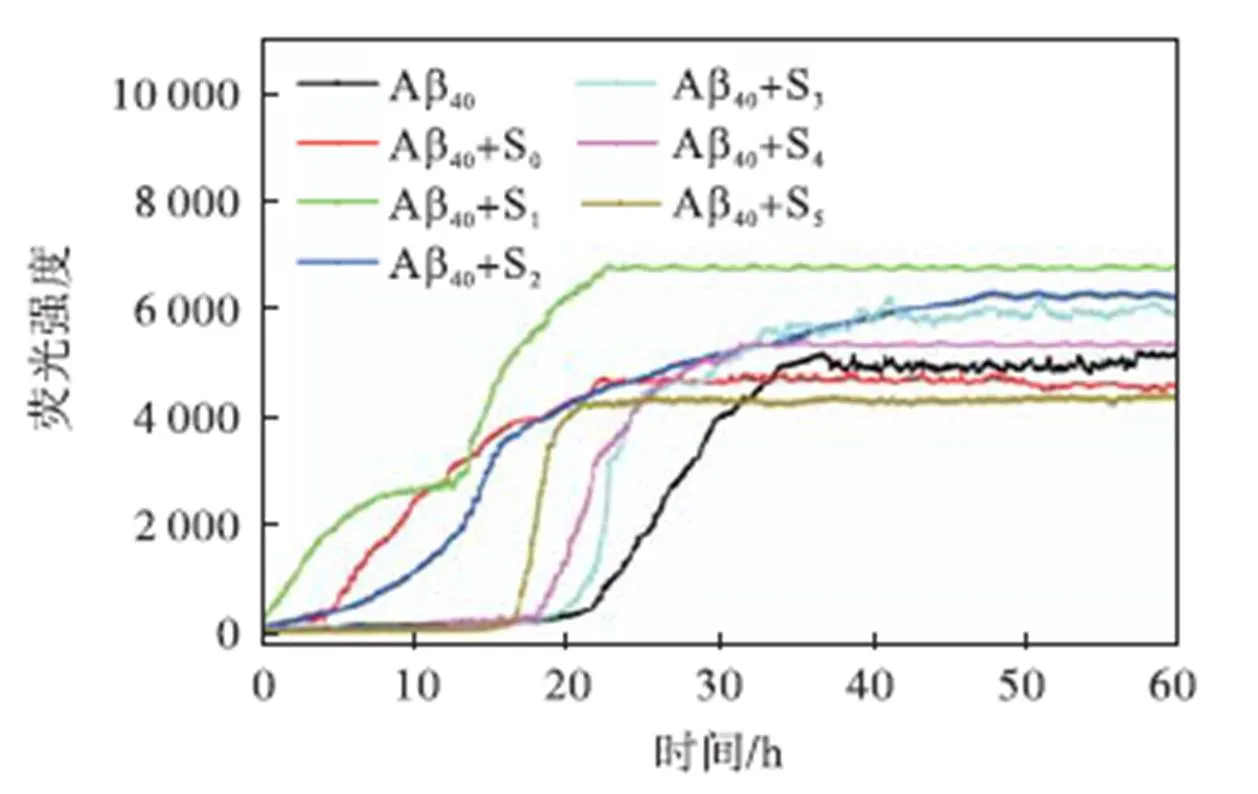
图6 不同浓度Cu2+诱导形成的Aβ40种子对Aβ40聚集二次成核的影响
2.3 Aβ40种子诱导形成的Aβ40聚集体的形貌
图7为利用AFM考察的不同种子诱导的Aβ40聚集体的形貌特征.可以看出,Aβ40单独培养(图7(a))以及与不同浓度Cu2+诱导形成的Aβ40种子共培养(图7(b)~(g))形成的纤维形貌相似,与图6中最终形成相近的ThT荧光强度相一致.说明纤维状和球形种子虽然对Aβ40聚集二次成核的促进作 用不同,但最终均诱导Aβ40聚集形成相似的纤维形貌.

图7 Aβ40种子诱导形成的Aβ40聚集体的形貌
Morriss-Andrews等[29]通过分子动力学模拟研究也得到相似结果,即无定形聚集体同样可以作为种子诱导纤维化聚集.产生这一结果的主要原因是单体可以插入到无定形聚集体中,形成β-折叠位点,诱导发生结构重排,从而可以作为种子结合单体生长并形成纤维化程度更高的聚集体.
2.4 Aβ40种子诱导形成的Aβ40聚集体的二级结构
为了详细考察种子诱导的Aβ40聚集体的二级结构,在此进行了CD实验,结果如图8所示.明显可以看出,单独Aβ40培养72,h后,其CD光谱在216,nm左右出现一负峰,为β-折叠结构的特征峰.表明Aβ40在单独培养72,h后形成的聚集体为β-折叠结构.而加入不含Cu2+的Aβ40种子以及Cu2+诱导形成的Aβ40种子共培养时,同样在216,nm左右有一大小相近的负峰,与图6中最终形成相近的ThT荧光强度以及图7中最终形成相似的纤维形貌相一致.结合图7结果进一步表明,Cu2+诱导形成的纤维状和球形Aβ40种子虽然对Aβ40聚集二次成核的促进作用不同,但最终形成与单独培养的Aβ40相同的富含β-折叠结构的纤维.
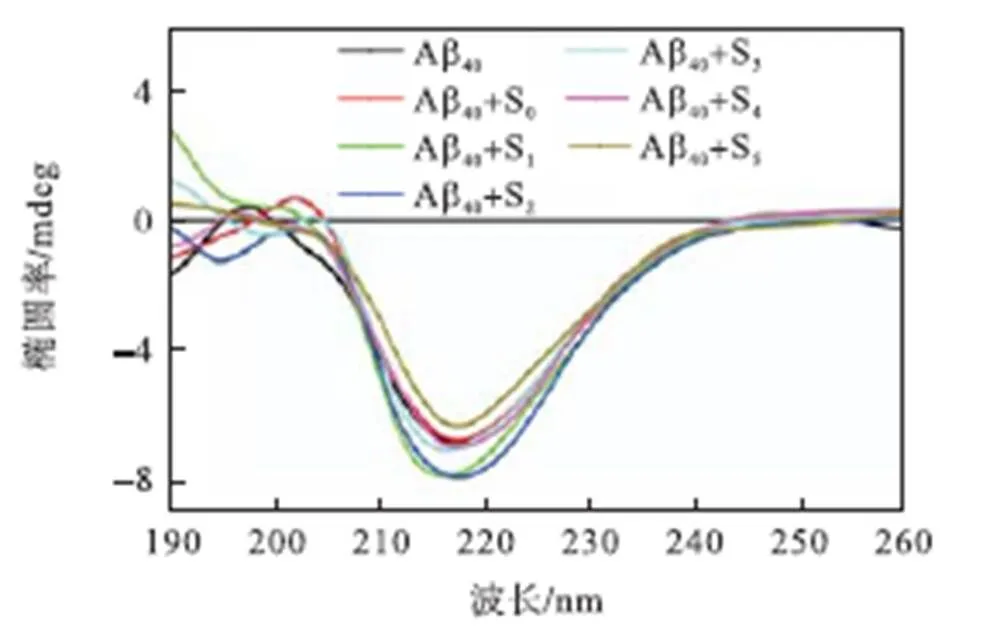
图8 Aβ40种子诱导形成的Aβ40聚集体的二级结构
2.5 Aβ40种子及其诱导形成的Aβ40聚集体的细胞毒性
图9为通过MTT实验考察的Cu2+诱导形成的Aβ40种子的细胞毒性,Aβ40种子的培养浓度为25,μmol/L,在细胞中的最终浓度分别为5.0,μmol/L和0.5,μmol/L.从图9可以看出,0.5,μmol/L的各Aβ40种子对细胞活性均无明显的影响,表明0.5,μmol/L的各种子基本无细胞毒性.而各种子浓度为5.0,μmol/L时,加入Aβ40单独培养形成的种子(S0)能够将细胞活性显著降低至71.9%,;加入不同浓度Cu2+诱导形成的Aβ40种子时,细胞活性进一步显著降低,种子的细胞毒性进一步增大,并且具有Cu2+浓度依赖效应.特别是在加入S5(种子中携带的Cu2+最多)时,细胞活性显著降低至53.8%.这说明Cu2+在加快Aβ40的聚集进程,改变Aβ40的聚集路径(见图1、图2和图4)之后,生成的Cu2+-Aβ40聚集体毒性显著增大,这与Huang等[30]的研究结果相一致.

***代表与对照组相比的显著值p<0.001;###代表与S0 组相比的显著值p<0.001
进一步考察不同种子诱导形成的Aβ40聚集体的细胞毒性,结果如图10所示.Aβ40的培养浓度为25,μmol/L,种子浓度为2.5,μmol/L.Aβ40在细胞中的最终浓度为5.0,μmol/L,与Aβ40共培养的每种种子在细胞中的最终浓度为0.5,μmol/L.从图10可以看出,单独培养的Aβ40聚集体能够将细胞活性显著降低至73.6%;当与S0种子共培养时,其细胞毒性并无显著变化;而与Cu2+诱导的Aβ40种子共培养时,则对其细胞毒性产生了不同程度的影响;在与低浓度Cu2+诱导形成的Aβ40种子(S1)共培养时,对其细胞毒性无显著影响,但随着Cu2+浓度的增加,种子促使Aβ40聚集体的细胞毒性逐渐增大,特别是在S5(种子中携带的Cu2+最多)存在下,细胞活性显著降低至62%.从这些种子的形态上看(见图2),纤维状种子对其诱导的Aβ40聚集体的细胞毒性影响较小,但随着种子由纤维状向球形的转变,其诱导的Aβ40聚集体的细胞毒性显著加剧.然而由图9可知,用于共培养的0.5,μmol/L种子是不会造成额外的细胞毒性的.这说明对细胞的毒性主要来源于种子诱导形成的Aβ40聚集体.以上结果表明,不同Aβ40种子所诱导形成的Aβ40聚集体虽然具有相似的纤维形貌以及相同的二级结构,但所呈现的细胞毒性却大有不同;Cu2+诱导形成的纤维状Aβ40种子对其诱导的Aβ40聚集体的细胞毒性影响较小,而Cu2+诱导形成的球形Aβ40种子则会显著加剧其诱导的Aβ40聚集体的细胞毒性,并对种子中所携带的Cu2+具有浓度依赖效应.
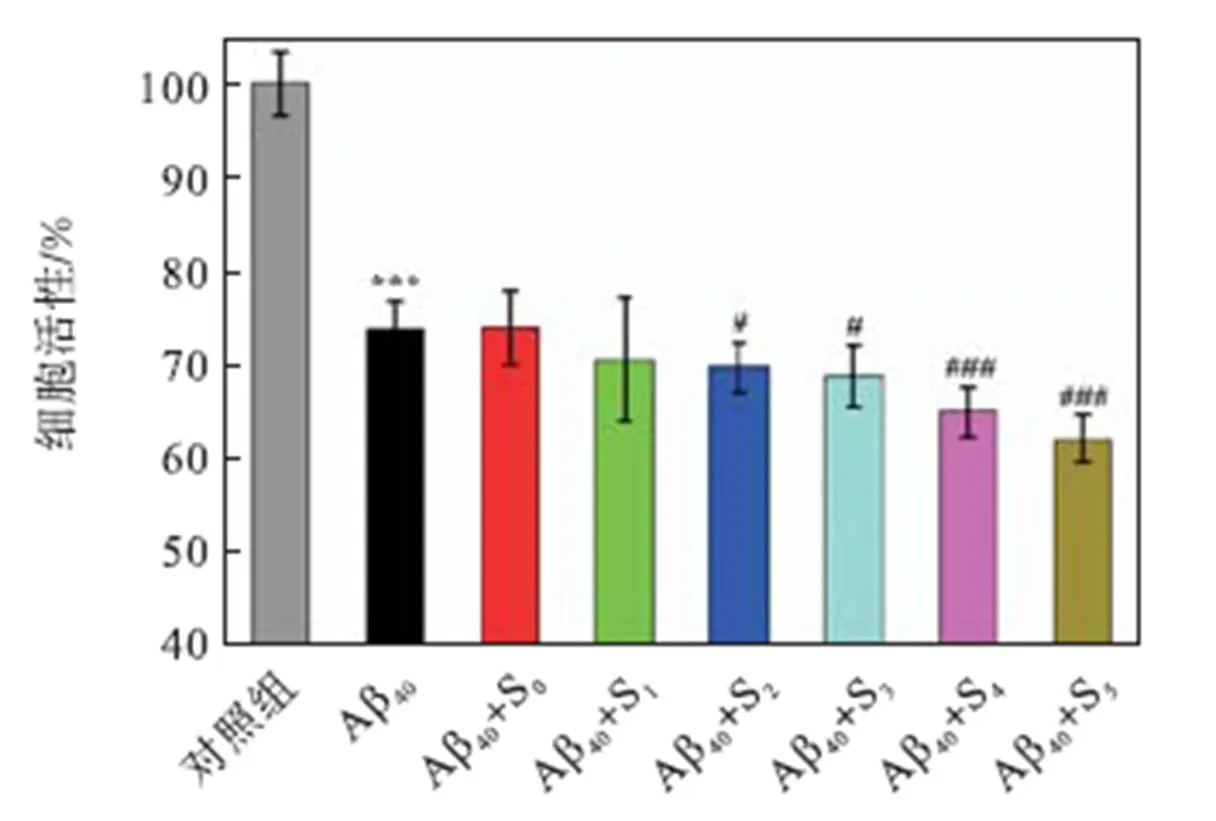
***代表与对照组相比的显著值p<0.001;#和###分别代表与Aβ40组相比的显著值为p<0.05和p<0.001
3 结 语
系统探讨了不同浓度Cu2+诱导的Aβ40种子的形貌、二级结构等特性及其对Aβ40二次成核聚集过程和细胞毒性的影响.从实验结果分析得到:不同浓度Cu2+诱导形成的Aβ40种子的结构形貌不同;随着Cu2+浓度的增加,Cu2+与Aβ40的结合量逐渐增大;种子形貌也由富含β-折叠结构的纤维状转变为无β-折叠结构的球形;这两种形态的种子均可促进Aβ40二次成核,形成富含β-折叠结构的纤维聚集体;其中,具有纤维形态的种子促进作用较强并且具有浓度依赖效应,而球形种子促进作用较弱;尽管两种形貌的种子诱导的Aβ40聚集体的结构和形貌没有明显变化,但是得到的Aβ40聚集体的细胞毒性具有明显差异;纤维状种子对其诱导的Aβ40聚集体的细胞毒性影响较小,而球形种子则会显著加剧其诱导的Aβ40聚集体的细胞毒性,并对种子中所携带的Cu2+具有浓度依赖效应.可见Cu2+不仅能促进Aβ40聚集并产生细胞毒性,而且形成的Cu2+-Aβ40聚集体还能作为种子继续促进Aβ40二次成核并进一步加剧细胞毒性.上述研究成果可为进一步理解Aβ在金属离子存在下的聚集过程和机理解析提供有意义的实验和理论依据.
[1] Selkoe D J. Alzheimer's disease:Genotypes,phenotype,and treatments[J].,1997,275(5300):630-631.
[2] Dickson D W. Neuropathological diagnosis of Alzheimer’s disease:A perspective from longitudinal clinicopathological studies[J].,1997,18(4):S21-S26.
[3] Masters C L,Simms G,Weinman N A,et al. Amyloid plaque core protein in Alzheimer disease and down syndrome[J].,1985,82(12):4245-4249.
[4] Glenner G G,Wong C W. Alzheimer's disease:Initial report of the purification and characterization of a novel cerebrovascular amyloid protein[J].,1984,120(3):885-890.
[5] Bernstein S L,Dupuis N F,Lazo N D,et al. Amyloid-beta protein oligomerization and the importance of tetramers and dodecamers in the aetiology of Alzheimer's disease[J].,2009,1(4):326-331.
[6] Kayed R,Head E,Thompson J L,et al. Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis[J].,2003,300(5618):486-489.
[7] Schmidt M,Sachse C,Richter W,et al. Comparison of Alzheimer abeta(1-40)and abeta(1-42)amyloid fibrils reveals similar protofilament structures[J].,2009,106(47):19813-19818.
[8] Cohen S I,Linse S,Luheshi L M,et al. Proliferation of amyloid-β 42 aggregates occurs through a secondary nucleation mechanism[J].,2013,110(24):9758-9763.
[9] Dong J,Atwood C S,Anderson V E,et al. Metal binding and oxidation of amyloid-beta within isolated senile plaque cores:Raman microscopic evidence[J].,2003,42(10):2768-2773.
[10] Lovell M A,Robertson J D,Teesdale W J,et al. Copper,iron and zinc in Alzheimer's disease senile plaques [J].,1998,158(1):47-52.
[11] Opazo C,Huang X,Cherny R A,et al. Metalloenzyme-like activity of Alzheimer's disease β-amyloid:Cu-dependent catalytic conversion of dopamine,cholesterol,and biological reducing agents to neurotoxic H2O2[J].,2002,277(43):40302-40308.
[12] Viles J H. Metal ions and amyloid fiber formation in neurodegenerative diseases. Copper,zinc and iron in Alzheimer's,Parkinson's and prion diseases[J].,2012,256(19/20):2271-2284.
[13] Chen W T,Liao Y H,Yu H M,et al. Distinct effects of Zn2+,Cu2+,Fe3+,and Al3+on amyloid-beta stability,oligomerization,and aggregation:Amyloid-beta destabilization promotes annular protofibril formation[J].,2011,286(11):9646-9656.
[14] Faller P,Hureau C,Berthoumieu O. Role of metal ions in the self-assembly of the Alzheimer's amyloid-β peptide [J].,2013,52(21):12193-12206.
[15] Xie B L,Dong X Y,Wang Y J,et al. Multifunctional-ity of acidulated serum albumin on inhibiting Zn2+-mediated amyloid β-protein fibrillogenesis and cytotoxicity[J].:,2015,31(26):7374-7380.
[16] Du X B,Wang Z,Zheng Y B,et al. Inhibitory effect of selenoprotein P on Cu+/Cu2+-induced Aβ42aggregation and toxicity[J].,2014,53(3):1672-1678.
[17] Eskici G,Axelsen P H. Copper and oxidative stress in the pathogenesis of Alzheimer’s disease[J].,2012,51(32):6289-6311.
[18] Dorlet P,Gambarelli S,Faller P,et al. Pulse EPR spectroscopy reveals the coordination sphere of copper(II)ions in the 1-16 amyloid-beta peptide:A key role of the first two N-terminus residues[J].,2009,121(49),9437-9440.
[19] Faller P,Hureau C,La Penna G. Metal ions and intrinsically disordered proteins and peptides:From Cu/Zn amyloid-beta to general principles[J].,2014,47(8):2252-2259.
[20] Zatta P,Drago D,Bolognin S,et al. Alzheimer's disease,metal ions and metal homeostatic therapy[J].,2009,30(7):346-355.
[21] Bishop G M,Robinson S R. Quantitative analysis of cell death and ferritin expression in response to cortical iron:Implications for hypoxia-ischemia and stroke[J].,2001,907(1/2):175-187.
[22] Adlard P A,Bush A I. Metals and Alzheimer's disease [J].,2006,10(2/3):145-163.
[23] Schlief M L,West T,Craig A M,et al. Role of the menkes copper-transporting ATPase in NMDA receptor-mediated neuronal toxicity[J].-,2006,103(40):14919-14924.
[24] Pedersen J T,Østergaard J,Rozlosnik N,et al. Cu(Ⅱ)mediates kinetically distinct,non-amyloidogenic aggregation of amyloid-beta peptides[J].,2011,286(30):26952-26963.
[25] Wang Q,Shah N,Zhao J,et al. Structural,morphological and kinetic studies of β-amyloid peptide aggregation on self-assembled monolayers[J].,2011,13(33):15200-15210.
[26] Sarell C J,Wilkinson S R,Viles J H. Substoichiometric levels of Cu2+ions accelerate the kinetics of fiber formation and promote cell toxicity of amyloid-{beta} from Alzheimer disease[J].,2010,285(53):41533-41540.
[27] Brzyska M,Trzesniewska K,Wieckowska A,et al. Electrochemical and conformational consequences of copper(Cu(Ⅰ) and Cu(Ⅱ))binding to β-amyloid(1-40)[J].,2010,10(6):1045-1055.
[28] Damante C A,Ösz K,Nagy Z,et al. The metal loading ability of β-amyloid N-terminus:A combined potentiometric and spectroscopic study of copper (Ⅱ) com-plexes with β-amyloid(1-16),its short or mutated peptide fragments,and its polyethylene glycol(PEG)-ylated analogue[J].,2008,47(20):9669-9683.
[29] Morriss-Andrews A,Bellesia G,Shea J E. Beta-sheet propensity controls the kinetic pathways and morphologies of seeded peptide aggregation[J].,2012,137(14):145104-1-145104-9.
[30] Huang X,Cuajungco M P,Atwood C S,et al. Cu(Ⅱ) potentiation of alzheimer abeta neurotoxicity. Correlation with cell-free hydrogen peroxide production and metal reduction[J].,1999,274(52):37111-37116.
Characteristics of Cu2+-Mediated Aβ40Seeds and Their Effects on Aβ40Aggregation
Dong Xiaoyan,Qi Fengjuan,Zhang Huan,Zhao Yanjiao
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300354,China)
The secondary nucleation mechanism of amyloid β-protein(Aβ)suggests that the pre-formed Aβ aggregates promote Aβ fibrillation as nucleation seeds.The binding of Cu2+to Aβ also accelerates Aβ aggregation.So,it is of great significance to study the effect of Aβ seeds induced by Cu2+on Aβ secondary nucleation.The effects of Aβ40seeds induced by different concentrations of Cu2+on Aβ40aggregation,morphology,secondary structure and cytotoxicity were investigated.The results indicate that with increasing concentration of Cu2+,the morphology of Aβ40seeds changed from fibrils to spherical aggregates.Moreover,Aβ40seeds with two different morphologies both promoted Aβ40secondary nucleation and eventually induced the formation of typical fibril aggregates rich in β-sheet structure.It is shown that the fibrous seeds had greater impact on Aβ40secondary nucleation than the spherical seeds,and they accelerated Aβ40secondary nucleation in a concentration-dependent manner.It is worth noting that there is a significant difference in the cytotoxicity of Aβ40aggregates induced by different morphologies of Aβ40seeds.The comparison shows that the cytotoxicity of Aβ40aggregates induced by spherical seeds was significantly higher than that induced by fibrous seeds.This work clarified the role of Aβ seeds induced by Cu2+in promoting Aβ aggregation,thus providing a theoretical basis for the design and development of potent inhibitors against Aβ aggregation and cytotoxicity.
Alzheimer’s disease;amyloid β-protein(Aβ);copper ions;seed;secondary nucleation
10.11784/tdxbz201801018
TQ463
A
0493-2137(2018)12-1287-09
2018-01-03;
2018-02-26.
董晓燕(1962— ),女,博士,教授.
董晓燕,d_xy@tju.edu.cn.
国家自然科学基金资助项目(21376172).
the National Natural Science Foundation of China(No.,21376172).
(责任编辑:王新英)
