星状神经节阻滞对动脉瘤性蛛网膜下腔出血介入手术脑血管痉挛的防治
2018-11-29王士强陈奇宏
王士强,张 颖,曹 阳,陈奇宏
动脉瘤是导致蛛网膜下腔出血最常见的病因之一,主要见于脑底动脉环的大动脉分支处,可导致患者出现剧烈头痛、恶心、呕吐、颈强直、Kernig氏征等脑膜刺激征反应,严重的患者可进一步并发偏瘫、失语甚至昏迷等功能障碍,威胁患者的生命安全[1]。目前,蛛网膜下腔出血症状较为轻微患者,如Hunt_Hess评估Ⅰ_Ⅱ级患者,均主张给予积极的介入栓塞治疗,可有效封堵动脉瘤,避免动脉瘤破裂威胁患者生命安全。虽然介入栓塞具有微创,迅速封堵动脉瘤的优势,但存在较高的术后脑血管痉挛发生风险,可致迟发性脑缺血、脑梗死和局部脑水肿,是导致患者术后死亡的重要因素[2]。因此,针对动脉瘤型蛛网模下腔出血患者介入术后的脑血管痉挛的预防具有重要意义。目前,已有部分研究发现星状神经节阻滞(stellate ganglion block,SGB)术具有脑保护、改善脑血流的作用,并应用于大脑开颅显微镜下颅内动脉瘤夹闭术的治疗[3]。本文将探讨SGB对介入手术脑血管痉挛的防治和应激反应的影响,现报道如下:
1 资料与方法
1.1 临床资料:收集我院自2016年1月至2017年12月期间,给予全身麻醉下介入治疗的动脉瘤性蛛网膜下腔出血患者60例,采用随机数字表法分为星状神经节阻滞组(SGB组)和对照组,各30例。两组患者一般临床资料见表1,差异均无统计学意义(均P>0.05)。
纳入标准:(1)患者经脑CT、MR、脑血管造影检查结合患者临床表现和体征,确诊动脉瘤性蛛网膜下腔出血;(2)患者Hunt_Hess分级Ⅰ~Ⅱ级,符合介入手术治疗适应证;(3)患者ASA分级Ⅱ_Ⅲ级;(4)本研究符合我院伦理学要求,患者及家属签署知情同意协议,愿意参与并配合本课题研究。
排除标准:(1)患者属于非动脉瘤性蛛网模下腔出血,如动静脉畸形、脑底异常血管网病、颅内肿瘤等所致;(2)患者存在心肺功能不全、肝肾功能障碍等疾病,或不符合星状神经节阻滞适应证。

表1 两组患者一般临床资料比较
1.2 方法:SGB组患者于麻醉诱导前给予患侧星状神经节阻滞,首先确定星状神经节解剖学位置,即星状神经节位于椎动脉三角内,下侧界于第7颈椎横突和第1肋骨颈的高度,内侧界为颈长肌外侧缘,外侧界为前斜角肌及膈神经,前方为颈动脉鞘。故于患者右侧行颈内静脉穿刺置管,协助患者旋转仰卧位,头偏往健侧,常规消毒铺巾,采用超声观察引导穿刺星状神经节,选择线阵探头,以与颈部矢状面45°角探查颈6横突的基部,探查频率10MHz,超声可视下逐层穿刺,避开相关神经、血管直至星状神经节,回抽无血液、气体后给予0.25%甲磺酸罗哌卡因(辰欣药业股份有限公司,国药准字 H20061065,剂量10ml:119.2mg/支),注射6 ~8ml,连接镇痛泵,泵入 0.2%罗哌卡因,2ml/h,持续3d。若患者经阻滞后 5~10min出现阻滞侧结膜充血、瞳孔缩小现象,则认为SGB阻滞。后续手术治疗、相关维持麻醉药物及尼莫地平的使用方法和剂量均与对照组相同。
分别于手术当日早晨和介入手术完成后72h,采用经颅超声多普勒检测大脑前动脉(ACA)、大脑中动脉(MCA)、大脑后动脉(PCA)及椎动脉(VA)的收缩期血流速度峰值(Vs)、舒张期峰值(Vd)和搏动指数(PI),并计算平均血流速度(Vm)。同时,分别于术前和术后72h抽取各患者晨起空腹静脉血,采用放射免疫分析法检测血清胰岛素(InS),采用葡萄糖氧化酶法检测血糖(FBG),采用酶联免疫吸附试验检测β_内啡肽(β_EP),采用电化学发光免疫测定生长激素(GH)。
1.3 评价标准:根据患者MCA平均血流速度诊断脑血管痉挛,即VmMCA>120cm/s则认为患者出现脑血管痉挛现象[4]。InS 的正常值为 5 ~20μU/ml,FBG正常值(3.9~6.1)mmol/L,β_EP的正常值为(46.19±1.41)pg/ml,GH 的正常值 <10ng/ml,患者上述激素大于正常值,其水平越高,则应激反应现象越严重[5,6]。
1.4 统计学处理:软件为SPSS 23.0版统计软件,两组间计数资料采用 χ2检验,计量资料用(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 脑血流动力学变化和脑血管痉挛发生率:见表2。经手术治疗后72h,SGB组患者上述血流动力学指标虽然均有升高,明显低于对照组(P<0.05)。SGB组治疗后72h,脑血管痉挛发生2例,发生率仅6.67%,而对照组痉挛发生 9例,发生率高达30.00%,差异有统计学意义(χ2=5.46,P <0.05)。
表2 两组患者治疗前后脑血流动力学变化比较(±s)
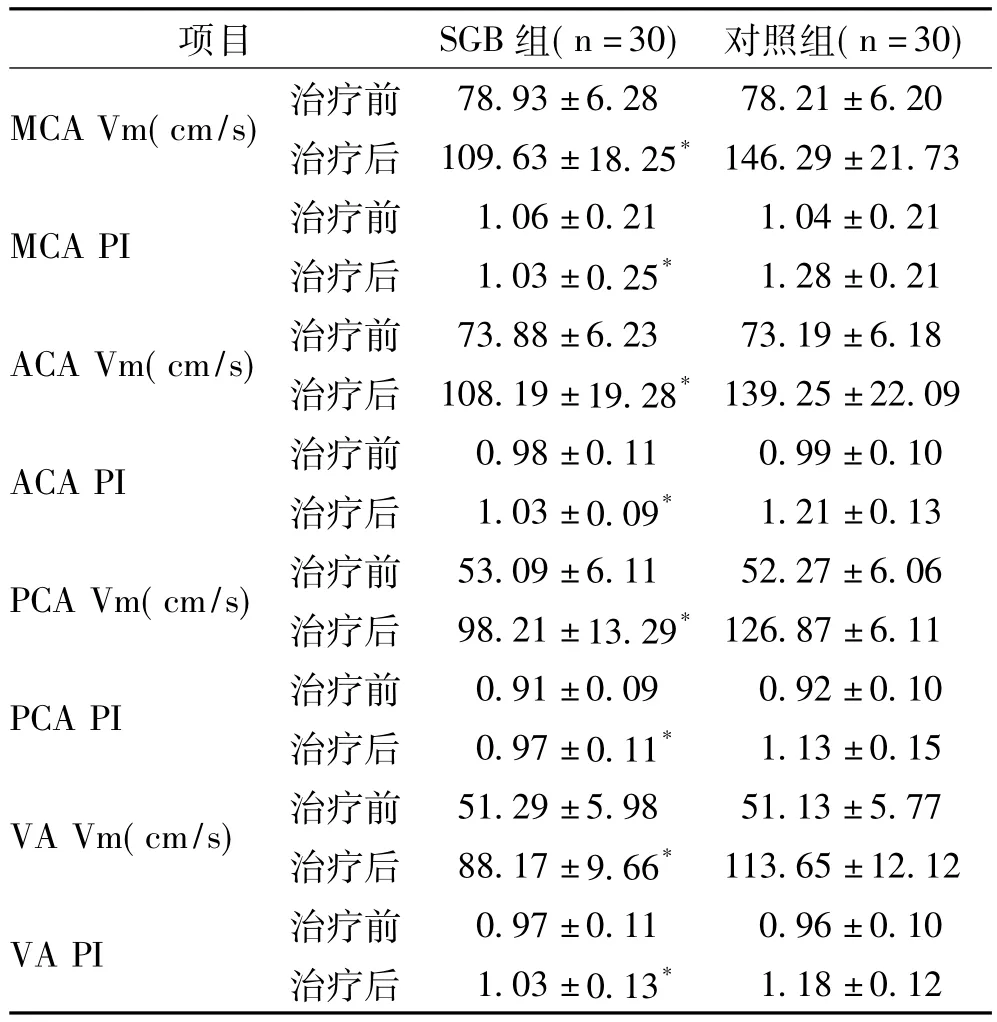
表2 两组患者治疗前后脑血流动力学变化比较(±s)
注:与对照组治疗后比较*P<0.05
项目 SGB组(n=30) 对照组(n=30)MCA Vm(cm/s) 治疗前 78.93±6.28 78.21±6.20治疗后 109.63±18.25*146.29±21.73 MCA PI 治疗前 1.06±0.21 1.04±0.21治疗后 1.03±0.25* 1.28±0.21 ACA Vm(cm/s) 治疗前 73.88±6.23 73.19±6.18治疗后 108.19±19.28*139.25±22.09 ACA PI 治疗前 0.98±0.11 0.99±0.10治疗后 1.03±0.09* 1.21±0.13 PCA Vm(cm/s) 治疗前 53.09±6.11 52.27±6.06治疗后 98.21±13.29*126.87±6.11 PCA PI 治疗前 0.91±0.09 0.92±0.10治疗后 0.97±0.11* 1.13±0.15 VA Vm(cm/s) 治疗前 51.29±5.98 51.13±5.77治疗后 88.17±9.66* 113.65±12.12 VA PI 治疗前 0.97±0.11 0.96±0.10治疗后 1.03±0.13*1.18±0.12
2.2 应激反应变化:见表3,经手术治疗后72h,两组患者上述血清水平均升高,但SGB组升高明显低于对照组(P<0.05)。
表3 两组患者治疗前后血清应激反应相关指标变化比较(±s)
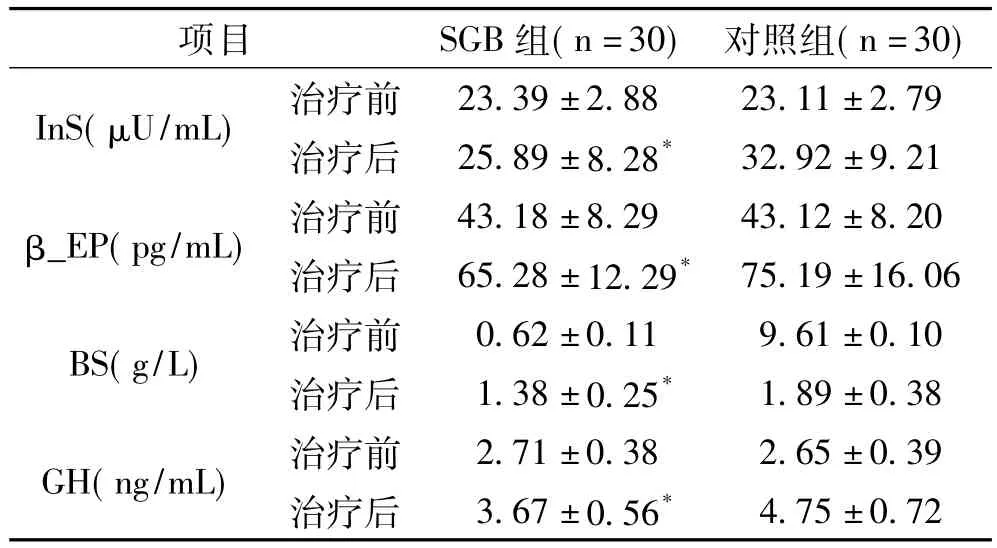
表3 两组患者治疗前后血清应激反应相关指标变化比较(±s)
注:与对照组治疗后比较*P<0.05
项目 SGB组(n=30) 对照组(n=30)32.92±9.21 β_EP(pg/mL) 治疗前 43.18±8.29 43.12±8.20治疗后 65.28±12.29* 75.19±16.06 BS(g/L) 治疗前 0.62±0.11 9.61±0.10治疗后 1.38±0.25* 1.89±0.38 GH(ng/mL) 治疗前 2.71±0.38 2.65±0.39治疗后 3.67±0.56*InS(μU/mL) 治疗前 23.39±2.88 23.11±2.79治疗后 25.89±8.28*4.75±0.72
3 讨论
目前,虽然动脉瘤蛛网膜下腔出血患者的介入治疗或大脑开颅显微镜下动脉瘤夹闭术取得了较为理想的动脉瘤封堵效果,极大地降低了颅内动脉瘤破裂、脑出血的风险,但术后居高不下的脑血管痉挛发生率持续影响动脉瘤的疗效,威胁患者的生命安全[7]。虽然术前、术中或术后持续给予尼莫地平治疗扩张脑血管,依然无法降低脑血管痉挛的发生率[8]。因此,探寻降低术后脑血管痉挛发生率的治疗措施具有重要的临床意义和价值[9]。
星状神经节处于颈部下段,即交感神经干的颈下神经节,由C6、C7和T1神经节融合构成,可支配头部、颈部、上胸部和上臂等区域,具有调节全身神经和抑制神经兴奋的功能[10]。当神经兴奋时,星状神经节持续活化,交感神经张力显著增大,出现脑血管收缩、血压增大,脑血流动力学紊乱,最终并发脑血管痉挛现象。故针对星状神经节进行阻滞,可显著抑制交感神经干的活性,扩张脑血管,拮抗脑血管痉挛,降低脑血管痉挛的发生率[11]。同时,星状神经节阻滞可有效增加脑血管流量,改善脑梗死区域血运,发挥神经保护作用[12]。
此外,针对脑血管痉挛发生的基础研究认为,丝裂原活化蛋白激酶(mitogen_activated protein kinase,MAPK)信号通路和蛋白激酶C通路与脑血管痉挛的密切相关[13]。研究发现星状神经节阻滞具有抗血管内皮细胞氧化,降低细胞内自由基和钙离子水平,阻断MAPK信号通路和蛋白激酶C通路,从而抑制脑血管痉挛的发生[14]。而且,亦有研究报道星状神经节阻滞具有上调一氧化氮合酶活性,上调血管内皮细胞中一氧化氮的含量,从而扩张脑血管,进一步降低脑血管痉挛的发生率[15]。
基于星状神经节阻滞的上述效应,本研究在动脉瘤型蛛网膜下腔出血介入手术患者中给予SGA,观察发现SGA组脑血流动力学指标和脑血管痉挛发生率均低于对照组,证实其在介入手术中亦具有良好的预防脑血管痉挛效果。同时,证实SGA可进一步降低患者应激反应,避免应激反应对患者的损伤。本文研究的病例数有限,今后增加病例数,获取更有说服力的数据,以利于临床的应用。
