大豆油精炼过程中多环芳烃的迁移规律
2018-11-28刘玉兰温运启马宇翔司胜利许利丽刘春梅
刘玉兰,温运启,马宇翔,司胜利,许利丽,刘春梅
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.河南阳光油脂集团有限公司,河南 郑州 450100)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指分子中含有两个或两个以上苯环的一类碳氢化合物[1],目前己知的PAHs类成分有200多种,其中很多是已知或潜在的致癌物质,苯并[a]芘(benzo[a]pyrene,BaP)是致癌性很强的PAHs的代表[2-3]。GB 2716—2005《食用植物油卫生标准》中规定BaP限量为10 μg/kg,欧盟No. 835/2011法规规定食用油(不含可可油和椰子油)中BaP限量为2 μg/kg,苯并[a]蒽、䓛、苯并[b]荧蒽和BaP 4 种PAHs组分(PAH4)的总限量为10 μg/kg[4]。美国环境保护署将萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、䓛、苯并[b]荧蒽、苯并[k]荧蒽、BaP、茚并[1,2,3-cd]芘、二苯并[a,h]蒽、苯并[g,h,i]苝 16 种PAHs组分(PAH16)列为优先控制污染物[5-6]。
PAHs广泛存在于人类生活的自然环境如大气、水体、土壤、作物和食品中[7]。利用植物油料制取的毛油中也或多或少存在一定量的PAHs,采用完善的科学合理的油脂精炼工艺技术对PAHs有很好的脱除作用[8-10]。但若油脂精炼过程仅考虑脱胶、脱酸、脱色和脱臭效果,不对油脂中PAHs脱除做出严格要求和精准技术控制,成品油中PAHs残留可能依然很高,食用油质量安全风险加大。在油脂精炼生产中影响PAHs脱除效果的因素有很多,包括油脂加工助剂中PAHs含量及风险、油脂精炼工艺技术和工艺条件等。刘玉兰[11-12]、张东东[13-14]和张小涛[15]等对花生油、芝麻油、葵花籽油、菜籽油精炼过程PAHs脱除的工艺条件和脱除效果做出了研究报道,但鲜见有对大豆油精炼过程PAHs脱除效果的研究报道。刘玉兰等[16]对油脂加工助剂中铅含量及其对油脂精炼效果的影响做出了研究报道,但鲜见对油脂加工助剂如磷酸、柠檬酸、烧碱、活性白土、硅藻土等PAHs含量的研究报道。若加工助剂中含有PAHs且含量较高,其中的PAHs就有可能在油脂精炼过程中向油脂中迁移对食用油质量安全造成不良影响,因此有必要对油脂加工助剂的PAHs风险开展研究并进行防范,在生产中选用和采购PAHs含量低、风险小的加工助剂。此外,在油脂精炼生产中,毛油中的杂质及有害成分会随精炼各工序进入到相应的副产物如油脚、皂脚、废白土和脱臭馏出物中,这些副产物在后续的综合利用中特别是做为食用原料加工成其他产品如油脚生产食用磷脂、脱臭馏出物生产VE时,可能也存在食品安全风险,但就此内容鲜见研究报道。为研究加工助剂中PAHs含量和精炼过程PAHs在大豆油中的含量变化及向副产物中的迁移情况,本实验从大豆油加工厂采集油脂精炼各工序的油脂样品和对应加工助剂样品以及精炼副产物样品,对样品中PAHs含量进行检测分析,研究大豆油精炼过程PAHs含量变化及迁移规律,为大豆油生产中PAHs风险的有效防范和控制提供支持。
1 材料与方法
1.1 材料与试剂
大豆油精炼过程的脱胶油、脱酸油、脱色油、脱臭油和对应的加工助剂磷酸、烧碱、活性白土以及精炼副产物油脚、皂脚、废白土、脱臭馏出物等,均从郑州一大豆油加工厂的生产线取样。
PAH16混标(质量浓度为200 μg/mL,纯度≥98%)美国O2si公司;PAH16氘代同位素内标(纯度≥97%)美国Dr. Ehrenstorfer GmbH公司;硅胶固相萃取小柱(500 mg,3 mL) 美国Supelco公司;乙腈、甲醇、正己烷、二氯甲烷(均为色谱纯) 美国VBS公司;色谱柱DB-5MS(60 m×0.25 mm,0.25 μm) 美国Agilent公司。其他使用的试剂均为分析纯。
1.2 仪器与设备
ISQ气相色谱-质谱联用仪 美国Thermo Fisher Scientific公司;Trace 1310气相色谱系统(配AI1310自动进样器、Xcalibur软件数据处理系统、I570590固相萃取装置) 美国Supelco公司;LD5-10台式低速离心机 北京京立离心机有限公司;MTN-2800W氮吹浓缩仪 天津奥特赛恩斯仪器有限公司;DW-FL270超低温冷冻储存箱 中科美菱低温科技股份有限公司。
1.3 方法
1.3.1 油脂中PAHs含量的测定
油脂中PAHs检测:参照GB/T 23213—2008《植物油中PAHs的测定 气相色谱-质谱法》和Shi Longkai等[17]优化的SPE-净化-同位素稀释-气相色谱-质谱法。
色谱条件:脉冲不分流模式进样,进样量1.0 μL;进样口温度300 ℃;载气为氦气(纯度≥99.999%);恒流模式,流速1.0 mL/min。升温程序:80 ℃保持1 min,随后以20 ℃/min速率升至180 ℃,3 ℃/min升至200 ℃,6 ℃/min升至250 ℃并保持3 min,再以3 ℃/min升至300 ℃并保持16 min。
质谱条件:离子源温度300 ℃;传输线温度300 ℃;电子电离源;电力能量70 eV;灯丝电流25 μA。
1.3.2 加工助剂及精炼副产物中PAHs含量的测定
加工助剂(磷酸、烧碱和活性白土)中PAHs检测以及精炼副产物(油脚、皂脚、废白土、脱臭馏出物)中PAHs检测参照GB/T 23213—2008和温运启等[18]优化的气相色谱-质谱法。色谱和质谱条件同1.3.1节油脂中PAHs含量测定法。
1.3.3 大豆油精炼过程PAHs脱除率的计算
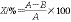
式中:X为大豆油精炼过程PAHs脱除率/%;A为精炼前油脂中PAHs含量/(μg/kg);B为精炼后油脂中PAHs含量/(μg/kg)。
2 结果与分析
2.1 大豆油精炼过程BaP、PAH4、PAH16含量变化

图1 大豆油精炼过程BaP含量变化Fig. 1 Changes in BaP content during refining of soybean oil
从图1可见,大豆油经水化脱胶和碱炼脱酸后,BaP含量均有降低,脱除率分别为7.56%、23.57%。这可能是油脚和皂脚对BaP有一定的吸附作用所致。采用活性白土(用量1%左右)对大豆油进行吸附脱色后,脱色油中BaP含量略有升高。活性白土对BaP的脱除效果很差,在油质量分数3%~5%的条件下,对植物油中BaP的脱除率仅为30%左右甚至更低[19-20]。因此,若活性白土中含有BaP,在油脂脱色过程不仅不能脱除BaP,还可能引起脱色油中BaP含量升高。大豆油经蒸馏脱臭后BaP含量明显降低,其脱除率在所有精炼工序中最高,达到91.65%。
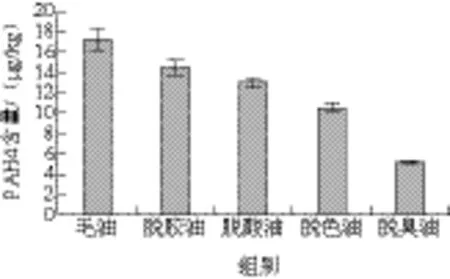
图2 大豆油精炼过程PAH4含量变化Fig. 2 Changes in total content of 4 EU priority PAHs during refining of soybean oil
如图2所示,在大豆油精炼过程中PAH4含量随精炼过程呈现持续降低。在水化脱胶、碱炼脱酸、活性白土吸附脱色和蒸馏脱臭各工序,大豆油中PAH4的脱除率分别为15.93%、10.41%、19.31%、50.91%,总脱除率为70.16%。

图3 大豆油精炼过程PAH16含量变化Fig. 3 Changes in total content of 16 USEPA PAHs during refining of soybean oil
从图3可知,大豆油中PAH16含量在精炼过程中也呈现持续降低。在水化脱胶、碱炼脱酸、白土吸附脱色和蒸馏脱臭各工序,PAH16的脱除率分别为15.45%、11.59%、6.66%、52.99%,总脱除率为67.20%。
综合图1~3可知,相比于水化脱胶、碱炼脱酸、吸附脱色和蒸馏脱臭,蒸馏脱臭过程对BaP、PAH4和PAH16有明显的脱除作用,是大豆油精炼生产中PAHs脱除的关键工序。油脂吸附脱色工序PAHs的脱除率并不高,这是因为该吸附脱色过程采用的吸附剂是活性白土,若采用优选的活性炭(譬如Norit活性炭和汪洋活性炭)对BaP和PAHs的脱除效果都显著好于普通活性炭和活性白土[12-15]。因此,当大豆毛油中PAHs含量较高和风险较大时,为深度脱除油脂中的PAHs,采用复合吸附剂(活性白土+活性炭)进行油脂脱色是合理的工艺技术选择。
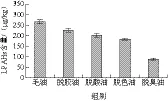
图4 大豆油精炼过程LPAHs含量的变化Fig. 4 Change in LPAH content during refining of soybean oil
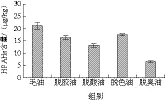
图5 大豆油精炼过程HPAHs含量的变化Fig. 5 Changes in HPAH content during refining of soybean oil
PAHs的危害与其分子中苯环数目(n)有关,轻质PAHs(LPAHs,n≤4)的危害小于重质PAHs(HPAHs,n>4)[21-22]。将PAH16中10 种LPAHs和6 种HPAHs分别统计分析,这两类PAHs在大豆油精炼过程中的含量变化见图4和图5。从图4可知,LPAHs在大豆油精炼过程中持续降低,总脱除率为67.02%,在脱胶、脱酸、脱色、脱臭工序的脱除率分别为14.83%、11.05%、9.26%、52.02%。图5显示,HPAHs经白土吸附脱色后脱色后含量有所上升,说明白土对大豆油中HPAHs的脱除效果很差,在整个精炼过程,HPAHs总脱除率为69.46%。
2.2 大豆油精炼用加工助剂中PAHs含量

表1 大豆油精炼用加工助剂中PAHs的含量Table 1 Contents of PAHs in three agents used for refining of soybean oil μg/kg
从表1可以看出,大豆油精炼所用3 种加工助剂均含有PAHs类成分。BaP、PAH4和PAH16含量,磷酸中分别为0.95、2.81 μg/kg和26.18 μg/kg,烧碱中分别为1.84、16.81 μg/kg和112.61 μg/kg,活性白土中分别为0.71、8.85 μg/kg和111.85 μg/kg。磷酸中PAHs含量相对较低,烧碱中含量最高。活性白土中BaP含量虽不算太高,但PAH16含量相对较高。
加工助剂含有的PAHs在大豆油精炼过程中很可能向毛油中迁移,因为PAHs在油脂中有很好的溶解度。但对照大豆油中BaP、PAH4、PAH16在水化脱胶过程含量分别下降0.33、2.75、44.42 μg/kg,碱炼脱酸过程分别下降0.95、1.51、28.18 μg/kg,可见磷酸和烧碱中的PAHs并未造成油脂中PAHs含量升高。这是因为磷酸水化脱胶所形成的油脚、烧碱碱炼脱酸形成的皂脚均能吸附夹带脱除一定量的PAHs,正常用量的加工助剂和PAHs含量较低的加工助剂不会造成油脂中PAHs含量升高并对其具有一定的脱除效果。但若过量使用加工助剂,或加工助剂中PAHs含量较高,在油脂精炼过程中对油脂中PAHs的脱除效果可能弱于引入效果,引起油脂中PAHs含量的升高。因此在选用和采购加工助剂时,将其中PAHs含量作为一个风险控制指标,对防范加工助剂对油脂PAHs造成不利影响是必要的。
2.3 大豆油精炼副产物中PAHs含量

表2 大豆油精炼副产物中PAHs含量Table 2 Contents of PAHs in soybean oil re fi ning by-products μg/kg
由表2可以看出,大豆油脚样品中BaP、PAH4、PAH16的含量分别为0.45、10.14、261.60 μg/kg,其中组分含量较高的是Nap、Phe、Pyr,分别占总量的38.48%、19.18%、12.03%,HPAHs和LPAHs两类组分的含量分别占总量的3.06%、96.94%。皂脚样品中BaP、PAH4、PAH16含量分别为0.90、7.39、434.49 μg/kg,其中组分含量较高的是Nap、Phe、Flu、Pyr,分别占总量的27.99%、29.04%、9.94%和10.58%,HPAHs和LPAHs含量分别占总量的2.26%、97.74%。废白土样品中BaP、PAH4、PAH16含量分别为0.52、9.69、156.29 μg/kg,组分含量较高为Nap、Phe、Flu、Pyr,分别占总量的21.06%、20.65%、12.61%和23.69%,HPAHs和LPAHs含量分别占总量的4.10%、95.90%。脱臭馏出物样品中BaP、PAH4、PAH16含量分别为12.49、300.50、2 775.15 μg/kg,其中组分含量较高为Nap、Ace、Fl、Phe,分别占总量的25.01%、20.82%、19.19%和14.60%,HPAHs和LPAHs含量分别占总量的6.33%、93.67%。可知油脂精炼副产物中LPAHs占PAHs总量的绝对大比例,同时主要以Nap、Phe、Pyr、Flu、Ace、Fl几种占比最大。
将图1、表1和表2综合分析可知,大豆油吸附脱色过程BaP含量增高0.87 μg/kg,所使用的白土中BaP含量为0.71 μg/kg,脱色废白土中BaP含量为0.52 μg/kg。这说明采用活性白土在油脂脱色过程中,活性白土对毛油中BaP的导入效果大于脱除效果。因此选用BaP和PAHs含量更低的活性白土或采用活性炭做为油脂脱色吸附剂对降低油脂脱色过程BaP和PAHs风险是必要的。大豆油脚富含大豆磷脂,通常用来提取饲用、食用及药用的各种大豆磷脂产品[23],还有研究报道可从大豆油脚中提取辅酶Q10[24]。大豆油水化脱胶所用加工助剂磷酸及对应脱胶副产物油脚BaP含量较低,风险较小,但LPAHs和PAH16总量仍然较高。大豆油皂脚是生产工业脂肪酸的良好原料[25],大豆油碱炼脱酸用烧碱及对应副产物皂脚中BaP含量很低,但烧碱中PAH4、LPAHs及PAH16总量仍显偏高。
BaP、PAH4、PAH16在待脱臭大豆油(即脱色油)中的含量分别为3.95、10.49、200.66 μg/kg,经油脂脱臭过程,脱臭大豆油中的含量降低至0.33、5.15、94.34 μg/kg,大豆油脱臭馏出物中的含量分别为12.49、300.50、2 775.15 μg/kg,分别是脱臭油含量的37.85、58.35、29.42 倍。这一方面是因为PAHs在油脂脱臭过程中被高效从油脂中脱除而迁移至脱臭馏出物中,另一方面是因为油脂脱臭过程产生的馏出物的数量相比于脱臭油的比例很小(油脂脱臭损耗一般不超过1%)[26],因此造成脱臭馏出物中PAHs含量显著升高、PAHs污染严重。而脱臭馏出物中含有多种活性成分[27],是生产天然VE和植物甾醇的良好原料[28-30],还有从大豆油脱臭馏出物中提取角鲨烯的研究报道[31],但脱臭馏出物超高的PAHs的风险,应引起对其综合利用安全性的高度关注。
3 结 论
大豆油精炼用加工助剂磷酸、烧碱和活性白土中均含有PAHs,其中PAHs含量多少及精炼生产中加工助剂用量大小均可能对大豆油精炼过程PAHs含量造成影响,因此应将加工助剂中PAHs含量作为大豆油精炼生产的一个风险防范指标;大豆油水化脱胶、碱炼脱酸、吸附脱色和蒸馏脱臭过程对PAHs均有一定的脱除作用,但采用活性白土对油脂吸附脱色过程对BaP几乎没有脱除作用(基于白土用量1%的结果);大豆油精炼副产物油脚、皂脚、废白土、脱臭馏出物中均含有较高含量的BaP和PAHs,特别是脱臭馏出物中BaP、PAH4 和PAH16含量分别达到12.49、300.50 μg/kg和2 775.15 μg/kg。相比于之前对油脂精炼副产物的研究主要关注其组成成分、综合利用方法而鲜见对其中PAHs含量及风险的研究报道,更应该引起对其做为食品原料综合利用安全性的高度关注。总之,完善的大豆油精炼过程对BaP和PAHs有很好的脱除作用,使之从大豆油中向精炼副产物中迁移和富集,结果是成品油中PAHs含量和安全风险大幅降低,而副产物中PAHs含量显著升高,做为食用原料的风险明显加大,应加强其风险防范。
