褪黑素提高HO-1表达对氯胺酮相关性肾损伤的影响
2018-11-28曾锦江牛得草谭伟明
曾锦江,卢 勇,牛得草,谭伟明,米 华
(广西医科大学第一附属医院泌尿外科,南宁 530021)
氯胺酮是N-甲基-D-门冬氨酸受体的拮抗药[1],因其致幻及中枢兴奋等特性被滥用于各类娱乐场所,现为当今流行毒品K粉的主要成分。在2007年SHAHANI等[2]首次报道9例滥用氯胺酮造成泌尿系统损害后,氯胺酮相关性泌尿系统损害(ketamine associate urinary dysfunction,KAUD)才引起人们的重视,KAUD起初主要表现为尿频、尿急、急迫性尿失禁、尿痛、血尿等,随着病情进展可导致膀胱挛缩和上尿路损害,严重影响生活质量。目前氯胺酮滥用致泌尿系统损害的相关研究大多停留在临床病例报道,临床上更是缺乏统一有效的治疗手段。近期有研究表明,氯胺酮通过氧化应激损伤的激活导致膀胱炎及细胞凋亡的发生、发展[1,3]。褪黑素作为安全、不良反应小的抗氧化剂,可在机体氧自由基刺激下,活化和增加血红素氧化酶-1(HO-1)表达出明显的抗氧化、抗炎和抗凋亡的保护效应[4]。鉴于KAUD在临床上下尿路症状突出表现,与之相关肾损害往往被忽视,而GIMONA等[5]报道一些氯胺酮滥用导致肾功能不全者的肾穿刺检查结果显示肾小管破坏、血管及间质再生,提示氯胺酮导致上尿路损害可能是直接损伤为主。本研究旨在建立氯胺酮导致大鼠肾损害模型,探讨褪黑素对氯胺酮相关性肾损害的保护机制为揭示其中相关的发病机制和治疗方案提供思路。
1 材料与方法
1.1材料
1.1.1主要试剂 盐酸氯胺酮注射液(规格100 mg/2 mL)购于福建古田制药有限公司;褪黑素1 g购自美国Sigma公司;谷胱甘肽过氧化酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所;脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司;HO-1一抗购自英国Abcam公司,内参β-actin和二抗(羊抗兔)均购自美国Cell Signaling Technology公司。
1.1.2主要仪器 电动匀浆机购自德国IKA公司;低温离心机购自德国Eppendorf公司; MK3酶标仪购自上海雷博生物技术有限公司;组织切片机购自德国Leica公司;荧光显微镜及显微镜照相系统购自日本Olympus公司;微量加样器购自德国Eppendorf公司;双垂直电泳槽、半干转膜仪购自上海天能科技有限公司;Odyssey双色红外荧光成像系统购自美国LI-COR公司。
1.1.3实验动物 清洁级SD雄性大鼠32只,体质量190~210 g,购于广西医科大学实验动物中心,饲养于温度、湿度适宜的动物房,本研究已通过动物伦理委员会审核。
1.2方法
1.2.1建立氯胺酮致SD大鼠肾损害模型 参考YEUNG等[6]成功造模及结合本课题组预实验经验,将32只大鼠按随机数字表法随机分为A组(等量生理盐水)、B组(氯胺酮30 mg/kg)、C组(褪黑素5 mg/kg)及D组(氯胺酮30 mg/kg+褪黑素5 mg/kg),各组大鼠每天09:00予以腹腔注射给药,持续12周。褪黑素用量参照文献[4,7]实验的最佳用量。建模过程中,每3天称1次各组大鼠体质量以调整用药量。大鼠于12周后采用10%水合氯醛腹腔注射麻醉,固定、常规备皮,充分暴露大鼠腹主动脉及肾脏,用采血针取腹主动脉血5 mL并置于4 ℃冰箱中静置30 min后取上清液送至广西医科大学药学院实验室平台行血清肌酐及尿素氮检测。同时迅速分离右侧新鲜肾脏,置于-20 ℃保存,用于氧化指标及Western blot检测,随后应用4%多聚甲醛缓冲液灌注固定后,取左侧肾脏浸泡于多聚甲醛缓冲液内用于组织学相关检测。
1.2.2氧化指标测定 准确称取预先保存的各组大鼠新鲜右侧肾脏制备成10%的组织匀浆(冰浴下),4 ℃ 25 000 r/min,离心5 min。取上清液后用冰生理盐水稀释成1%的匀浆。各组MDA水平用硫代巴比妥酸(TBA)法测定,各组肾组织中SOD及GSH-Px水平采用直接比色法检测,组织蛋白水平用微量酶标法(BCA)测定。
1.2.3肾组织切片苏木精-伊红(HE)及马松(Masson)染色 各组大鼠肾组织用4%多聚甲醛固定48 h后,常规行脱水、透明、浸蜡、包埋后,切成5 μm厚度石蜡切片,随后行贴片、脱蜡、水化、HE染色及Masson染色和封片等步骤,在显微镜下观察各组大鼠肾实质、间质等形态变化。
1.2.4TUNEL法检测肾组织细胞凋亡 各组肾脏石蜡切片常规脱蜡后,用3%过氧化氢甲醇溶液清除内源性过氧化物酶的活性。随后,滴加蛋白酶K工作液20 μg/mL,室温下孵育30 min,用PBS冲洗3次后,滴加TUNEL反应液,置于孵育盒中室温下孵育60 min。滴加转化剂-酶标记抗荧光素抗体(POD)之后,再次置于孵育盒中孵育25 min,随后用加入配好的二氨基联苯胺(DBA)显色液,显色5 min并在显微镜下观察颜色深浅控制染色强度,将切片置于HE染液复染,常规脱水、透明及封闭后显微镜下观察凋亡细胞并计数。
1.2.5Western blot测定组织蛋白表达 称取新鲜保存肾组织置于1.5 mL离心管,剪碎后加入蛋白质裂解液(RIPA)和蛋白酶抑制剂(PMSF),冰浴下匀浆之后静置30 min,4 ℃ 15 000 r/min、离心5 min,取上清液采用BCA法测蛋白水平以调整上样量。随后加入上样缓冲液,高温至蛋白质变性,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),之后进行转膜、封闭及漂洗。将膜置于一抗HO-1(兔抗鼠,1∶15 000)及内参β-actin(1∶500)孵育盒,4 ℃摇床过夜,TBST洗膜后,二抗按照1∶10 000稀释,4 ℃摇床孵育3 h,Odyssey双色红外荧光成像系统下扫膜、拍照并测量灰度值,分析结果。计算目的蛋白的灰度值和内参β-actin蛋白灰度值的比值作为目的蛋白的相对表达率。

2 结 果
2.1各组大鼠行为及肾功能指标比较 与A组比较,B、D组大鼠立即出现活动增加、共济失调,随后平静不动;而D组大鼠活跃持续及平静到恢复正常的时间均比B组短。以体质量为协变量调整后,各组大鼠血肌酐及尿素氮采用协方差分析结果显示,B组血肌酐、尿素氮水平较其余各组明显升高(P<0.05),而C、D两组大鼠血肌酐、尿素氮与A组比较,差异无统计学意义(P>0.05),见图1。
2.2各组大鼠肾组织中SOD、GSH-Px及MDA水平比较 与B组比较,A、C、D组MDA水平明显降低,SOD、GSH-Px水平明显升高,差异均有统计学意义(P<0.05);而C组中MDA水平与A组无明显差异,SOD及GSH-Px水平与D组无明显差异(P>0.05),见表1。

a:P<0.05,与A组比较;b:P<0.05,与B组比较

表1 各组大鼠肾组织中SOD及MDA等水平比较
a:P<0.05,与B组比较;b:P<0.05,与A组比较
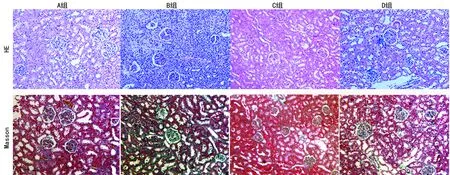
图2 大鼠肾组织HE染色及Masson染色结果(×200)
2.3肾脏组织HE及Masson染色结果 光镜下HE染色可见A、C组大鼠肾组织无明显单核炎症细胞浸润,肾小球及肾小管形态正常;B组大鼠肾间质和肾小球周围可见大量炎症细胞浸润,多处局灶性坏死,甚至出现肾小球萎缩、封闭;与B组比较,D组大鼠炎症细胞浸润减少,肾小球及肾小管尚完整,间质破坏不明显。Masson染色切片显示,B组可见肾组织胶原染色加深,有条索状纤维形成,D组胶原染色与A、C组无明显差别,见图2。
2.4各组TUNEL细胞凋亡结果 A、C组大鼠中肾组织偶见呈棕黄色的阳性细胞(凋亡细胞),可能是正常细胞凋亡的假阳性结果;B组大鼠无论在肾实质还在间质阳性染色细胞明显增多(P<0.05);与B组比较,D组大鼠肾组织的阳性细胞减少明显(P<0.05),只出现少许凋亡细胞。凋亡细胞数半定量结果显示,与A组比较,B组大鼠肾组织凋亡细胞明显增加(P<0.05),而D组凋亡细胞数量比B组明显减少(P<0.05),C、A组大鼠肾凋亡细胞比较差异无统计学意义(P>0.05),见图3、4。
2.5各组大鼠肾组织HO-1蛋白表达水平 与A组比较,B、C、D组大鼠HO-1蛋白水平均明显升高(P<0.05);而D组中HO-1蛋白水平升高更明显(P<0.05),见图5。

a:P<0.05,与A组比较;b:P<0.05,与B组比较;c:P<0.05,与C组比较
3 讨 论
氯胺酮作为毒品“K粉”的主要成分,非法滥用情况逐年递增,不容乐观。氯胺酮的滥用对神经、心血管系统及肝脏的毒副作用已有充分认识,但关于KAUD研究目前仅限于临床治疗,相关的基础研究也大多呈现单一性,未能系统深入的探究,导致临床上尚无统一规范的治疗,其发病机制有待进一步研究[8-9]。
氯胺酮滥用导致的泌尿系统损害由于突出的膀胱刺激症状,其相关性肾损害往往被忽视。GIMONA等[5]发现一些氯胺酮滥用导致肾功能不全者的肾穿刺检查结果显示,肾小管破坏、血管及间质再生,提示氯胺酮导致上尿路损害可能是直接损伤为主,间接损害为辅的病理过程。本研究发现,长期予以氯胺酮注射后,大鼠的血清肌酐及尿素氮水平明显高于其余各组,同时在大鼠肾病理组织切片可见大量炎症细胞浸润,出现肾小球萎缩,间质纤维化严重等,甚至在TUNEL凋亡结果中发现,肾间质和实质细胞凋亡数量明显增加,提示氯胺酮长期作用可导致肾脏的多种直接损害。尽管已发现长期滥用氯胺酮可导致严重泌尿系统损伤,可其治疗方案却无相关研究证据可循,对于一些严重肾积水并感染者,可行患侧肾切除术,由于滥用氯胺酮患者主要为青少年群体,不主张轻易行外科手术治疗,对于此类患者临床上迫切需要有效而明确的药物和治疗手段的出现。
本研究发现长期予以氯胺酮后大鼠肾组织匀浆的MDA水平明显增加,而抗氧化蛋白SOD、GSH-Px水平明显降低,而在予以抗氧化剂褪黑素作用后能有效地降低MDA水平,并提高SOD、GSH-Px水平,另外仅予以褪黑素后SOD、GSH-Px水平也有不同程度提高,说明褪黑素能有效抵抗氯胺酮导致的肾组织氧化损伤和提高抗氧化相关蛋白表达。近年来,氧化应激损伤成为学者们研究肾脏疾病的热点,氧化损伤与反应氮原子和活性氧(ROS)的过量产生相关,ROS使体内自由基增加,自由基中超氧化物和脂质过氧化产物(如MDA)可诱导细胞和组织相应靶分子累积氧化变性或损伤,是造成细胞代谢和功能紊乱的基本环节和重要病理生理基础[10-11],褪黑素是哺乳动物中松果体产生的一种激素,研究表明其具有促进睡眠和强大的抗氧化作用,其作为一种高效的抗氧化剂,能够直接清除氧自由基从而减轻氧自由基对抗氧化酶的破坏,不仅其清除羟自由基的能力及清除烷过氧化物能力是维生素E的2倍[12],而且其几乎无任何有害不良反应[13-14],可在临床上安全推广。
相比于抗氧化酶SOD和GSH-Px,HO-1拥有更为强大的抗氧化特性,例如HO-1能促进抗氧化代谢产物胆红素和胆绿素的形成,可分解血红素(具有强烈氧化毒性的底物)且减少细胞内氧化剂铁和铁蛋白的合成[15]。由于HO-1具有上述突出的抗氧化特性,使得其成为近年来预防氧化损伤备受瞩目的靶基因[16-17]。为了更进一步阐明褪黑素治疗氯胺酮对肾脏的氧化损伤是否与激活HO-1高表达相关,本研究通过Western blot技术观察各组大鼠肾组织HO-1蛋白表达水平,发现仅长期予以氯胺酮注射后大鼠肾组织HO-1的蛋白水平增加并不明显,但在增加褪黑素干预后HO-1蛋白水平明显增加(P<0.05),并且单独予以褪黑素的大鼠肾组织HO-1水平也明显增加(P<0.05),说明氯胺酮可导致肾组织产生氧化应激,使得HO-1表达略微升高,只是机体的自身加强氧化系统防御的机制,但是远不足以抵抗氯胺酮所致的ROS和MDA水平的增加。相比之下,褪黑素可以有效增加HO-1蛋白水平,从而明显抑制MDA水平,表明在氯胺酮导致肾氧化应激性损伤后应用褪黑素可有效增加HO-1蛋白水平,进而拮抗SOD、GSH-Px耗竭,其机制可能与上调HO-1相关靶基因转录的激活有关。
综上所述,本研究结果表明,褪黑素能很大程度上改善氯胺酮导致肾脏氧化损伤,降低脂质过氧化产物(如MDA)水平,提高组织抗氧化蛋白SOD、GSH-Px及HO-1的水平,从而减少炎症细胞浸润,细胞凋亡,肾小球萎缩、封闭及间质纤维形成等,其保护机制可能与增加HO-1蛋白表达有关,而抵抗氧化损伤有望成为研究KAUD的药物靶点。本研究对于揭示氯胺酮相关性肾损害的发病机制、设计合理的药物治疗靶点,为发掘更精确和个性化的诊断和治疗方法可提供研究基础。
