miR-16通过调节Bcl-2的表达活性影响胃癌细胞的生物学行为*
2018-11-26金向东何旭华叶盛威刘洋刘山
金向东 何旭华 叶盛威 刘洋刘山
(1.鄂州市第三医院消化内科,湖北 鄂州 436000;2.湖北省肿瘤医院胃肠外科, 湖北 武汉 430000; 3.武汉市第三医院胸外科,湖北 武汉 430000)
胃癌(Gastric Carcinoma)是世界上第四大常见的恶性肿瘤,是全球因癌症导致死亡的第二大原因[1]。近年随着现代医学的进步,治疗胃癌战略更加多元化[2]。胃癌生长和转移的过程相当复杂,涉及大量致癌基因、抑癌基因和非编码基因等[3]。分子靶向治疗的兴起,对于胃癌患者而言是一个重要的福音[4]。
miRNA是一类小型非编码RNA的家族,其长度范围从20~22个核苷酸不等[5]。越来越多的研究发现,miRNA在调节多种生物过程中起重要作用,如细胞分化、增殖、迁移和凋亡[6-9]。许多miRNA可直接作用于致癌基因和抑癌基因,调控其表达,从而影响肿瘤细胞的生物学行为[10]。
Bcl-2(B-cell lymphoma 2)是人类Bcl-2基因编码的蛋白质,是调节细胞凋亡的Bcl-2家族的创始成员[11]。这是一个重要的抗凋亡蛋白[12],但它并非属于原癌基因,因为它并不是生长信号传感器[13]。尽管存在部分相应的研究基础,但在胃癌中miR-16和Bcl-2的相互关系及其调节机制仍然不清楚。在本研究中,我们通过探寻miR-16在胃癌SGC7901细胞中的表达及其与Bcl-2作用的分子机制,为胃癌的潜在治疗靶点提供新的思路。
1 材料与方法
1.1 细胞培养 胃癌细胞系SGC7901购自中国科学院(中国北京),用含有10%的胎牛血清(Thermo Fisher Scientific,Inc)的RPMI-1640培养基进行培养,加入100μg / ml青霉素和100μg/ ml链霉素(上海远慕生物科技有限公司),加湿,在37℃下含有5%的二氧化碳(CO2)中培养。
1.2 细胞转染 miR-16 mimic、inhibitor和Bcl-2靶向siRNA在上海艾博思生物技术有限公司合成。将SGC7901细胞接种于6孔板中,并在37℃、95%空气和5%CO2的潮湿空气中培养过夜,使其融合度达到70%~90%。随后根据 Lipofectamine 3000试剂(Invitrogen,Carlsbad,California,United States)操作步骤进行转染。
1.3 细胞活性评估 通过细胞计数试剂盒-8(CCK-8,Dojindo Molecular Technologies,Gaithersburg,MD)评估细胞活力。将SGC7901细胞悬液接种在96孔板中,在37℃、5%CO2中预培养24h。用miR-16 mimic、miR-16 inhibitor、Bcl-2 siRNA模拟对照和抑制剂对照转染。48h后向培养基中加入10μlCCK-8溶液,培养物在37℃、5%CO2中孵育1h。使用酶标仪(Bio-Rad,Hercules,CA)在450nm处测量吸光度。
1.4 RNA提取和定量聚合酶链反应(PCR) 用Trizol Reagent(Invitrogen)法对转染的细胞进行RNA提取。使用PrimeScript RT试剂盒(TaKaRa,中国大连),将提取的RNA逆转录成cDNA,用SYBR Premix ExTaq TaKaRa与Stratagene Mx3000P PCR系统(Agilent Technologies,Inc,Santa Clara,CA,USA)进行定量PCR。GAPDH用作mRNA定量的内参。 通过2-ΔΔCT方法计算mRNA的相对表达率。每个基因重复反应3次。进行独立实验3次。
1.5 Western blotting 使用Radio Immunoprecipitation Assay(RIPA)裂解缓冲液(Beyotime Biotechnology,Shanghai,China)提取蛋白质,裂解液中加入蛋白酶抑制剂(Roche,Basle,Switzerland)。使用BCA TM蛋白质测定试剂盒(Pierce,Appleton,WI,USA)对蛋白质进行定量检测。将等量的蛋白质进行凝胶(10%~12%SDS-PAGE)电泳,使用湿转法将蛋白转染至PVDF(Maibio,Shanghai,China)膜上,使用5%脱脂奶粉室温下封闭2h以上。并用以下一抗Bcl-2(ab32124)、pro-caspase-3 (ab32150)、cleaved caspase-3(ab13585)、pro-caspase-9 (ab32068)、GAPDH(ab8245, Abcam, Cambridge, UK) and cleaved caspase-9 (#9501; Cell signaling Technology)进行4℃孵育过夜。然后与二抗(1:5000,Abcam,USA)标记通过辣根过氧化物酶在室温下培养1h,漂洗后,ECL发光。实验重复3次。
1.6 细胞凋亡实验 细胞凋亡采用FITC膜联蛋白V凋亡检测试剂盒(北京中国生物技术研究所)。将miR转染的细胞再用PBS洗涤两次,然后用5μl PI和10μl FITCAnnexin V中染色,在黑暗中37℃室温中孵育1h。最后使用流式细胞仪FACS进行分析。
1.7 划痕实验 将胃癌SGC7901细胞接种于6孔板,待细胞融合度达到90%时,用已灭菌消毒的200μl枪头垂直划线,并在显微镜下测量划痕的初始位置及距离(0 time)后置于恒温孵箱中孵育72h,再次测量划痕的距离,并计算细胞的迁移率。细胞迁移率的计算公式=[迁移距离D(0h)-迁移距离D(72h)]/ 迁移距离D(0h)。实验重复3次。

2 结果
2.1 miR-16在胃癌SGC7901细胞中的转染效率 为确定miR-16是否参与胃癌肿瘤的发生,将miR-16mimic、miR-16inhibitor及其相应的对照分别转染入SGC7901细胞。通过PCR检测转染效率,结果显示,miR-16 mimic组表达明显上调[(1.01±0.14)%vs(1.89±0.23)%,P<0.01],而miR-16 inhibitor组显著下调[(1.06±0.15)%vs(0.28±0.11)%,P<0.01],见图1。
2.2 miR-16对SGC7901细胞迁移和活性的影响 通过CCK-8划痕实验测定miR-16在SGC7901细胞上的生物学功能。miR-16过表达时SGC7901细胞的活性[(103.4±8.5)% vs(72.4±10.4)%,P<0.05]和相对迁移率[(98.8±10.8)% vs(67.6±11.5)%,P<0.05]远低于对照组。而细胞活性 [(98.6±9.70) % vs(121.2±11.1)%,P<0.05]和相对迁移率[(104.5±11.0%)% vs(120.5±11.6)%,P<0.05]在miR-16 inhibitor组则高于对照组,表明miR-16能抑制SGC7901细胞迁移和活性,见图2A、B。
2.3 miR-16对SGC7901细胞凋亡的影响 在miR-16过表达时,SGC7901细胞凋亡百分比显著增加[(3.2±0.7)% vs(11.3±1.3)%,P<0.001],而miR-16下调时对细胞凋亡没有明显影响[(3.3±0.3)% vs(3.5±0.9)%,P>0.05],见图3A。进行western blot检测凋亡相关蛋白表达,结果显示,miR-16 mimic激活凋亡相关蛋白cleaved caspase-3和cleaved caspase-3的表达,而miR-16抑制时这些蛋白表达却相反,且pro-caspase-3和procaspase-9的蛋白水平未被miR-16过表达或抑制所调控,见图3 B。这些结果表明,miR-16可能是潜在的胃癌抑制基因,能诱导胃癌细胞SGC7901的凋亡。
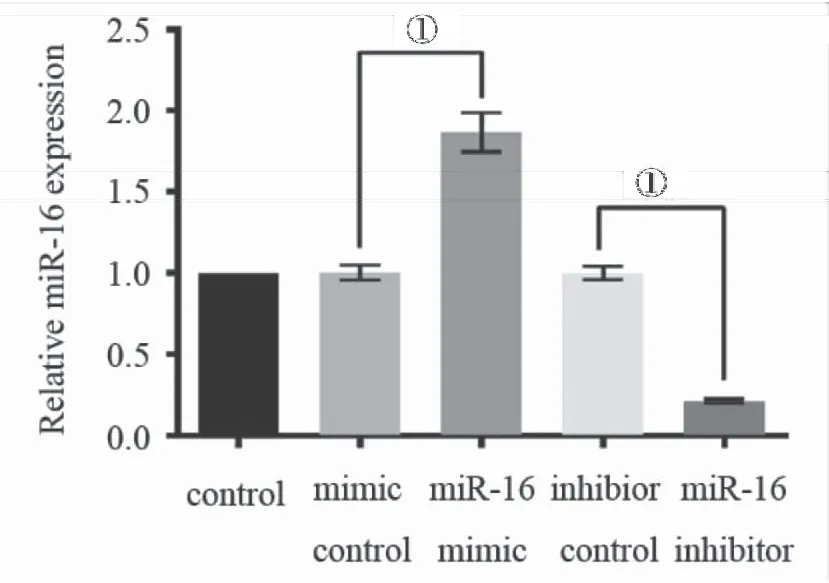
图1miR-16mimic,miR-16inhibitor及其相应的对照转染入SGC7901细胞后miR-16的表达情况
Figure1TheexpressionofmiR-16mimic,miR-16inhibitoranditscorrespondingcontroltransfectedSGC7901cells
注:与mimic、inhibitor比较,①P<0.01

图2 miR-16mimic、miR-16inhibitor及其相应的对照对细胞迁移和活性影响Figure 2 Effect of miR-16mimic, miR-16 inhibitor and their corresponding controls on cell migration and activity
注:与mimic、inhibior比较,①P<0.05

图3 miR-16 对SGC7901细胞凋亡率及凋亡相关蛋白的影响Figure 3 Effect of miR-16 on apoptotic cells rate and apoptosis-related proteins of SGC7901注:与mimic比较,①P<0.01
2.4 miR-16对Bcl-2表达的影响 为进一步探索miR-16在胃癌SGC7901细胞中对Bcl-2调控的影响,将miR-16mimic、miR-16inhibitor及其相应的对照转染入SGC7901细胞,通过western blot检测Bcl-2蛋白水平。结果表明,miR-16过表达后Bcl-2的表达明显下调,而miR-16抑制后Bcl-2明显上调,见图4。故推测在胃癌中Bcl-2受到miR-16负性调节。

图4miR-16mimic,miR-16inhibitor对Bcl-2蛋白表达的影响
Figure4EffectofmiR-16mimicandmiR-16inhibitoronBcl-2proteinexpression
2.5 Bcl-2对SGC7901细胞迁移和活性的影响 为进一步验证Bcl-2是否参与miR-16对SGC7901细胞的调控,通过使用Bcl-2特异性siRNA用于沉默Bcl-2后与miR-16 inhibitor进行共同转染。结果显示,miR-16inhibitor转染后SGC7901的细胞活性[(103.5±9.3)% vs(126.7±10.6)%,P<0.05]和迁移 [(100.1±10.4)% vs(132.3±11.9)%,P<0.05] 显著增加,而与Bcl-2 siRNA共转染后可以消除miR-16 inhibitor对细胞活性[(126.7±10.6)% vs(74.3±8.3)%,P<0.01]和迁移[(132.3±11.9)% vs(80.6±12.1)%,P<0.01]的促进作用,见图5。说明Bcl-2能消除miR-16对SGC7901细胞迁移和活性的影响,反向验证了miR-16对Bcl-2的调控作用。

图5 Bcl-2 siRNA与miR-16inhibitor共转后对SGC7901细胞迁移和活性的影响Figure 5 The migration and activity after Bcl-2 siRNA co-transfection with miR-16 inhibitor on SGC7901 cell 注:A.与inhibitor、inhibitor+si-Bcl-2比较,①P<0.05;B.与inhibitor control、inhibitor+si-Bcl-2比较,②P<0.001
2.6 Bcl-2对SGC7901细胞凋亡的影响 结果显示,miR-16 inhibitor与Bcl-2 siRNA共转染后,凋亡细胞明显增加[(3.4±0.5)% vs(12.2±0.9)%,P<0.001],见图6A。western blot分析结果显示,与miR-16inhibitor相比,miR-16inhibitor与Bcl-2siRNA共转染后会活化cleaved caspase-3和cleaved caspase-3的表达,但pro-caspase-3和procaspase-9的蛋白水平无明显变化。这些结果表明,Bcl-2可改变miR-16对SGC7901细胞凋亡的影响,见图6B。

图6 Bcl-2 siRNA与miR-16inhibitor共转后对SGC7901细胞凋亡的影响Figure 6 The effect of apoptosis after Bcl-2 siRNA co-transfection with miR-16 inhibitor on SGC79013注:与inhibitor +si-Bcl-2比较,①P<0.01
3 讨论
对于胃癌患者而言,特别是晚期患者,传统的二联或三联细胞毒性化疗方案的中位生存期约为9~11个月[14]。虽然联合化疗较单药化疗能一定程度上提高肿瘤缓解率和总体生存率,但联合用药也显著增加化疗的毒性[15]。来自基因表达谱的数据表明,胃癌的病理和临床表现的差异可能是由于独特的分子表型所导致的[16]。近些年来,学者们发现了胃癌的各类分子靶向药物,并应用于治疗中,包括靶向HER2、EGFR、MET、FGFR、PI3K / MTOR和血管生成通路的药物[17]。例如,用曲妥珠单抗治疗HER2阳性的胃癌已经导致总体存活率的显著增加[18]。与传统的治疗模式相比,这些新的靶向分子能显著提高患者的生存获益。
目前越来越多的证据表明,非编码miRNA可能参与肿瘤的发病机制,其功能和潜在应用已成为目前研究热点[19]。miR-16与人类癌症相关,包括乳腺癌、结肠直肠腺癌、肺癌等[20-22]发病和发展有关。有研究表明,miR-16能通过在非小细胞肺癌细胞中激活自噬来抑制TGF-β1诱导的上皮-间质转化[23]。还有研究表明,miR-16还能通过抑制癌基因BMI1诱导乳腺癌细胞中的线粒体依赖性细胞凋亡[24]。但是miR-16在胃癌中的作用机制,以及对胃癌细胞的增殖、迁移和凋亡的影响尚未得到深入的研究。在本研究中我们证明了miR-16的过表达抑制胃癌SGC7901细胞的活力和迁移,并促进细胞凋亡,起到抑癌的作用。这也印证了文献中miR-16的作用方式。
Bcl-2基因在细胞存活和凋亡抑制中起关键作用。许多研究已经表明,Bcl-2可以被几种miRNA调控。目前已经确定Bcl-2基因的损伤导致了多种恶性肿瘤的发生,包括黑素瘤、乳腺癌、前列腺癌、慢性淋巴细胞白血病和肺癌等[25-29]。XU等研究发现,MicroRNA-19a能抑制鼻咽癌CNE1细胞活力和迁移,而且是通过抑制Bcl-2而诱导细胞凋亡[30]。SHEN等在体外证明,miR-16通过体外靶向Bcl-2诱导大鼠活化的胰腺星状细胞凋亡[31]。然而没有足够的信息证明miR-16调节Bcl-2在胃癌中的作用。因此,我们的研究首次揭示了在胃癌中miR-16和Bcl-2之间的潜在关系。实验结果证明,miR-16能抑制Bcl-2蛋白的表达。此外,Bcl-2的沉默可以消除miR-16抑制对细胞活性和迁移的促进作用,并可促进细胞的凋亡,而Bcl-2在胃癌SGC7901中被miR-16反向调节。
4 结论
本研究表明,miR-16能抑制细胞活性和迁移,诱导胃癌SGC7901细胞凋亡,因此miR-16可能是潜在的胃癌抑制基因。此外,miR-16可能通过靶向调控Bcl-2发挥对SGC7901细胞的作用。这些结果提示miR-16在治疗胃癌中发挥一定作用,可能是潜在的胃癌抑制基因,有望成为下一个治疗胃癌的新靶点。
