慢病毒干扰SKA1对前列腺癌PC-3细胞增殖及CDK4和cyclin D1表达的影响
2018-11-26曹志华牛桂林胡跃世
王 阳,曹志华,牛桂林,刘 磊,朱 清,胡跃世,李 征
(南阳市中心医院泌尿外科,河南南阳 473000)
前列腺癌是欧美地区男性发病率最高的恶性肿瘤,也是导致发达国家男性癌症相关死亡的重要原因。近年来,前列腺癌在中国的发病率和死亡率呈现上升的趋势[1-2]。因前列腺癌发病部位隐匿,大部分患者确诊时已发生骨转移,丧失手术良机,而长期抗雄激素治疗则导致前列腺癌由雄激素敏感性逐渐进展为去势抵抗性,预后极差。基因治疗与分子靶向治疗是目前新兴起的癌症治疗方法[3]。纺锤体和动粒相关蛋白1(spindle and kinetochore associated protein 1,SKA1)与SKA2、SKA3共同构成三元复合物SKA,是动粒与微管蛋白结合所必需的成分。SKA复合物在真核生物的有丝分裂过程中发挥关键作用,为真核生物生长、发育的基础。多项研究显示[4-6],SKA1在肿瘤生长过程中发挥重要作用,SKA1沉默可影响非小细胞肺癌、肝细胞癌、胃癌等多种癌细胞的恶性增殖,抑制其周期进程。但SKA1与前列腺癌的相关性研究鲜有报道。本研究通过慢病毒载体介导的RNAi技术来沉默前列腺癌PC-3细胞中SKA1的表达,观察其对PC-3细胞增殖以及细胞周期进程的影响,探讨其治疗前列腺癌的潜在价值。
1 材料与方法
1.1细胞株与试剂去势抵抗性前列腺癌PC-3细胞以及人类胚胎肾细胞系293T购自中国科学院细胞库(上海,中国;慢病毒载体pLVTHM购自武汉淼灵生物公司;RPMI-1640培养基、0.25%胰蛋白酶和胎牛血清均购自美国Gibco公司;PCR引物购自上海生工公司;转染试剂盒购自北京博迈斯生物公司;Trizol总RNA提取试剂盒购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo公司;荧光定量PCR试剂盒购自宝生物大连公司;兔多克隆抗体SKA1、细胞周期蛋白依赖性激酶4(cyclin-dependent protein kinases 4,CDK4)、cyclinD1购自美国Sigma公司;羊抗兔IgG-HRP购自上海碧云天生物公司;噻唑蓝(MTT)试剂盒购自上海歌凡生物公司;MX-3000P荧光定量PCR仪和EPICSXL流式细胞仪购自Beckman Couhe公司。
1.2细胞培养及传代取适量PC-3细胞接种于含10%胎牛血清的RPMI-1640培养液(含100 U/mL青霉素和100 U/mL链霉素)中,放置在37℃、5%CO2孵箱中培养,每3 d传代1次,一般传至3~5代,处于对数生长期的细胞可用于转染。293T细胞在Dulbecco改良的含10%FBS的Eagle’s培养基(Hyclone)中孵育,置于37℃、5%CO2孵箱中培养。
1.3慢病毒表达载体Lv-shSKA1的构建、包装及滴度测定根据GenBank提供的人SKA1 基因的mRNA序列(NM_001039535),利用siRNA设计软件(http://jura.wi.mit.Edu/bioc/siRNAext/home.Php)设计3条siRNA序列,根据抑制效率,确定抑制效率最高的SKA1序列,添加EcoRⅠ、XmaⅠ酶切位点,其siRNA引物序列为:上游5′-GGCTggatccATGGCCTCGTCAGATCTGGAAC-3′,下游为5′-AAGGCCCGGGGGTTATAACATAACGAGTAAGT-3′,引物序列由上海生工公司合成。用EcoRⅠ、XmaⅠ双酶切慢病毒载体pLVTHM,用T4连接酶将SKA1目的片段与慢病毒表达载体连接,然后转化到大肠杆菌 DH5α。筛选阳性克隆,抽提质粒,进行PCR鉴定,然后送往上海生工进行测序。将重组质粒及慢病毒包装质粒用Lipofectami 共同转染至293T 细胞,转染8 h后,弃去含有质粒的培养基,换成完全培养基,继续培养48 h,收集上清液,离心,过滤,并进行滴度测定。
1.4慢病毒转染PC-3细胞取处于对数生长期的PC-3细胞,接种于6孔板,每孔约5×104个细胞,37℃、5%CO2培养箱中培养,待细胞融合度达到70%~80%时开始转染,操作步骤参照转染试剂盒说明书。将PC-3细胞分别与含20 μL Lv-shSKA1慢病毒或Lv-shCon的转染试剂共培养4 d后,荧光显微镜下检测GFP表达,评估感染效率。
1.5实时荧光定量PCR(qRT-PCR)检测转染4 d后,收集各组(空白组、Lv-shCon组和Lv-shSKA1组)PC-3细胞,利用Trizol法提取RNA,经琼脂糖凝胶电泳检测其完整性,并用紫外分光光度计检测其纯度及浓度。取1.0 μg总RNA,采用逆转录试剂盒合成cDNA。取5 μL稀释20倍的cDNA为模板,加入10 μL SYBR Green qPCR Super Mix(2×)、0.4 μL ROX Reference DyeⅡ(50×)、0.5 μL上下游引物,最后加ddH2O至20 μL,在实时荧光定量PCR仪上扩增。反应条件:95 ℃ 45 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,扩增40个循环。实验进行3次生物学重复,以GAPDH作为内参基因。采用2-ΔΔCt法分析qRT-PCR结果,ΔCt=Ct目的基因-Ct内参基因;ΔΔCt=ΔCt实验组- ΔCt对照组。siRNA干涉效率=(2-ΔΔCt目的基因-2-ΔΔCt内参基因) / 2-ΔΔCt目的基因× 100%。引物序列见表1。

表1 SKA1和GAPDH引物序列
1.6蛋白质印迹(Westernblot) 转染4 d后,收集各组(空白组、Lv-shCon组和Lv-shSKA1组)PC-3细胞,按常规步骤提取细胞蛋白,采用BCA法进行蛋白定量,并调节好蛋白浓度。每组取50 μg蛋白样品,与适量上样缓冲液混合,煮沸变性;SDS-PAGE电泳;转至PVDF膜,置于含5%脱脂奶粉的TBST溶液,避光封闭1 h;TBST漂洗后,将膜置于一抗稀释液(兔多克隆抗体SKA1、CDK4、cyclin D1按1∶1 000稀释)中,4 ℃孵育过夜;次晨TBST漂洗后,置于二抗稀释液(山羊抗兔IgG溶液按1∶1 000稀释)中,室温孵育1 h,TBST漂洗3遍;将发光液均匀加在膜上,反应5 min,置于暗盒中曝光、显影和定影。使用GIS-2020数码图像分析系统扫描并分析蛋白杂交条带。以GAPDH作为内参蛋白。
1.7MTT法检测细胞增殖收集各组慢病毒干扰5 d的PC-3细胞,按每孔1.0×105个细胞接种至96孔培养板,每组设置5个复孔。在37℃、5%CO2孵箱中分别继续培养1、2、3、4和5 d。培养终止前4 h每孔加入20 μL MTT液(5 mg/mL,用PBS溶解),在37℃继续培养4 h后,小心弃去上清,向每孔加入150 μL DMSO,振荡溶解结晶。采用酶标分析仪在595 nm波长处检测各孔的吸光度(A595)值。
1.8流式细胞仪检测细胞周期收集各组慢病毒干扰5 d的PC-3细胞,按每孔1.0×105个细胞接种至6 cm培养皿,每组设置3个重复。待细胞覆盖率达80%时,弃掉培养液,收集细胞;D-Hanks漂洗1遍,胰酶消化后终止,收集细胞;4 ℃预冷PBS漂洗1遍,收集细胞;100 μL PBS重悬细胞,用900 μL 4 ℃预冷70%乙醇4 ℃固定1 h;弃掉固定液,PBS漂洗,加入20 μL PI染色液,4 ℃避光孵育30 min;PBS漂洗,过滤,用EPICSXL流式细胞仪进行数据采集并分析。

2 结 果
2.1慢病毒转染后PC-3细胞的形态观察感染72 h后,荧光显微镜检测Lv-shSKA1慢病毒感染PC-3细胞情况。结果发现,Lv-shCon组和Lv-shSKA1组细胞GFP阳性率均达80%以上,说明重组慢病毒Lv-shSKA1对PC-3细胞具有较好的亲嗜性(图1)。

图1荧光显微镜观察慢病毒转染后PC-3细胞形态(×10)
Bright:明场视野;GFP:绿色荧光视野。
2.2转染PC-3细胞SKA1mRNA表达水平qRT-PCR结果显示,SKA1 mRNA在空白组与Lv-shCon组细胞中的表达水平差异不具有统计学意义(P>0.05);与Lv-shCon组比较,SKA1 mRNA在Lv-shSKA1组细胞中表达水平显著下调,差异有统计学意义(P<0.05,表2)。
2.3转染PC-3细胞SKA1蛋白表达水平Western blot结果显示,SKA1蛋白在空白组与Lv-shCon组细胞中的表达水平差异不具有统计学意义(P>0.05);与Lv-shCon组比较,SKA1蛋白在Lv-shSKA1组细胞中表达水平显著下调(P<0.05,图2、表2)。
表2 慢病毒转染PC-3细胞后SKA1 mRNA相对表达水平及相对灰度值

表2 慢病毒转染PC-3细胞后SKA1 mRNA相对表达水平及相对灰度值
组别SKA1(2-ΔΔCt)水平SKA1灰度空白组1.03±0.130.407±0.018Lv-shCon组0.98±0.210.396±0.011Lv-shSKA1组0.26±0.07∗0.294±0.038∗F值42.25330.828P值0.000 0.000
与Lv-shCon组比较,*P<0.05。

图2 慢病毒转染PC-3细胞后SKA1蛋白表达
2.4慢病毒转染对PC-3细胞增殖的影响MTT实验结果显示,空白组与Lv-shCon组细胞增殖速率差异不具有统计学意义(P>0.05);与Lv-shCon组比较,Lv-shSKA1组细胞增殖速率显著较慢(P<0.05,表3)。
表3 慢病毒转染PC-3细胞后不同时间点的A595值
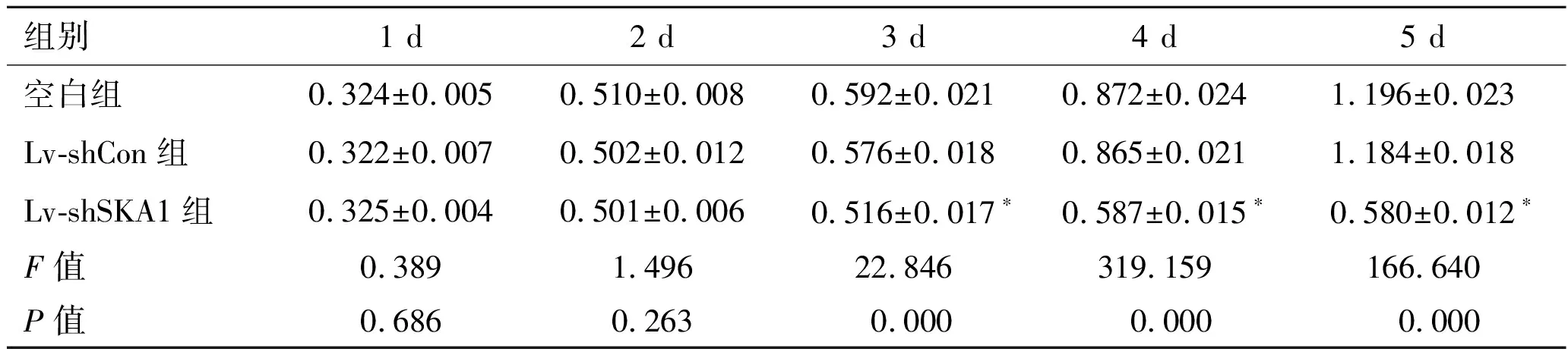
表3 慢病毒转染PC-3细胞后不同时间点的A595值
组别1 d2 d3 d4 d5 d空白组0.324±0.0050.510±0.0080.592±0.0210.872±0.0241.196±0.023Lv-shCon组0.322±0.0070.502±0.0120.576±0.0180.865±0.0211.184±0.018Lv-shSKA1组0.325±0.0040.501±0.0060.516±0.017∗0.587±0.015∗0.580±0.012∗F值0.3891.49622.846319.159166.640P值0.6860.2630.0000.0000.000
与Lv-shCon组比较,*P<0.05。
2.5慢病毒转染对PC-3细胞周期分布的影响流式细胞仪检测结果显示,与Lv-shCon组比较,Lv-shSKA1组G0/G1期细胞数显著减少(P<0.05),S期细胞数显著增加(P<0.05),大部分细胞停滞于S期(表4)。
表4 慢病毒转染PC-3细胞后各组G0/G1、S、G2/M、sub-G1所占百分比

表4 慢病毒转染PC-3细胞后各组G0/G1、S、G2/M、sub-G1所占百分比
组别G0/G1SG2/M空白组61.73±1.5829.61±2.5811.53±1.08Lv-shCon组60.46±0.9631.58±0.8612.11±0.73Lv-shSKA1组48.84±1.68∗39.36±1.49∗12.81±0.52F值121.30241.4603.128P值0.0000.0000.081
与Lv-shCon组比较,*P<0.05。
2.6慢病毒转染对PC-3细胞CDK4、cyclinD1蛋白表达的影响Western blot结果显示,与Lv-shCon组比较,Lv-shSKA1组细胞CDK4、cyclin D1蛋白表达水平均显著下调(P<0.05,图3、表5)。
表5 慢病毒转染PC-3细胞后CDK4、cyclin D1蛋白表达相对灰度值

表5 慢病毒转染PC-3细胞后CDK4、cyclin D1蛋白表达相对灰度值
组别CDK4cyclinD1空白组0.431±0.0260.413±0.014Lv-shCon组0.425±0.0180.406±0.024Lv-shSKA1组0.305±0.015∗0.312±0.021∗F值61.861 39.336P值0.0000.000
与Lv-shCon组比较,*P<0.05。

图3 慢病毒转染PC-3细胞后CDK4、cyclinD1蛋白表达
3 讨 论
前列腺癌早期患者主要以根治性手术切除为主,中晚期患者则以内分泌治疗-雄激素剥夺疗法(androgen deprivation therapy,ADT)为主。治疗初期,ADT治疗对多数患者效果明显,但随着治疗时间的延长,多数患者均会进展成去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),缩短患者生存期[7-8]。因此,探索CRPC的分子发生机制,寻找其关键作用靶点,将为靶向治疗提供新的实验证据。PC3细胞株是一种从人前列腺癌骨转移肿瘤中分离出来的雄激素非依赖性前列腺癌细胞株,目前被广泛用于去势抵抗型前列腺癌的基础和临床研究[9]。近年来,RNA干扰技术成为广泛用于研究肿瘤细胞增殖、凋亡、转移及细胞周期的一种分子生物学工具,用于肿瘤的基因靶向治疗具有极大的临床应用前景。本研究中我们应用慢病毒介导的RNAi抑制SKA1在前列腺癌PC-3细胞中的表达,初步研究其在前列腺癌中的功能和作用,为后期的靶向治疗提供理论依据。
纺锤体和动粒相关蛋白1(SKA1)是近期发现的、与有丝分裂密切相关的基因,是动粒结合微管蛋白必不可少的组成部分,其表达异常可造成纺锤体检测点发生缺陷,在细胞周期调控和肿瘤的发生、发展过程中发挥重要作用。SKA1在乳头状甲状腺癌、非小细胞肺癌、肝细胞癌、胃癌、肾癌、前列腺癌等多种癌组织中的表达均显著癌旁正常组织,与临床分期、淋巴结转移、侵袭等密切相关,参与了相关肿瘤的细胞增殖进程[ 10-12]。然而SKA1与前列腺癌的相关性研究鲜有报道,是否也发挥类似作用,尚不得而知。本研究中我们采用shRNA干扰技术下调SKA1表达,并应用MTT检测SKA1下调对前列腺癌细胞增殖的影响,结果显示,Lv-shSKA1组细胞增殖速率慢于Lv-shCon组,说明慢病毒介导的SKA1沉默能够抑制前列腺癌PC-3细胞的体外增殖,与他人研究结果类似[ 13-14],提示SKA1在前列腺癌增殖过程中也发挥重要作用。
细胞周期失控是肿瘤形成的关键因素。SKA1是一种重要的微管结合蛋白,与SKA2、SKA3组成蛋白复合物SKA,对微管蛋白的解聚起着调控作用,使染色体移向两级,保证细胞顺利进行有丝分裂,防止产生非整倍体。细胞增殖过程中非整倍体的产生是绝大部分恶性肿瘤的共同特征[15-16]。SKA1缺乏可造成染色体分离异常,而过表达则可造成细胞间期微管成核,其缺乏或过表达均对有丝分裂的正常进程造成严重影响。SKA复合物或其成分缺乏可造成染色体排列不整齐或延迟,导致有丝分裂在分裂中期停滞,而不能进入分裂后期[17-18]。学者研究显示,SKA1缺乏使胃癌MGC80-3细胞周期阻滞在S期,进而抑制增殖[19]。本研究中我们的研究结果与其一致,流式检测结果显示,SKA1基因沉默后G0/G1期细胞数显著减少,S期细胞数显著增加,即大量细胞在S期停滞,表明SKA1能够影响细胞的周期分布,可能是造成肿瘤细胞恶性增殖的一个重要原因,SKA1有望成为治疗前列腺癌的靶标基因。
迄今为止,SKA1沉默抑制肿瘤细胞增殖和细胞周期进程的的分子机制尚不明确,因此,我们进一步研究SKA1沉默对细胞周期相关蛋白的影响。CDK4、cyclin D1是影响肿瘤细胞周期进程的2个关键调控分子,cyclin D1是G1期的细胞周期蛋白,与CDK4在G1期结合成复合物,接着在氨基端与视网膜母细胞瘤编码蛋白pRb结合并使其磷酸化,释放出转录因子E2F,调控细胞由G1期进入S期,对细胞的分裂增殖起着促进作用[20-21]。本研究中我们的结果显示,,SKA1基因表达沉默后,前列腺癌PC-3细胞中CDK4、cyclin D1蛋白表达显著下调,这与QIN等[5]在肝癌中的研究结果类似,因此,我们有理由推测SKA1敲低后抑制前列腺癌细胞生长的机制可能部分通过下调CDK4和Cyclin D1的表达来实现的。
总之,这些研究结果表明SKA1可能通过调节细胞周期相关蛋白在前列腺癌细胞生长中发挥重要作用,慢病毒介导的SKA1 沉默将会和其他分子标志物一样成为治疗前列腺癌的新的治疗策略。不过本研究只是对SKA1在前列腺癌中的功能及下游调控蛋白进行初步研究,研究层面尚浅,后续还需继续从机制上进行深入研究。
