RXR介导的自噬通路在大鼠肺缺血/再灌注损伤中的调控作用*
2018-11-26项冰倩CHENJunhao楼国强周卓琳武垣伶张晶晶许益笑王万铁
项冰倩, 高 慧, CHEN Jun-hao, 楼国强, 周卓琳, 武垣伶, 张晶晶, 许益笑, 王万铁△
(1温州医科大学缺血/再灌注损伤研究所, 浙江 温州 325035; 2浙江省台州医院病理科, 浙江 临海 317000;3School of Biomedical Sciences, University of Western Australia, Perth 6000, Australia)
肺缺血/再灌注损伤(pulmonary ischemia/reperfusion injury,PIRI)是指肺组织细胞缺血一定时间后,再恢复血流灌注,组织细胞的损伤程度迅速加剧。PIRI是一种复杂且广泛的病理生理学过程,心血管系统疾病及大血管手术、器官移植术、脓毒血症和失血性休克时均存在PIRI现象,同时PIRI也是溶栓及肺移植术后严重影响患者预后的关键因素之一[1]。近年来,细胞自噬与PIRI关系的研究备受关注。自噬是指真核细胞通过溶酶体降解细胞中受损的蛋白质和细胞器,从而维持内环境的稳定,是真核生物进化后高度保守的一种细胞自稳程序[2-4]。在生理情况下,自噬维持在较低的水平,通过降解多余的或对细胞有损伤作用的细胞器与蛋白质,为细胞提供保护作用[5];在病理情况下,如氧化应激、细胞营养缺乏及缺血/再灌注损伤等能诱导过度的自噬,过度自噬可破坏细胞内结构和功能均正常的蛋白质和细胞器,有时能导致自噬性细胞死亡[6]。研究表明[2]自噬参与肺缺血/再灌注损伤的发生发展,但其具体发生机制目前尚未完全阐明。
维甲酸X受体(retinoid X receptor,RXR)属于核受体超家族中的一个子家族,作为配体转录因子,RXR在细胞内可与自身结合形成同源二聚体,或与其它因子形成异源二聚体[7]。在配体的作用下,核受体被激活后,通过与反应元件(response element,RE)的特异性DNA序列结合来控制靶基因表达的水平。被激活后的RXR在体内可对脊椎动物细胞的分化、发育、死亡及新陈代谢产生影响,在体外可诱导部分肿瘤细胞系的分化。研究表明, RXR在机体内可通过多条信号通路干预心血管及肿瘤、各类皮肤病、糖尿病等疾病的病理发展过程[8-11],但RXR是否参与了肺缺血/再灌注损伤目前尚不明确。因此,本实验通过建立大鼠肺缺血/再灌注模型,明确细胞自噬对缺血/再灌注肺的影响;同时用RXR激动剂与抑制剂对模型进行干预,探讨RXR在PIRI中的可能作用及机制,以及对PIRI期间发生的细胞自噬的调控作用,为将来RXR的临床应用治疗提供充分的实验依据和理论基础。
材 料 和 方 法
1 动物
SPF级健康雄性Sprague-Dawley(SD)大鼠70 只,体重(200±20) g,由温州医科大学动物实验中心提供,许可证号为SCXK (浙)2015-0009。
2 主要试剂
9-顺式维甲酸(9-cis-retinoic acid, 9cRA)和HX531(Sigma);抗LC3、mTOR/p-mTOR、beclin 1和GAPDH抗体(Abcam);抗RXRα抗体(Bioss);辣根酶标记山羊抗兔 II 抗(中国博蕴);免疫荧光 II 抗(上海翊圣生物科技有限公司);牛血清白蛋白(Gibco);逆转录试剂盒(Thermo);BCA蛋白定量试剂盒和DAPI染色液(中国碧云天生物技术研究所)。
3 主要方法
3.1实验分组及大鼠肺缺血/再灌注模型的制备 采用随机数字表法将SD大鼠分为7组,每组10只:正常对照(control,C)组、假手术(sham,S)组、假手术+RXR激动剂9-顺式维甲酸(S+9cRA,SRA)组、假手术+RXR抑制剂HX531(S+HX531,SH)组、肺缺血/再灌注(I/R)组、肺缺血/再灌注+9-顺式维甲酸(RA)组和肺缺血/再灌注+HX531(HX531)组。C组不做任何处理;S组术前不注射任何药物,术中只行气管插管和开胸,不夹闭左侧肺门,行机械通气210 min;SRA组术前90 min 腹腔注射9-顺式维甲酸(5 mg/kg);SH组术前90 min和术前30 min分别腹腔注射9-顺式维甲酸(5 mg/kg)和HX531(5 mg/kg);I/R组术前不注射任何药物,术中行左肺门阻断30 min再灌注180 min;RA组术前90 min 腹腔注射9-顺式维甲酸(5 mg/kg);HX531组术前90 min和术前30 min分别腹腔注射9-顺式维甲酸(5 mg/kg)和HX531(5 mg/kg)。
依据文献采用SD大鼠在体左侧肺门夹闭制备缺血/再灌注模型[12]:5%的水合氯醛以10 mL/kg腹腔注射进行麻醉,消毒胸颈部皮肤后切开并分离皮下组织和肌肉,暴露气管T型切开,气管插管后接呼吸机行机械通气,呼吸机参数为:吸呼比为3∶ 4,呼吸频率为70次/min,100%氧浓度,潮气量30 mL/min。于左胸部3~5肋间处开胸并游离左侧肺门,动脉夹阻断左肺门30 min,30 min后恢复血流再灌注180 min。灌注结束后处死大鼠并取肺组织。
3.2肺组织病理学观察及肺泡损伤定量指标的评估 实验结束后,立即用已消毒的眼科剪取大鼠左下肺大小约1 cm×1 cm×1 cm 的肺组织,经预冷的PBS缓冲液漂洗后放入装有4%多聚甲醛的离心管内,进行组织固定(固定时间约2~3天)。组织固定后经梯度乙醇脱水、包埋、切片、脱蜡后进行HE染色,随后光学显微镜(×200)下观察各组肺组织标本的形态学变化。在×400视野下每张切片随机连续观察50个视野,计算每个视野下的损伤肺泡数及总肺泡数(当肺泡内出现水肿渗出液或出现红细胞或白细胞超过2个以上时均可视为损伤的肺泡),计算损伤肺泡数与总肺泡数的比值,把损伤肺泡数占总肺泡数的百分比值作为肺泡损伤定量评估指数(index of quantitative assessment,IQA)。
3.3免疫荧光法检测肺组织RXRα的表达量 实验结束后取各组大鼠左下肺大小约1 cm × 1 cm × 1 cm的肺组织,经预冷PBS缓冲液漂洗后放入装有4%多聚甲醛的离心管内,进行组织固定,常规行石蜡包埋切片,经脱蜡、水化、孵育、煮片、 I 抗及 II 抗的结合、胞核染色、封片后,暗室下用正置荧光显微镜(×400)观察RXRα的表达并拍片。
3.4RT-PCR法检测肺组织中LC3、beclin 1和mTOR 的mRNA表达 取大鼠肺组织加液氮研磨,以 TRIzol 法提取总RNA,测定RNA浓度,按照RT-PCR试剂盒说明书进行cDNA合成及扩增。PCR参数为:预变性94 ℃ 3 min;变性94 ℃ 30 s,退火60 ℃ 30 s,延伸 72 ℃ 1 min,循环 33 次;终止延伸72 ℃ 5 min。以GAPDH为内参照。引物序列见表1。结果用 Quantity One 分析。以目的基因条带灰度值和内参照条带灰度值的比值反映其表达水平。
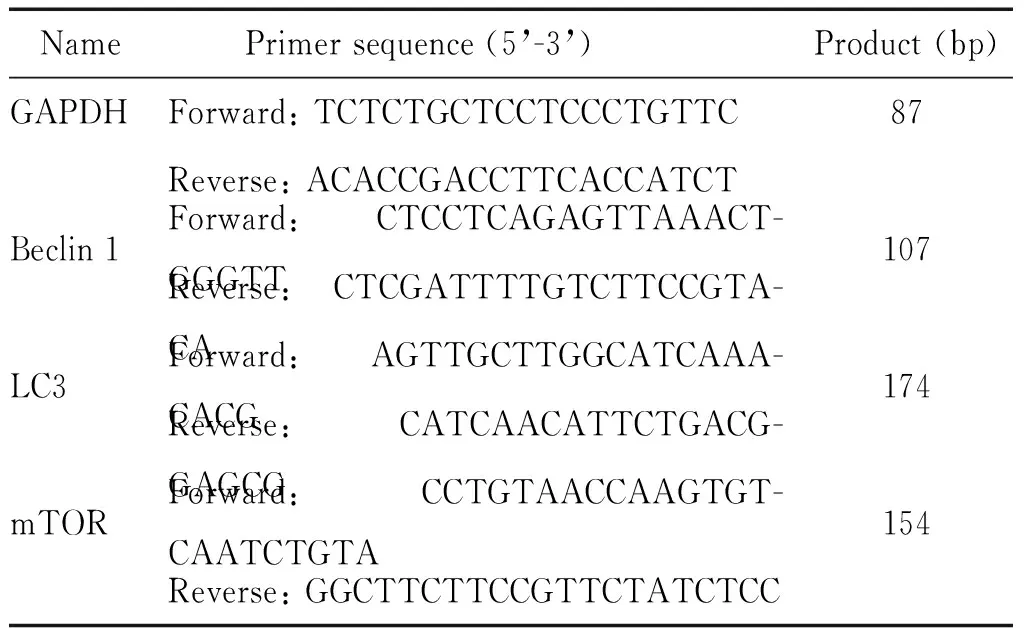
表1 RT-PCR的引物序列
3.5Western blot检测肺组织LC3-II、beclin 1和p-mTOR的蛋白水平 低温下充分研磨肺组织,以400 μL RIPA(含4 μL PMSF)裂解组织,混匀后吸取匀浆液4 ℃离心取上清,BCA 蛋白定量试剂盒测蛋白浓度并绘标准曲线,样品蛋白定量成2 g/L,变性煮沸10 min。配胶进行电泳,上样量20 μg,湿转至PVDF膜,5% 脱脂奶粉室温封闭2 h, TBST漂洗, I 抗(LC3-II、beclin 1和p-mTOR 抗体)均以1 ∶1 000稀释;GAPDH 抗体以1 ∶5 000稀释,4 ℃孵育过夜,TBST洗涤3次,每次7 min, II 抗室温孵育1 h。TBST洗涤3次,每次5 min,加ECL工作液,反应2 min,暗室曝光,显影、定影后,凝胶分析软件分析蛋白条带灰度值。取目的蛋白条带灰度值和内参照GAPDH条带灰度值的比值。计算p-mTOR与mTOR的比值,以反映mTOR蛋白的磷酸化水平。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠肺组织光镜观察结果
光镜下观察可见,C组肺间质及肺泡结构清晰完整,肺泡壁薄,间质无水肿,无炎症细胞浸润,肺泡内未见渗出液或红细胞漏出;S组、SRA组和SH组肺间质及肺泡结构基本完整,无肺间质增宽,肺毛细血管轻微扩张充血,肺泡腔内可见散在分布的红细胞与炎性细胞,未见透明膜形成;I/R组与HX531组肺泡结构紊乱,偶见部分肺泡变形塌陷,局部肺泡壁有水肿增厚或破裂,肺间质水肿,肺毛细血管局部扩张、充血,白细胞渗出,肺泡腔内可见大量红细胞漏出,肺泡壁内有较多炎性细胞浸润;与I/R组和HX531组相比,RA组肺泡结构轻微紊乱,肺泡塌陷、变形数量减少,肺间质水肿及肺毛细血管扩张、出血程度均有明显减轻,肺泡腔内红细胞漏出减少,肺泡壁内炎性细胞浸润程度减轻,见图1。
2 各组大鼠肺泡损伤定量评估结果
与C组相比,SRA、SH组和S组的IQA差异无统计学显著性;与C组相比,I/R组、RA组和HX531组的IQA明显升高(P<0.05);与I/R组相比,RA组的IQA明显下降(P<0.05),而与HX531组比较差异无统计学显著性;与RA组相比,HX531组的IQA明显升高(P<0.05),见图1。
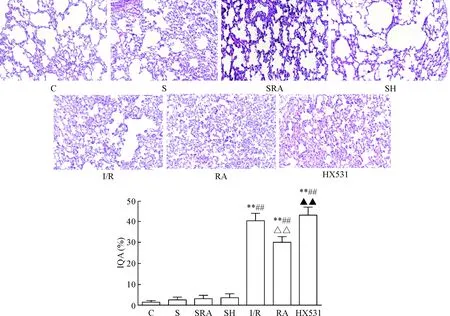
Figure 1.HE staining of lung tissue and the change of IQA in each group (×400). Mean±SD. n=10. ** P<0.01 vs C group; ## P<0.01 vs S group; △△ P<0.01 vs I/R group; ▲▲P<0.01 vs RA group.
3 各组大鼠肺组织RXRα免疫荧光结果
光镜下观察可见,C组、S组、SH组的RXRα表达量较低,SRA组的RXRα表达量较高;与C组、S组和SH组相比,I/R组、RA组与HX531组的RXRα表达量轻度增加;与I/R组和HX531组相比,RA组RXRα表达水平有所增高;I/R组和HX531组RXRα表达水平无明显差异,见图2。
4 各组大鼠肺组织RT-PCR检测结果
与C组相比,I/R组、RA组和HX531组的LC3和beclin 1的mRNA表达明显升高,mTOR的mRNA表达明显降低(P<0.01);与I/R组相比,RA组LC3和beclin 1的mRNA表达明显下降,mTOR的mRNA表达明显增高(P<0.01),而与HX531组比较差异无统计学显著性;与RA组相比,HX531组的LC3和beclin 1 mRNA表达明显升高,mTOR的mRNA表达明显降低(P<0.01),见图3。
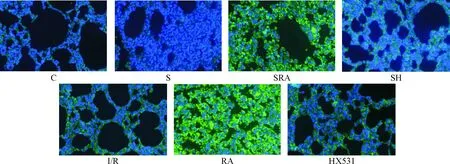
Figure 2.Immunofluorescence of RXRα in the lung tissues from each group (×400).
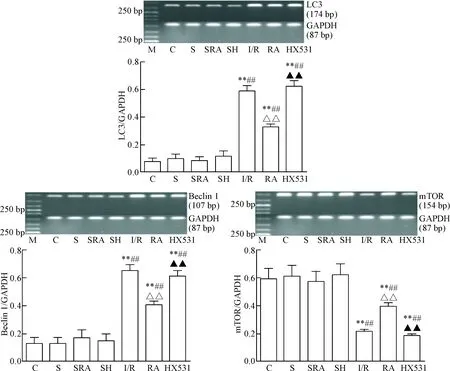
Figure 3.The mRNA expression of LC3, beclin 1 and mTOR in each group. M: DNA marker. Mean±SD. n=10. **P<0.01 vs C group; ##P<0.01 vs S group; △△P<0.01 vs I/R group;▲▲P<0.01 vs RA group.
5 各组大鼠肺组织Western blot检测结果
与C组相比,I/R组、RA组和HX531组的LC3-II和beclin 1蛋白表达明显升高,p-mTOR的蛋白水平明显降低(P<0.01);与I/R组相比,RA组LC3-II和beclin 1的蛋白水平明显下降,p-mTOR的蛋白水平明显增高(P<0.01),而与HX531组比较差异无统计学显著性;与RA组相比,HX531组的LC3-II和beclin 1蛋白水平明显升高,p-mTOR的蛋白水平明显降低(P<0.01),见图4。
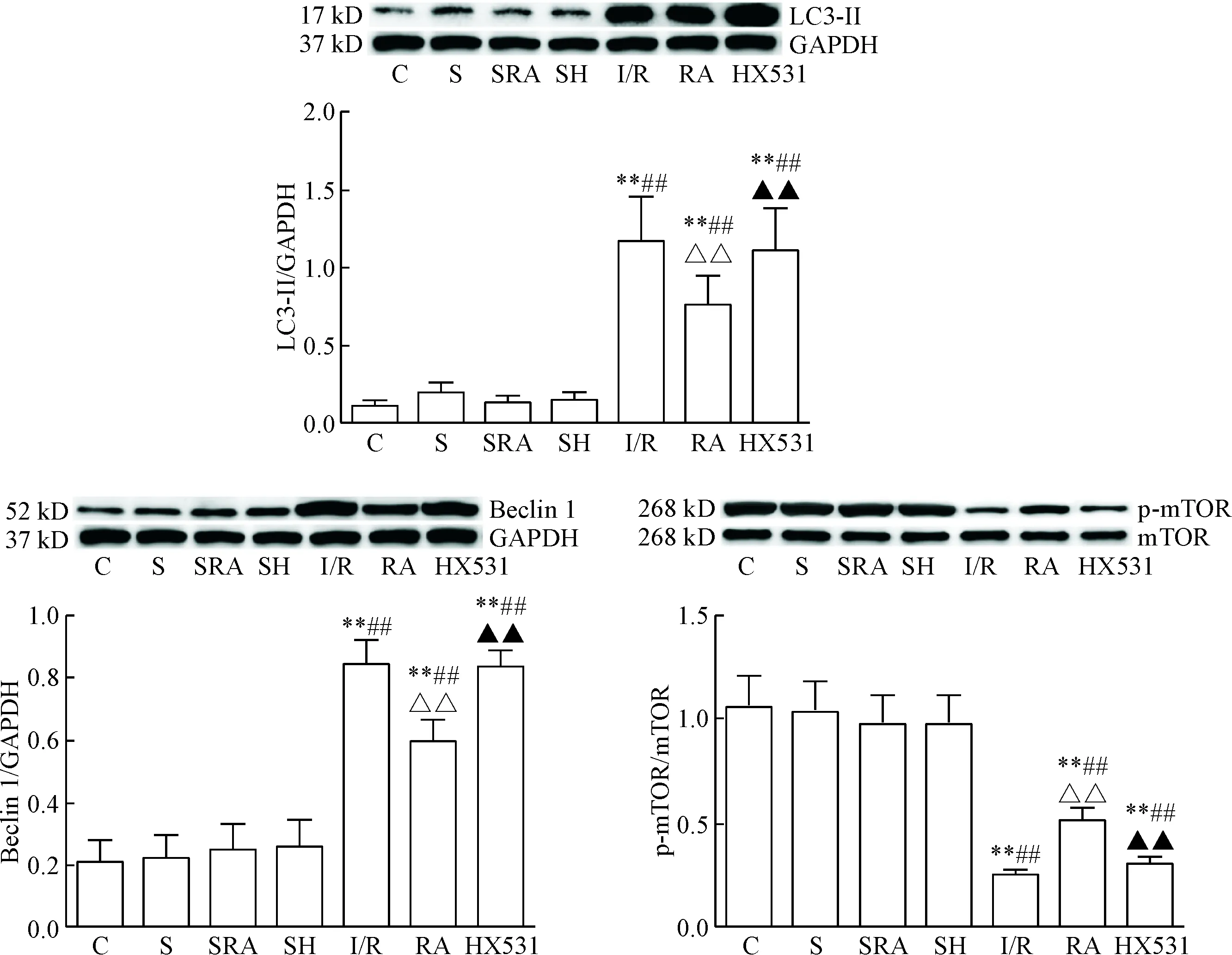
Figure 4.The protein levels of LC3-II, beclin 1 and p-mTOR in each group. Mean±SD. n=10. ** P<0.01 vs C group; ##P<0.01 vs S group; △△P<0.01 vs I/R group; ▲▲P<0.01 vs RA group.
讨 论
维甲酸X受体是细胞核内重要的受体之一,在人体内分布范围较广泛,其通过与不同的配体,在炎症、肿瘤、胚胎发育、物质代谢及造血异常等多类疾病中起着重要的作用。RXR在细胞内通常以异源二聚体的形式存在,异源二聚体本身不具有任何的生物学性能,真正能够发挥生物学效应的是异源二聚体与配体结合形成的复合体[13-15]。当异源二聚体被成功激活后转变成转录调节因子,随后与目标基因进行结合,通过调节目标基因的转录与表达水平发挥生物学效应。研究表明,RXRα在正常细胞的增殖与分化中起着重要的作用,其功能及表达的异常与人类中多种恶性肿瘤的发生发展密切相关。因此,RXRα被认为是肿瘤治疗及预防的重要靶点之一。除了肿瘤,RXRα还广泛参与各类物质的代谢调节,如胆固醇、脂肪、胆汁酸和维生素D等代谢以及葡萄糖的内稳态[13-17]。
PIRI的发生是机体多通路、多途径共同调控的结果,目前研究认为细胞自噬信号转导通路在脏器I/R中起重要作用。自噬是指细胞内变性、衰老和受损的细胞器和蛋白质被运输到溶酶体,溶酶体对其进行消化降解,以细胞质内出现双层膜结构包裹部分胞质和细胞器的自噬小体为判断指标的细胞自我消化过程。以往的研究发现,在生理状态下,细胞自噬维持在较低的基线水平。在机体遭受某些刺激时,如缺血/再灌注和内质网应激等,体内自噬水平会出现适度的增高,以减轻这些病变所引起的损伤。但随着自噬水平过度的增高,机体会伴随自噬性细胞死亡和细胞丢失等变化,说明自噬既是细胞内的一种防御和应激调控机制,也是细胞损伤的重要机制之一[18-19]。
作为细胞内重要的物质代谢方式之一,自噬的发生和发展均受到机体严格的控制和调节。自噬由自噬相关基因(autophagy-associated gene,ATG)进行严密调控,主要包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、自噬相关基因3和自噬相关基因6(beclin 1)等。目前已知的自噬调节相关通路有多条,其中磷脂酰肌醇3激酶-蛋白激酶B(protein kinase B)- 雷帕霉素靶蛋白信号转导通路(PI3K-Akt-mTOR信号转导通路)是调控自噬的唯一抑制性通路;自噬激活经典转导通路包括腺苷酸激活的蛋白激酶(AMP-activated protein kinase,AMPK)通路和beclin 1-PI3K III通路[20-22]。在哺乳动物中,微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)通过2条泛素样蛋白加工修饰过程参与自噬泡的形成,LC3最开始以前LC3的形式存在,随后立刻被Atg4B切割,形成胞浆可溶性形式LC3-I。在自噬发生过程中,LC3-I在Atg5-Atg12-Atg16复合物的协助下经过多次修饰后形成具有膜结合能力的LC3-II。LC3-II定位于前自噬体与自噬体,与自噬体膜稳定结合,表达量与自噬泡数量成正比,在某种程度反映了自噬小体的数量,通常被当作哺乳动物中自噬体膜的标记蛋白,通过检测LC3蛋白的含量,可以粗略判断机体自噬的表达情况[23-26]。mTOR为保守进化的丝-苏氨酸蛋白激酶,是磷脂酰肌醇激酶相关蛋白激酶(phosphatidylinositol-kinase-related protein kinase,PIKK)的家族成员之一,参与机体细胞一系列的活动,如细胞的生长、能量代谢、细胞增殖、凋亡与存活等。研究表明,mTOR至少存在着mTORC1和mTORC2两种复合物,其中mTORC1由多种蛋白质组成,参与了体内细胞转录、翻译和自噬等过程,并且对自噬激动剂雷帕霉素高度敏感。mTORC1通路是机体内多条信号通路的交汇点,通过对其上游信号,如AMPK-mTORC1及Class I PI3K-AKT-mTORC1信号通路,或其下游信号,如ULK1分子等的转导来调控细胞自噬水平。细胞若处于正常生长状态时,mTORC1会下调自噬信号转导通路,使机体维持一个较低的基础自噬水平;若细胞处于应激,比如在饥饿状态下,mTORC1功能会被抑制,导致自噬被PI3K-AMPK/mTOR信号通路轴所激活[27-30]。肿瘤抑制蛋白beclin 1是自噬调控程序中重要的调控蛋白,它能与抗凋亡蛋白Bcl-2直接发生相互作用,当beclin 1与Bcl-2结合时,beclin 1的功能被抑制,不能激活自噬。当促凋亡蛋白BH3催化beclin 1从Bcl-2解离后,beclin 1即能诱导启动自噬程序;相反的,若Bcl-2或者其它Bcl-xL家族成员发生过表达时,beclin 1与其结合从而导致自噬被抑制[31]。
本研究结果显示,C组、S组、SRA组和SH组检测指标变化的差异无统计学显著性,肺组织形态学变化也相差不大,表明肺组织无缺血/再灌注时,单纯的手术操作和药物对大鼠肺影响不大;与C组相比,I/R组、RA组和HX531组的肺IQA、自噬促进蛋白LC3-II和beclin 1的水平升高,自噬抑制蛋白p-mTOR水平则降低,提示缺血/再灌注时,肺组织诱发自噬水平的上调,造成肺组织的损伤;将RA组和HX531组与I/R组相互比较,我们发现使用9-顺式维甲酸激活RXR后,RXRα表达量、p-mTOR的蛋白水平升高;肺IQA、LC3-II和beclin 1的水平则降低;而使用HX531抑制RXR后则出现了相反的变化,这种实验结果反差表明激活RXR可以降低细胞自噬水平,减少肺毛细血管的损伤和肺泡渗出液,改善肺换气功能,减轻缺血/再灌注肺损伤;而抑制RXR则会上调细胞自噬水平,加重肺组织损伤。在单培仁等[32]的研究中,他们证实缺氧/复氧能够诱导mTOR的失活,RXR激动剂却能抑制mTOR失活,对细胞起到保护作用,并且这种保护作用可被RXR拮抗剂所阻断,说明激动RXR可通过作用mTOR通路抑制心肌细胞的过度自噬,减轻细胞缺氧/复氧损伤。以上研究结果与本实验结果相一致,进一步支持了本实验得出的结论,即肺缺血/再灌注可上调细胞自噬的水平,而通过激动RXR可以抑制细胞自噬通路,从而减轻肺损伤,保护肺组织。
综上所述,大鼠肺缺血/再灌注可诱发过度的细胞自噬,损伤肺组织;激活RXR可以抑制细胞自噬通路,进而保护肺组织。本研究为临床上肺缺血/再灌注损伤的防治机制提供了科学理论依据,同时也为临床药物的研究与开发提供新的作用靶点。
