绵羊ADPN基因和PTGS2基因多态性与产羔数相关性研究
2018-11-24李婷婷邢亚楠董焕声潘庆杰
李婷婷,李 桢,杜 淼,邢亚楠,董焕声,潘庆杰
(青岛农业大学动物科技学院,山东青岛 2661091)
绵羊是第1个被驯化的放牧动物,可以给人们提供肉、皮、奶、毛等主要生产和生活材料,发展绵羊产业能够有效提高畜牧业经济效益[1]。除少部分绵羊品种常年发情外,大多数品种为季节性发情,不能全年进行配种,这在一定程度上影响了羊的繁殖效率,因此提升绵羊单产能力对生产效率有至关重要的影响[2]。由于绵羊高繁殖力的遗传力较低,致使其育种进程非常缓慢[3-4]。湖羊是我国选育出的高繁殖力绵羊品种之一。湖羊源于北方的蒙古羊[5-6],具有性成熟早、繁殖率高、繁殖周期短、早期生长快等优点,母羊的平均产羔率可达到256%,有的甚至可达300%以上,是世界上较稀少的具有高繁殖力的绵羊品种之一。相比湖羊而言,杜泊羊的繁殖力比较低,但杜泊羊胴体肉质好,生长发育速度较快,体重在100日龄时可以达到30~35 kg。在繁殖力方面,初产的杜泊母羊和经产的杜泊母羊繁殖率分别为135.13%和144.44%[7]。研究表明,ADPN(脂联素)基因及PTGS2(前列腺内过氧化物合酶2)基因是影响繁殖性状的2个主要候选基因[8-9]。本实验以湖羊和杜泊羊为研究对象,采用直接测序法对ADPN基因和PTGS2基因进行多态性检测,深入分析基因突变与繁殖力的关系,为进一步完善基因选育在绵羊生产中的应用、提高羊繁殖能力提供理论基础和实践依据。
1 材料与方法
1.1 实验动物及采样方法 实验选择有1~3胎的产羔记录、身体健康的65只湖羊和60只杜泊羊,在山东省朝阳畜牧有限公司同一饲喂条件下自由采食和饮水。在每只羊的耳缘部用75%酒精棉球消毒后,用耳标钳取耳组织1~2 cm,置于盛有无水乙醇的1.5 mL的离心管中,并在每个离心管上标上耳号,放入液氮中带回实验室,-80 保存。
1.2 主要耗材、试剂 细胞/血液/组织基因组DNA提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒由天根生化科技(北京)有限公司提供;DNA Marker、6×Loading Buffer、Premix Taq均购自 TaKaRa公司;核酸染料购自上海生工生物工程公司;无水乙醇,50×TAE缓冲液,琼脂糖。
1.3 基因组DNA的提取 采用细胞/血液/组织基因组DNA提取试剂盒进行湖羊和杜泊羊的耳组织基因组DNA的提取。
1.4 基因组DNA的琼脂糖凝胶电泳 利用1.5%琼脂糖凝胶电泳检测基因组DNA的纯度,核酸分析仪测定DNA浓度,DNA OD260/OD280均在1.7~1.9。
1.5 引物设计及PCR扩增与检测 以牛ADPN基因序列为参照[10],使用Primmer5.0设计ADPN基因引物,扩增ADPN基因第3外显子部分序列;根据Gladney等[11]提供的牛第3外显子到第5外显子的引物作为羊的PTGS2基因引物。引物均由上海生工生物工程公司合成,引物序列见表1。
1.6 PCR扩增体系的建立 PCR扩增体系25 µL:上、下游引物各 1 µL;DNA 模板 1 µL;Premix Taq酶 12.5 µL;超纯水 9.5 µL。ADPN基因引物的最佳PCR反应程序:95 预变性3 min,95 变性30 s,55 退火30 s,72 延伸1 min,35个循环,72 延伸10 min,4 保存。PTGS2基因引物的最佳PCR反应程序:95 预变性3 min,95 变性30 s,53 退火30 s,72 延伸1 min,35个循环,72 延伸10 min,4保存。产物用1.5%琼脂糖凝胶电泳检测。
1.7 PCR产物的切胶回收 使用普通琼脂糖凝胶DNA回收试剂盒进行PCR扩增产物切胶回收纯化,DNA溶液直接送去测序。
对ADPN、PTGS2基因进行PCR扩增切胶直接测序,对测得的序列用Megalign软件进行序列比对,并用Blast软件与NCBⅠ上的原始序列进行比对。
1.8 统计分析 运用Excel 2010 软件统计各绵羊ADPN、PTGS2基因位点的突变数、基因型及产羔数,数据以平均值±标准误表示。用SPSS 22.0 软件中一般线性模型完成湖羊、杜泊羊基因型与产羔表型数据关联分析。
2 结果与分析
2.1 基因组DNA提取结果 从图1中可以看到,条带清晰,亮度较高,无拖尾现象,说明基因组DNA纯度比较好,提取过程没有蛋白质污染,没有DNA降解,所提取的DNA符合后续的PCR扩增要求。
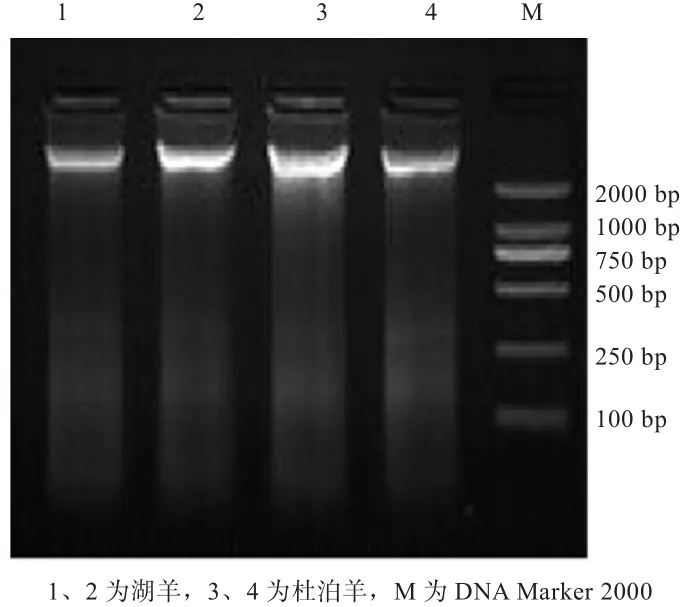
图1 湖羊和杜泊羊DNA检测结果
2.2 PCR扩增产物的检测 如图2显示,湖羊和杜泊羊ADPN基因引物和PTGS2基因引物PCR产物的目的条带明亮并且整齐一致,扩增片段的大小正确,特异性较好,可以用来进行后续实验。ADPN、PTGS2基因的目的片段分别是659、1 600 bp。
2.3 基因纯化 除去PCR产物中的蛋白质及其他有机化合物、无机盐离子、寡核苷酸引物等杂质,提纯后的PCR产物经1.5%的琼脂糖凝胶电泳检测,可以用来直接测序(图3)。
2.4 突变位点的检测
2.4.1ADPN基因碱基突变的检测 如图4~7所示(为保证突变清洗,截取部分序列长度),ADPN基因在133 bp处发生G→A的突变,该位点的密码子由GAT转变成AAT,并使编码的氨基酸由D(天冬氨酸)转变成N(天冬酰胺);在594 bp处也发生G→A的突变,该位点的密码子由AGA转变为AAA,编码的氨基酸由R(精氨酸)转变为K(赖氨酸)。
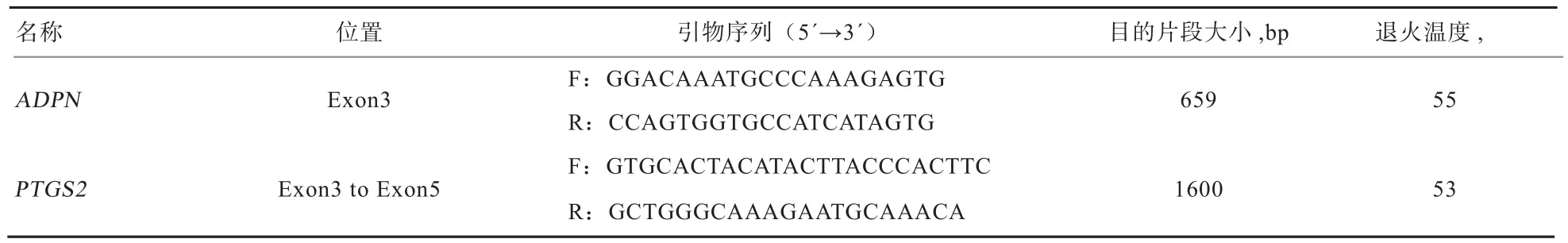
表1 引物序列
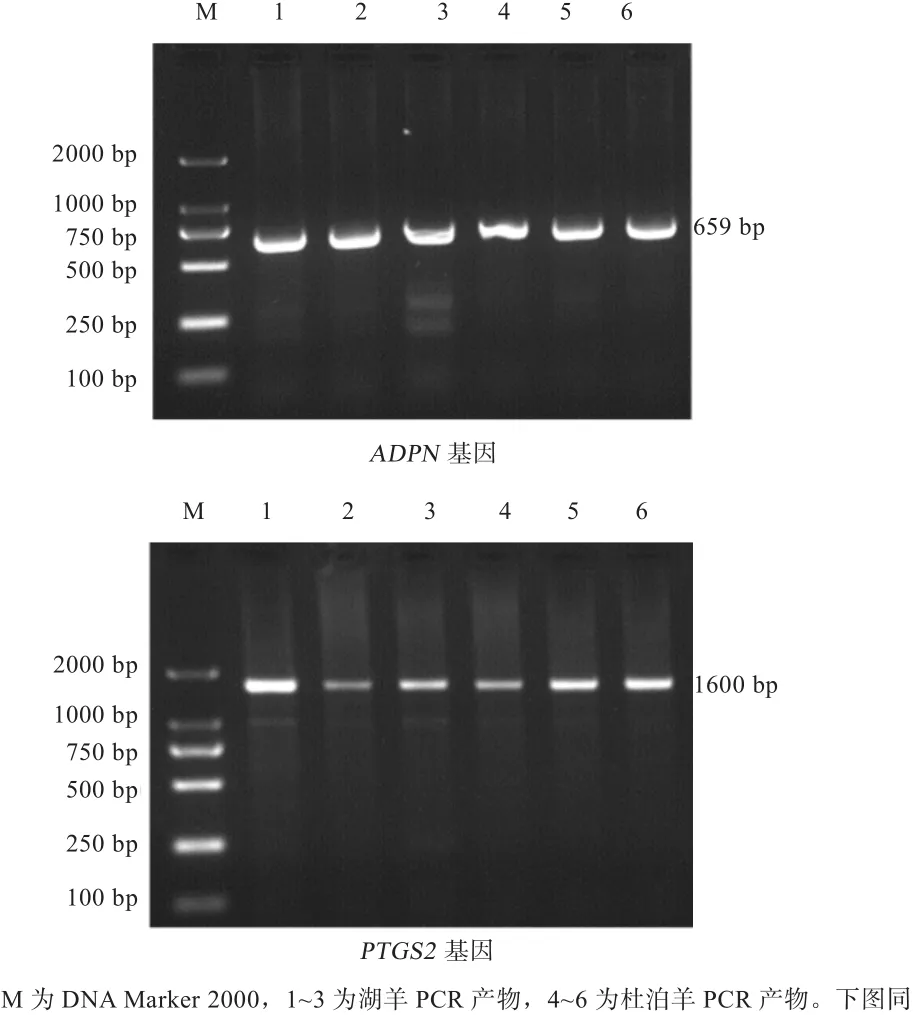
图2 ADPN、PTGS2基因PCR检测结果
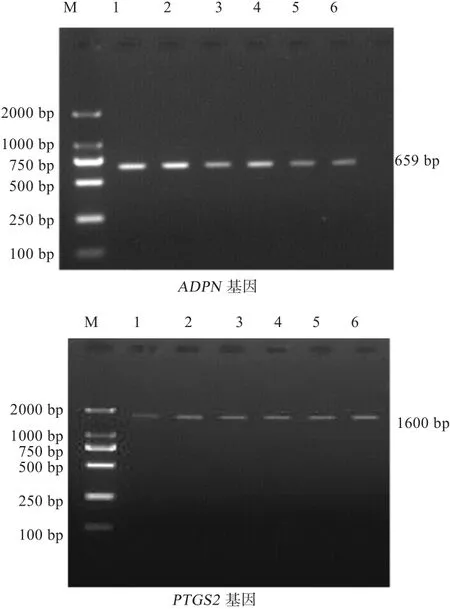
图3 ADPN 、PTGS2基因纯化结果
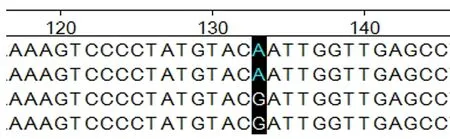
图4 ADPN基因在133 bp处的碱基突变
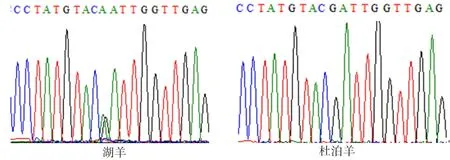
图5 ADPN基因133bp处的峰图
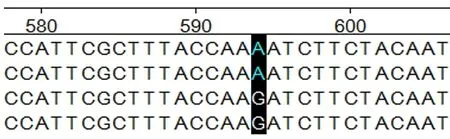
图6 ADPN基因在594 bp处的碱基突变
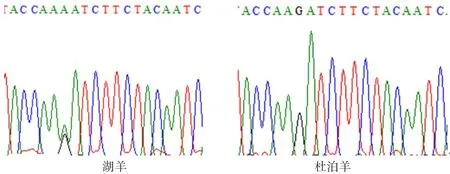
图7 ADPN基因594 bp处的峰图
2.4.2PTGS2基因碱基突变的检测 如图8、9所示,PTGS2基因在77 bp处发生遗传变异,该位点的密码子由AAA转变为CAA,并使编码的氨基酸由K(赖氨酸)转变为Q(谷氨酰胺)。

图8 PTGS2基因在77 bp的碱基突变
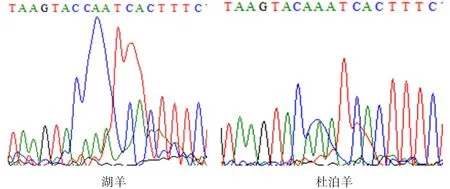
图9 PTGS2基因77 bp处的峰图
2.5 基因突变对产羔数的影响 湖羊1年产羔羊2次或者2年产羔羊3次,母羊平均的产羔率可达256%;与湖羊相比,杜泊羊的平均产羔率为140%。如表2显示,湖羊ADPN、PTGS2基因突变数均极显著高于杜泊羊(P<0.01);湖羊平均产羔数极显著高于杜泊羊(P<0.01)。
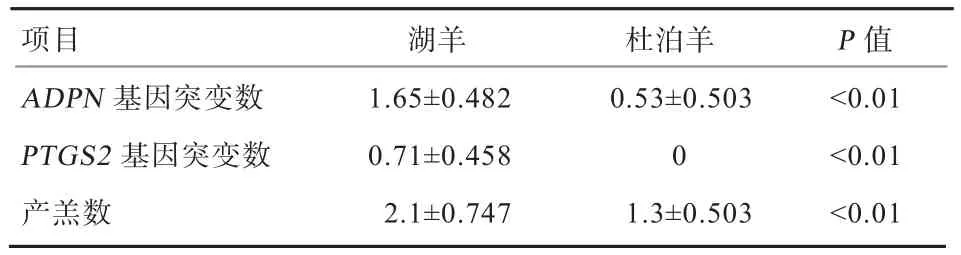
表2 基因突变对产羔数的影响
2.6 相关性分析 由表3可以看出,ADPN基因和PTGS2基因的突变与产羔数呈现极显著相关(P<0.01),说明相关系数的值不是偶然因素造成的;而ADPN基因和PTGS2基因Pearson相关系数值都大于0,说明这2个基因的突变与产羔数之间存在高度的线性正相关。
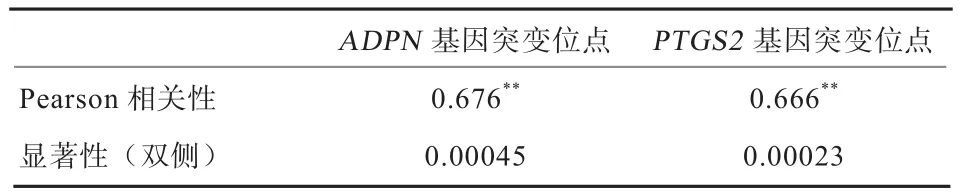
表3 ADPN、PTGS2基因与产羔数的相关性(n=125)
3 讨 论
ADPN基因在生殖过程中通过不同水平表达来调控下丘脑和垂体、卵巢或者直接作用卵母细胞和胚胎以及雄性睾丸等。刘重旭等[12]在研究中国西南9个山羊品种发现,3´UTR区发生G→A突变,在不同的山羊品种中等位基因的频率不相同。本研究在ADPN基因外显子3共检测到2个突变。杨彦杰等[13]对于牛的研究显示,ADPN基因外显子上检测到1个突变位点,由于牛、羊在生物分类学上归入偶蹄目牛科,均为反刍类食草动物,由此说明牛和羊在进化进程中虽然共祖,但又产生了基因遗传的差异性。本研究在内含子上没有发现碱基突变,这与曹海洋[10]在小尾寒羊上检测到内含子中4个突变不相符,可能是绵羊品种间存在个体差异性。
Liu等[14]和Sirois[15]研究发现,PTGS2的表达调控决定着反刍类食草动物排卵进程的长短。研究发现,PTGS2基因缺陷型的小鼠卵泡正常发育,但因黄体缺乏而导致不能正常排卵[16]。Linville等[17]发现,将野生型胚泡植入到PTGS2缺陷型小鼠子宫内,往往不能发育,进一步证实了PTGS2基因对蜕膜的重要性。本实验在湖羊的碱基序列上检测到1处突变位点,这与梁瑞圆等[18]发现小尾寒羊上PTGS2基因扩增片段中均存在碱基突变的结果一致。
与杜泊羊相比,湖羊高繁殖力的特征较为显著。在本研究中,高繁殖力的湖羊群体在ADPN基因和PTGS2基因都有突变位点,而在杜泊羊群体中没有发现突变位点。湖羊在ADPN基因133 bp处发生G→A突变,并使编码的氨基酸由D(天冬氨酸)转变成N(天冬酰胺);在594 bp处也发生了G→A突变,编码的氨基酸由R(精氨酸)转变为K(赖氨酸)。在PTGS2基因77 bp处发生了A→C突变,并使编码的氨基酸由K(赖氨酸)转变为Q(谷氨酰胺)。同时,通过相关性分析发现,基因的突变率与产羔数呈显著相关,研究结果证明ADPN基因与PTGS2基因参与调控绵羊的繁殖效率。
4 结 论
本研究发现,ADPN基因与PTGS2基因突变与产羔数呈显著相关,进一步分析发现2个基因是影响湖羊高繁殖力的基因,可以作为高繁多胎性状的候选基因。
