miRNAs 对睾丸内细胞功能调控的研究进展
2018-11-24高月锋杨宇泽简路洋曲扬华罗海玲
高月锋,杨宇泽,简路洋,芦 伟,曲扬华,罗海玲*
(1.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京100193;2.北京市畜牧总站,北京 100101)
睾丸内细胞类型众多,可以分为生殖细胞和体细胞两大类。生殖细胞依照动物的发育阶段分为精原干细胞、初级精母细胞、次级精母细胞、圆形精子细胞和成熟精子。体细胞分为间质细胞、支持细胞、管周肌样细胞、淋巴内皮细胞、血管内皮细胞、巨噬细胞以及神经细胞[1]。近几年,雄性繁殖相关的研究从针对睾丸质量以及组织形态学的研究转移到细胞水平。
miRNAs是一类约为22 nt的短链非编码RNA[2]。编码miRNAs的基因通常位于基因间、外显子或内含子区域[3],miRNAs可与Argonaute(AGO)蛋白结合,形成RNA诱导沉默复合物(RⅠSC),RNA诱导沉默复合物中的miRNA的种子序列(大约2~7 nt)可与靶基因mRNA 3' UTR区域不完全互补配对,或通过降低靶基因mRNA,抑制其翻译。部分研究表明,miRNAs可直接作用于靶基因序列,影响基因表达。同一个miRNA可以调控不同的靶基因,多个miRNAs也可以同时调控同一个靶基因[4]。miRNAs对睾丸的精子发生[5]及间质细胞[6]、支持细胞[7]和生殖细胞[8]的功能都起到重要的调控作用。本文综述了近年来miRNAs对睾丸内间质细胞、支持细胞以及生殖细胞功能调控的研究进展,以期为本领域的研究者提供参考。
1 间质细胞
间质细胞位于睾丸的间质空间,主要作用是分泌类固醇激素睾酮。睾酮分泌主要受促黄体素(LH)调控。睾酮作用于支持细胞的雄激素受体[9],从而影响支持细胞的功能。当睾酮分泌终止,会造成生殖细胞从支持细胞分离,最终导致生殖细胞死亡[10]。部分研究表明,miRNAs与间质细胞有直接或者间接的联系。miRNA-125a和miRNA-455可以靶向受体SRBⅠ,降低类固醇激素的生成[11]。成纤维细胞生长因子(bFGF)可以显著下调和上调早期间质细胞内miR-142-3p和miR-335的表达[12]。敲除miRNAs-140-5p/3p的胚胎,间质细胞数量明显增加[6]。以上研究表明,miRNAs可能间接影响间质细胞的功能。
但miRNAs与间质细胞功能的直接研究却少有报道。类固醇急性调节蛋白(STAR)可将类固醇由线粒体外膜转移至内膜,此过程是类固醇激素合成的限速步骤。miRNA-150通过抑制STAR在mRNA及蛋白水平的表达,降低睾酮及其前体物的合成,最终影响精子的发生[13]。综合以上研究结果,miRNAs也许可以调控间质细胞的数量以及能够调控睾酮的分泌。miRNAs对间质细胞更多的调控作用还有待进一步挖掘。
2 支持细胞
2.1 支持细胞Dicer特异性敲除 支持细胞为精子的成熟提供支持、营养和保护作用。众多研究结果表明,特异性敲除支持细胞内miRNAs合成关键酶Dicer,发现miRNAs与支持细胞的功能及精子发生有密切关系。Papaioannou 等[14]发现,小鼠支持细胞Dicer缺失造成睾丸退化和精子缺失,最终造成不育。Kim等[15]通过杂交获得了支持细胞Dicer特异性缺失的小鼠,胚胎期胚胎发育正常;在产后第0天,曲细精管的数量和形态并未表现出异常,但与睾丸发育、精子发生及结构完整性相关的基因表达皆下调;在产后第3天表现出大量的凋亡,造成生殖细胞和支持细胞缺失,以及睾丸尺寸降低;在产后第6天,表现出曲细精管数量降低及不育的症状[15]。Papaioannou等[16]研究结果表明,支持细胞Dicer缺失会使得睾丸内蛋白表达谱发生变化,Cu/Zn -SOD-1上调,因细胞凋亡而发生的细胞死亡增多。虽然以上试验并未对miRNAs与支持细胞的直接功能进行研究,但Dicer是细胞合成miRNAs的关键酶之一,Dicer特异性缺失,睾丸发育以及精子发生相继受到不同程度的影响,可以间接说明miRNAs或许对支持细胞功能行使和精子发生具有重要的调控作用。
2.2 支持细胞增殖和凋亡 生殖细胞增殖和分化期间需依托于支持细胞。支持细胞的数量可在一定程度上决定生殖细胞的数量。多数物种的支持细胞的增殖发生在青春期前[17-19],但鱼类和两栖类在性成熟后也会发生增殖[20]。支持细胞的增殖受多种因素调控,包括FSH、类固醇激素、雄激素和甲状腺激素和生长因子(如胰岛素样生长因子)[19,21-22]。
支持细胞的增殖同样也受到多种miRNAs的调控。Zhang等[23]研究表明,17β-雌二醇通过抑制miR-1285表达,从而激活AMPK来降低支持细胞的增殖。磷酸化的AMPK可通过增加p53和p27表达以及抑制mTOR和Skp2表达参与调节17β-雌二醇介导的支持细胞活力的抑制。此外,miR-133b可以靶向GLⅠ3,下调其表达,并促进支持细胞的增殖[7]。miR-762可促进猪未成熟支持细胞的增殖并抑制细胞凋亡,主要通过靶向结合RNF4的3'UTR区域,下调该基因的表达。RNF4是一种核转录因子,可作为雄激素受体依赖性转录中的共激活因子,降低的RNF4表达削弱了雄激素受体的转录调节活性[24]。以上研究结果说明,miRNAs可对支持细胞的活力、增殖和凋亡起到调控作用。
3 生殖细胞
3.1 生殖细胞Dicer特异性敲除 生殖细胞是繁殖功能的直接执行者,生殖细胞与miRNAs间的研究日益增多。当特异性敲除小鼠原始生殖细胞和精原细胞内的Dicer,原始生殖细胞和精原细胞表现出增殖能力下降[8]。此外,生殖细胞Dicer1的特异性敲除造成曲细精管内很少出现成熟精子,分化的成熟精子也表现出形态异常和活力低下,仅少数缺乏Dicer1的精子能够和野生型小鼠的卵子结合,生成后代[25]。
敲除Dicer也会造成睾丸尺寸的降低和精子发生过程的紊乱,造成附睾内成熟精子数量降低,精子形态异常,但精原细胞分化似乎未被影响,敲除后的睾丸中单倍体细胞的数量减少,凋亡的精母细胞数量增加。在晚期单倍体分化中发现明显的缺陷[26]。在雄性生殖细胞发育的开端选择性敲除Dicer1,由于减数分裂和减数分裂后期的多重累积性缺陷,导致功能性精子缺乏,表现出不育的症状。同时,精母细胞到前期Ⅰ过程发生推迟,凋亡率增加,圆形精子细胞数量降低。从圆形到成熟精子的过渡过程也受到严重影响,在突变体中形成的少数精子不动且畸形,表现出精子头部和鞭毛的形态缺陷,并且 Sine家族转座因子的表达在Dicer1缺失的精母细胞中上调[27]。综上所述,生殖细胞Dicer的特异性敲除可造成睾丸尺寸降低以及生殖细胞的数量、形态和功能的异常,间接说明了miRNAs或许对生殖细胞功能具有重要的调控作用。
3.2 生殖细胞更新及分化 精原干细胞的自我更新能力是生殖细胞行使生殖功能的基础。通过自我更新,精原干细胞能够保持数量的稳定。精原干细胞的更新受到间质细胞以及支持细胞分泌的信号分子的调控,同时也受到其自身miRNAs的调控。研究表明,miR-21、miR-34c、miR-182、miR-183和miR-146a主要在精原干细胞内表达[28]。在研究中通过抑制miR-21的表达,发现凋亡的生殖细胞数量增多,将供体来源的细胞移植到受体后,供体来源的细胞集落数量显著降低,并发现控制生殖干细胞自我更新的转录因子ETV5可调控miR-21的表达,说明miR-21在精原干细胞更新及精子发生过程中的重要作用[28]。He等[29]研究表明,miR-20和miR-106a主要在精原干细胞内表达,并可通过作用于STAT3和Ccnd1基因调控精原干细胞的自我更新。miR-184的表达限于从精原细胞到圆形的生殖细胞精子细胞。miR-184的过表达促进生殖细胞系GC-1spg的增殖,它可通过作用于NCOR2的 3' UTR,抑制NCOR2蛋白的表达。因此,miR-184对精子发生的调控或许通过NCOR2基因[30]。Liang等[31]研究表明,miR-34c可以在转录后水平,抑制ATF1在蛋白水平的表达,促进GC-2生殖细胞凋亡过程。以上研究结果进一步说明,miRNAs作为重要的调控因子对生殖细胞的更新起到调控作用。
精子发生需经历由精原细胞向精母细胞的过渡阶段,此阶段同样受到许多miRNAs的调控作用。McⅠver等[32]研 究 表 明,miR-293、miR-291a-5p、miR-290-5p、miR-294、miR-136、miR-743a 和 miR-463 在精原细胞分化成精母细胞的过程中起到至关重要的作用,这些miRNAs主要参与PTEN和Wnt信号通路,并发现关键的细胞周期调控因子Cyclin D1也是重要的靶基因之一。Luo等[33]利用高通量测序技术研究了B型精原细胞和精母细胞中miRNAs的表达谱,结果表明2种类型的细胞中Let-7家族miRNA的表达水平都非常高。在从精原细胞向精母细胞分化期间,miR-21、miR-140-3p、miR-103、miR-30a、miR-101和 miR-99b的表达水平降低,这些miRNAs靶向参与细胞凋亡、细胞增殖和分化、细胞连接形成和细胞周期调控的重要基因[33]。
3.3 染色质重塑 精子发生过程中会发生染色质重塑,染色质中的组蛋白会演变成过渡蛋白,最终演变成鱼精蛋白。最近研究表明,miR-122a可以通过降解miRNA的转录本,抑制蛋白Tnp2的表达,Tnp2作为一种过渡蛋白,主要参与精子染色质重塑过程,对精子由精原细胞向成熟精子分化起到重要作用[34]。以上研究说明,miRNAs或许可以调控精子染色质重塑过程。
4 miRNAs对睾丸内细胞功能调控
睾丸内间质细胞、支持细胞和生殖细胞作为睾丸内行使繁殖功能的主要细胞类群,完成各自功能的同时受到自身多种miRNAs的调控。睾丸各细胞内表达的miRNA、下游靶基因及行使的功能总结见表1。
5 结 论
miRNAs可以影响间质细胞的数量及睾酮合成、调控支持细胞的增殖和凋亡以及生殖细胞的细胞周期、凋亡和染色质重塑,最终影响精子的发生过程。但有关miRNAs作用于睾丸细胞内的许多研究结果都局限于候选miRNAs及下游靶基因的识别,后续需要研究miRNAs在各细胞信号通路中起到的作用,更详尽地揭示miRNAs对睾丸细胞的作用机制。
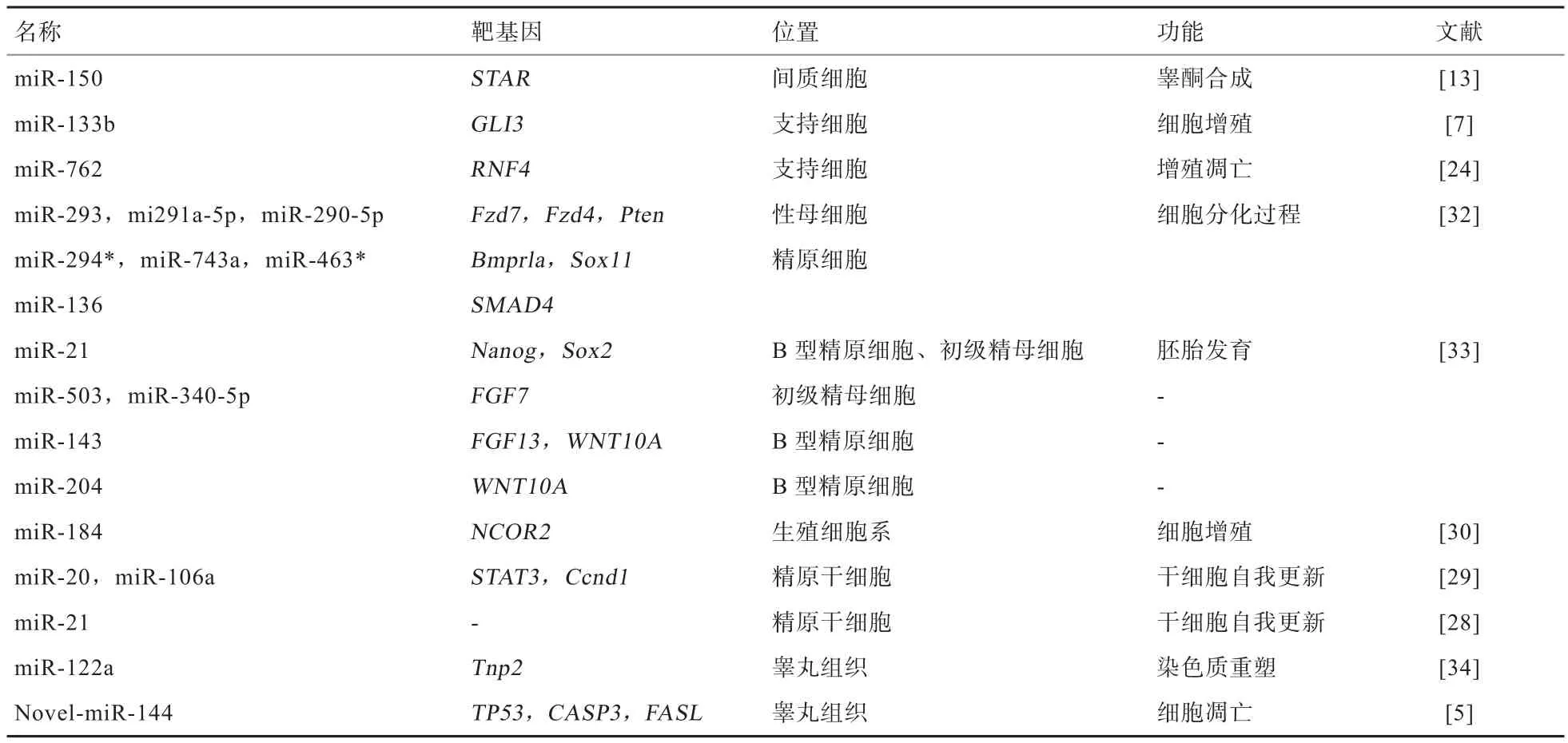
表1 睾丸各细胞内miRNAs的表达及功能
