超声处理改善不同比例大豆-乳清混合蛋白理化性质
2018-11-23王喜波张安琪王玉莹孙洪蕊朱丹丹刘越峰
王喜波,崔 强,张安琪,王玉莹,孙洪蕊,朱丹丹,刘越峰
超声处理改善不同比例大豆-乳清混合蛋白理化性质
王喜波1,崔强1,张安琪1,王玉莹1,孙洪蕊2,朱丹丹3,刘越峰3
(1.东北农业大学食品学院,哈尔滨 150030; 2. 吉林省农业科学院,长春 130000; 3. 黑龙江省公安消防总队,哈尔滨 150090)
为了探究超声作用对不同比例大豆-乳清混合蛋白功能性质的影响。该试验以大豆蛋白与乳清蛋白为原料,对粒径、-电位、内源性荧光光谱、扫描电子显微镜等结构性质,以及乳化活性、乳化稳定性、质构、持水性等理化特性和功能特性进行研究。结果表明:当SPI-WPI(soy protein isolate- whey protein isolate)质量比为5:5时,乳化活性与乳化稳定性最大(65.5 m2/g,16.3 min),同时粒径分布由双峰转为单峰,体积平均粒径[4,3]达到最小值(205.6 nm)、-电位绝对值达到最大(21.4 mV),此时混合体系稳定性最好。内源性荧光光谱显示有荧光物质释放,荧光强度持续增强,说明超声处理改变了混合体系蛋白结构。超声处理后混合蛋白比例在5:5时,具有最佳的凝胶性质,硬度达到最高(475.61 N),持水性达到最大(85.32%),与扫描电子显微镜的结果一致,显示此时混合蛋白体系形成致密、均一、有规则凝胶网络结构。该研究可为大豆-乳清混合蛋白的应用提供技术支撑。
超声波;乳化性;凝胶化;大豆分离蛋白;乳清分离蛋白
0 引 言
蛋白质因具有较高的营养价值和优越的功能特性[1]一直是国内外研究的热点。近年来,通过混合蛋白得到全新质感和更有利于人体健康的食品特别是植物蛋白与动物蛋白的混合体系食品越来越得到重视[1-2]。乳清分离蛋白(WPI,whey protein isolate)与大豆分离蛋白(SPI,soy protein isolate)广泛应用在食品工业中[3],然而膨化蛋白质在食品和非食品领域的应用一直受到WPI胶凝性差以及SPI乳化性差的限制[4]。严重制约了混合蛋白在食品中的应用。
国内外学者对混合蛋白体系研究重点主要集中在提高混合蛋白的理化特性与探究不同处理对混合蛋白之间相互作用的影响。Cosmin等[1]研究发现热处理大豆蛋白与酪蛋白混合体系有利于2种蛋白相互作用促使凝胶性能得到提升。Jissy等[2]研究不同离子浓度下大豆蛋白与乳清蛋白混合体系之间的相互作用,解析了不同离子浓度下球蛋白之间的相互作用。Qin等[5]研究表明微波处理可提高大豆与小麦混合蛋白的凝胶强度改变混合蛋白的内部结构。近年来,超声技术已广泛应用在食品体系,在液体中能够产生空化、剪切压力以及湍流作用[6-7]。超声波在处理液体食品时,对食品组分的结构和功能产生影响。然而,目前关于超声处理对SPI-WPI混合蛋白体系功能性质的研究还未见报道。本试验主要探究不同比例SPI-WPI混合蛋白超声处理后对体系乳化性与凝胶性的影响,以及超声处理对混合蛋白功能性质改变的机理,以不同比例SPI-WPI混合蛋白未超声处理作对照。
优质的混合蛋白健康食品(优质植物蛋白和优质动物蛋白)备受关注[8],混合蛋白的互补作用主要体现在,大豆分离蛋白与牛乳中酪蛋白或乳清蛋白间相互作用形成“关键簇”促进氨基酸的高效利用[9]。本文旨在制备一种高乳化性与凝胶性的混合蛋白食品,为开发新型双蛋白食品提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(实验室自制);乳清分离蛋白(Sigma 公司);谷氨酰胺转氨酶(一鸣生物制品有限公司);其他试剂均为分析纯。
1.2 仪器与设备
ULTRA-TURRAX T18 Basic型高速分散机/匀浆机(德国 IKA公司);TU-1800 型紫外可见分光光度计(北京普析通用仪器有限责任公司);ALPHA 1-4 LSC型冷冻干燥机(德国 Christ 公司);超声波细胞破碎仪(宁波新芝生物科技股份有限公司);F-4500荧光分光光度计(日本HITACHI 公司);扫描电子显微镜(日立高新技术公司);粒度分布仪(美国布鲁克海文仪器公司);
1.3 方 法
1.3.1 超声处理SPI-WPI混合物试验设计
制备方法参照Qin等[4]的方法,试验组:将SPI、WPI粉末分别溶于去离子水中使蛋白质量浓度达到100 mg/mL。25 ℃下磁力搅拌1 h,后将2种蛋白(SPI:WPI)分别按照9:1、7:3、5:5、3:7、1:9比例(质量比)混合(总质量30 g)于50 mL锥形瓶中,用分散器(10 000 r/min)搅拌5 min,继续在磁力搅拌1 h,使其充分溶解。对照组:分别将单SPI、单WPI粉末溶于去离子水中使蛋白质量浓度达到100 mg/mL。同理在25 ℃下磁力搅拌1 h后用分散器(10 000 r/min)搅拌5 min,继续磁力搅拌1 h,使其充分溶解。4 ℃静置过夜。超声处理参考Hu等[10]的方法,设置温度不得超过50 ℃,将超声波处理器的钛探头(直径0.636 cm)插入液面下,距离锥形瓶底部1 cm处,输出功率为450 W下处理30 min,超声时间1 s,间隔时间1 s。
1.3.2 乳化性及乳化稳定性的测定
参考Pearce等[11]的方法,用磷酸盐缓冲液(0.2 mol/L,pH值7.0)稀释改性后的混合蛋白样品至2 mg/mL,以体积比3:1的比例混合蛋白样品溶液与大豆油,并将其进行1 min均质(11 000 r/min)处理。处理后迅速吸取底部乳液100L,将其加入到10 mL 0.1% SDS 溶液中均匀混合。然后用分光光度计500 nm处分别测定0和10 min的吸光值。其乳化活性(EAI,emulsifying activity index)和乳化稳定性(ESI,emulsifying stability index)的计算公式如式(1)、(2)。

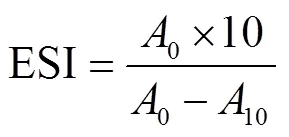
式中为稀释倍数100;为常数2.303;为比色池光径1 cm;为油相体积分数,取0.25;为乳化液形成前蛋白质的浓度,取10 mg/mL;0、10分别为乳状液在0、10 min的吸光度。
1.3.3 粒径分布的测定
用磷酸盐缓冲液(0.01 mol/L、pH值7.0)稀释制备的SPI-WPI混合溶液至1 mg/mL,参数设置为:颗粒折射率(1.460),分散剂折射率(1.330)[12]。
1.3.4-电位的测定
采用电位仪测定样品的-电位。将制备的SPI-WPI混合溶液稀释至2 mg/mL,温度平衡2 min,在25 ℃下测定[12]。
1.3.5 内源荧光光谱测定
用磷酸盐缓冲溶液(0.01 mol/L,pH值7.0)将不同比例的混合蛋白液配制成5 mg/mL的样品溶液,设置激发波长290 nm,发射波长范围300~460 nm,狭缝均为5.0 nm进行扫描[13]。
1.3.6 混合蛋白凝胶的制备
将不同比例的混合蛋白超声处理后加入TG酶(0.3 g TG酶,10 g蛋白),并将溶液的pH值调节至7.0[2]。在45 ℃下将样品保持2 h,然后在90 ℃加热灭酶10 min。形成的凝胶在4 ℃下冷藏过夜,然后进行质构、持水率(WHC,water holding capacity)、扫描电子显微镜(SEM,scanning electron microscope)的分析。
1.3.7 质构的测定
参考Jin等[14]的方法,略加改动,采用 TA-XT2i型质构仪进行测定。将不同比例混合蛋白超声处理后置于烧杯中(50 mm(直径)×25 mm(高),制备成凝胶。质构性质的测定使用/0.5柱形探头,探头下行速度为1 mm/s,检测速度为5mm/s,后撤速度为5mm/s,触发力为5 g,一次测定探头下压2次。
1.3.8 持水性的测定
将凝胶样品放在10 mL的离心管中,离心机4 000 r/min条件下离心30 min,分别将离心前与离心后移出多余水分的试管仔细称量[15],持水性(WHC)的计算公式如式(3)。

式中W样品离心前与离心管的共同质量,g;W样品离心除水后与离心管的共同质量,g。
1.3.9 扫描电子显微镜观察
将超声处理后不同比例的混合蛋白进行样品前处理,凝胶切块,浸泡在戊二醛固定剂溶液中24 h。用0.1 mol/L、pH值7.2的磷酸盐缓冲液冲洗3次。脱水用浓度为50%、70%、90%的乙醇各进行1次,每次15 min,然后100%的乙醇脱水3次,每次15 min。用体积比1:1的100%乙醇:叔丁醇、纯叔丁醇置换各1次,后冷冻干燥。然后将样品置于扫描电子显微镜(5kV)下观察其显微结构[16]。
1.4 数据统计分析
每次试验做3次平行试验,采用IBM SPSS Statistics 20软件进行数据统计分析,采用Origin 8.0软件进行试验数据绘图。
2 结果与分析
2.1 乳化性及乳化稳定性分析
图1为未处理与超声处理对SPI-WPI乳化活性与乳化稳定性的影响图,由图1可知,不同比例SPI-WPI混合体系在超声处理后乳化活性与乳化稳定性随着SPI-WPI质量比的增加呈先升高后降低的趋势。未超声的混合体系乳化活性先上升后下降,而乳化稳定性先升高,SPI-WPI质量比为3:7时下降,随后上升达到最大值。超声处理5:5时乳化活性与乳化稳定性均达到最大值分别为65.5 m2/g和16.3 min,较最低值分别提高15.5%和25.5%。对照组5:5时乳化活性达到最大值为59.3 m2/g,乳化稳定性在SPI-WPI质量比为1:9时为最大值16.2 min。影响混合体系乳化性的因素有很多,如SPI与WPI的结合程度、分子颗粒分布、蛋白质空间构象的改变等[17]。超声处理后乳化活性显著高于对照组是因为SPI-WPI混合蛋白质超声处理后在水中进一步伸展,内部基团暴露,更多小分子聚集在油水界面上,从而有效提高体系的乳化性[18]。Greta等[19]研究发现超声可以改变蛋白分子的结构,增强疏水作用,进而提高蛋白乳化性。而当SPI-WPI质量比超过3:7时对照组乳化稳定性高于超声处理组,这是因为WPI具有高乳化性[20],随着混合体系中WPI质量比的增加蛋白之间相互作用乳化稳定性增大。另外,不同比例混合蛋白超声处理后整体结构舒展,随着SPI-WPI质量比的增加,2种蛋白之间相互聚集,易于附聚在一起形成附聚物,可能影响疏水集团的暴露,从而降低体系乳化活性[21]。此外,聚集的蛋白质构象稳定性更强,不易解折叠及快速在油-水界面上稳定,因此导致乳化稳定性的降低。

注:不同字母代表有显著性差异(P<0.05),下同。
2.2 粒径分布分析
图2为未处理与超声处理对SPI-WPI粒径相对体积与平均粒径分布图,如图2a所示未超声处理粒径呈双峰分布,体积平均粒径[4,3]先增加后减小。超声处理后随着WPI质量比的增加粒径分布向更小且峰更窄的方向发展,Jambrak等[22]发现蛋白经超声处理后粒径会显著减小。超声处理混合蛋白比例5:5时转为单峰分布,此时蛋白比例平衡,使聚集后的团块最小,增加特定的自由表面[23],形成粒径大小均匀的微粒。图2b为体积平均粒径[4,3]分布图,由图可知当超声处理SPI-WPI混合体系比例为5:5时[4,3]达到最小值为205.6 nm。对照组蛋白比例为9:1时[4,3]达到最小值为335.7 nm。这可能因为蛋白液充分水合发生聚集使得粒径增大。WPI粒度显著小于SPI,随着WPI质量比的增加,蛋白碰撞结合程度减小,所以未处理的混合蛋白[4,3]下降。超声处理蛋白时,颗粒的破碎与重聚集同时发生[24],Gordon等[25]的研究具有相似的结果,他们发现对于较高的超声功率(450 W)处理12.5 min后WPI的粒径将不再减小,WPI的粒度分布也不明显的降低。此外在450 W的较高超声功率条件的处理下蛋白的相互作用增加分子间的碰撞与聚集表现出粒径轻微增加Arzeni等[26]也有类似的结果。Li等[27]指出乳液的粒径也是影响乳液稳定性的一个重要因素,粒径过大体系变得不稳定,这与本研究乳化特性的结果一致。另外Hu等[28]提出由于长时间的超声处理会引起热效应从而会使蛋白之间的相互作用形成小聚集体导致粒径的增加。

图2 未处理与超声处理SPI-WPI相对体积分布与平均粒径分布图
2.3 ζ-电位分析
SPI-WPI混合蛋白溶液的稳定性可以通过-电位即混合体系表面电荷的多少进行判断,其中最重要的是粒子间的静电斥力[29]。由图3可知对照组-电位变化趋势不明显,SPI-WPI质量比为5:5时绝对值达到最大18.1 mV,超声处理后不同比例的混合蛋白超声处理后ζ-电位随着SPI-WPI质量比的增加呈现先上升后下降的趋势,在SPI-WPI质量比为5:5时绝对值达到最大21.4 mV,说明此时颗粒之间的静电斥力最大,体系中分子不易于相互聚集[30],稳定性最好,这与粒径分布研究结果吻合。
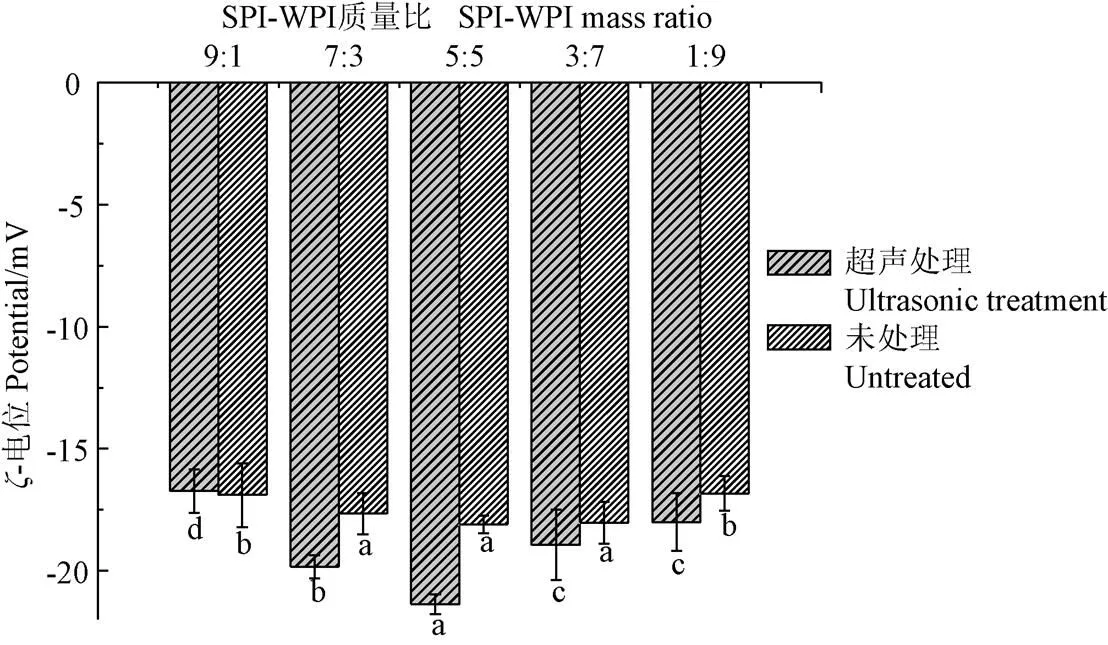
图3 未处理与超声处理对混合蛋白ζ-电位的影响
试验表明,超声处理会引起蛋白结构改变与分子间疏水相互作用的部分断裂有关,而不是肽键和二硫键[24],当混合蛋白比例为适当时,空化效应更利于分子间结构重排颗粒表面负电荷增加[31]。不同比例的SPI与WPI在超声处理后可改变体系表面电位和静电斥力,静电排斥维持乳液的稳定性,这与乳化性稳定性的研究结果相符合。
2.4 内源荧光光谱分析
蛋白质分子中内源荧光主要来自色氨酸和酪氨酸残基,其对微观环境的变化非常敏感,因此用于蛋白质三级结构构象变化的观察[32]。如图4所示,对照组不同比例SPI-WPI混合蛋白荧光强度较低且未发生红蓝移,说明此时蛋白结构未改变。

图4 未处理与超声处理荧光光谱图
超声处理后内源性荧光强度随着WPI质量比的增加而增加,其内源性荧光光谱的最大荧光强度发生蓝移(即短波长方向移动),说明不同比例SPI-WPI混合蛋白在超声处理后混合体系的构象发生了改变,荧光基团转向更加疏水的环境中,这可能是因为超声处理下SPI和WPI之间的相互作用使得蛋白质分子中的氨基酸的微观环境发生扰乱,Zhang等[32]得到相似的研究结果。荧光强度的增加是因为在较高的超声功率(450 W)条件处理下,混合蛋白的结构得到充分的展开,被包埋在蛋白内部的发色基团暴露在溶液中,增加混合蛋白表面分子的原因[33],使得蛋白的三级结构变得更加的舒展。
2.5 质构与持水性分析
质构与持水性是蛋白凝胶最重要的2个指标,可以反映凝胶体系中蛋白与水相互作用的关系。表1显示在TG酶交联作用下未处理与超声处理不同比例SPI-WPI混合蛋白质构和持水性的变化。未处理的混合蛋白质构特性与持水性均呈先上升后下降的变化趋势且变化范围不大,这可能是因为WPI较弱的凝胶性所导致。超声处理后SPI-WPI混合体系5:5时具有最高硬度值为475.61 N,同样粘性与咀嚼性也达到最大值。这可能是因为在超声作用下,蛋白之间弱键占主导地位,此时有助于凝胶硬度升高,黏性增大[15]。随着WPI质量比的增加2种蛋白质之间的相互作用减弱,超声处理后并没有形成更多的二硫键导致凝胶的结构与稳定性有所下降,这一点也可以通过扫描电子显微结构来证实。持水性可以反映凝胶内部结构的粗糙程度,当SPI-WPI比例为5:5时,持水性达到最大值。Wu等[34]得到相似的结果并指出这可能是因为SPI与WPI混合体系超声作用下粒径减小,从而促进2种蛋白之间形成更加致密和均匀的凝胶结构,高密度孔隙结构且稳定的凝胶可以有效的固定水分和提升质构性[35]。此外,不同比例SPI-WPI混合体系超声处理后蛋白内部结构充分暴露,TG酶作用下易于形成二硫键,从而在SPI与WPI比例为5:5时形成了致密稳定的凝胶三维网络结构。

表1 未处理与超声处理对不同SPI-WPI质量比混合蛋白质构与持水性的影响
注:不同字母代表同一处理不同SPI-WPI质量比差异显著。
Note: Different letters means significant difference of different SPI-WPI mass ration in the same treatment.
2.6 扫描电镜
扫描电子显微镜可以观察到在TG酶作用下不同比例SPI-WPI混合蛋白凝胶放大5 000倍后的微观结构,如图5所示为未处理与超声处理后不同比例SPI-WPI混合蛋白凝胶扫描电子显微镜。由5a和5b可以看出SPI-WPI蛋白比例为9:1与7:3时凝胶结构呈现不均匀粗糙的孔洞结构。当比例达到5:5时凝胶网络具有更均匀有序和致密的凝胶网络与平滑的结构,对照组凝胶结构粗糙网状结构单一,这与质构性和持水性的结果一致。根据Hu等[36]研究可知凝胶网络的差异可能是由于超声处理下产生空化现象后蛋白质粒径减小所致,与本试验粒径结果一致。另外超声处理会导致蛋白内部基团暴露于蛋白表面,更有利于混合蛋白二硫键的形成和疏水相互作用[4],从而形成更均匀致密的凝胶结构,但长时间超声的增加,蛋白分子间的相互碰撞加剧,可能产生聚集体。Ringgenberg等[37]研究表明凝胶性与蛋白的聚集体有着密切的关系,较大的聚集体会影响凝胶的网络结构。所以当SPI-WPI混合蛋白比例持续增加时,凝胶的结构遭到了不同程度的破坏,从而微观结构显示其凝胶结构变得不再均匀致密。Jissy等[2]得出了相似的结论,在SPI和WPI比例为5:5时,混合体系的凝胶结构由于蛋白质相互作用形成更小的空隙网络和孔洞结构。这些细致有序的凝胶网络可能会具有更高的凝胶强度和持水性。

图5 未处理与超声处理混合蛋白凝胶扫描电子显微镜图
3 结 论
1)超声处理不同比例的SPI-WPI混合蛋白能有效提高其乳化活性、乳化稳定性,当SPI-WPI质量比为5:5时,混合蛋白体系的乳化活性为65.5 m2/g,乳化稳定性为16.3 min,较最低值分别提高15.5%和25.5%。-电位绝对值均达到最大值21.4 mV,且粒径尺寸最小(205.6 nm)呈单峰分布,说明此时混合蛋白体系分布均匀,最为稳定,利于混合体系在超声处理后相互作用,提高乳化活性。
2)TG酶交联作用下不同比例SPI-WPI混合蛋白超声处理较未处理凝胶的质构性、持水性、微观结构有很大提高。超声处理后当SPI-WPI比例为5:5时,混合蛋白凝胶性具有最大的硬度为475.61 N,黏性与咀嚼性也达到最大值分别为349.19和352.20 N。凝胶结构更加致密坚固、持水性最高达到85.32%,较未超声处理提高。SPI-WPI混合体系蛋白质相互作用下凝胶结构具有更加致密稳定的凝胶三维网络结构。
本研究为开发新型双蛋白食品,提升植物蛋白与动物蛋白制品的加工技术水平具有重要的理论及实践价值,而且对研发新型蛋白生物材料具有重要的科学意义。
[1] Cosmin M, Beliciu, Carmen I, et al. Physico-chemical changes in heat treated micellar casein: Soy protein mixtures[J]. Food Science and Technology, 2013, 54(2): 469-476.
[2] Jissy J, Laurice P, Anneke H, et al. Mixing whey and soy proteins: Consequences for the gel mechanical response and water holding[J]. Food Hydrocolloids, 2016, 60: 216-224.
[3] Gonzalo G, Palazolo, Pablo A, et al. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermally-denatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3): 398-409.
[4] Qin Xinsheng, Chen Sasa, Li Xingjiang, et al. Gelation properties of transglutaminase-induced soy protein isolate and wheat gluten mixture with ultrahigh pressure pretreatment[J]. Food and Bioprocess Technology, 2017, 10(5): 866-874.
[5] Qin Xinsheng, Luo Shuizhong, Cai Jing, et al. Effects of microwave pretreatment and transglutaminase crosslinking on the gelation properties of soybean protein isolate and wheat gluten mixtures[J]. Journal of the Science of Food and Agriculture, 2016, 96(10): 3559-3566.
[6] Chemat F, Huma Z, Khan M K. Applications of ultrasound in food technology: Processing, preservation and extraction[J]. Ultrasonics Sonochemistry, 2011, 18(4): 813-835.
[7] 贾俊强,马海乐,曲文娟,等. 超声预处理大米蛋白制备抗氧化肽[J]. 农业工程学报,2008,24(8):288-293.
Jia Junqiang, Ma Haile, Qu Wenjuan, et al. Ultrasonic pretreatment for preparation of antioxidant peptides from rice protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(8): 288-293. (in Chinese with English abstract)
[8] 姜雪,韩越,杨瑞雪,等. 超声波处理在双蛋白饮品中的应用[J]. 食品工业,2015,36(10):179-183.
Jiang Xue, Han Yue, Yang Ruixue, et al. The usage of ultrasonic wave in mixed protein drinks[J]. The Food Industry, 2015, 36(10): 179-183. (in Chinese with English abstract)
[9] Bryant C M, Mcclements D J. Molecular basis of protein functionality with special consideration of cold-set gels derived from heat denatured whey[J]. Food Science and Technology, 1998, 9(4): 143-151.
[10] Hu H, Wu J, Li C et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.
[11] Pearce K N, Kinsella J E. Emulsifying properties of proteins: Evaluation of a turbidimetric technique[J]. Journal of Agriculture and Food Chemistry, 1978, 26(3): 716-723.
[12] Zhao L, Mouming Z, Ning L, et al. Physicochemical properties of peanut oil-based diacylglycerol and their derived oil-in-water emulsions stabilized by sodium caseinate[J]. Food Chemistry, 2015, 184: 105-113.
[13] Morales F J, Jimenez P S. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry, 2001, 72(1): 119-125.
[14] Jin I H, Kim J E, Seo J H, et al. Physicochemical properties
of soy protein iIsolate gels emulsified with various oils using a microbial transglutaminase[J]. Food Science Biotechnology, 2013, 22(1): 129-136.
[15] Buamard N, Benjakul S. Combination effect of high pressure treatment and ethanolic extract from coconut husk on gel properties of sardine surimi[J]. Food Science and Technology, 2018, 91: 361-367.
[16] German B, Damodaran S, Kinsella J E. Thermal dissociation and association behavior of soy proteins[J]. Journal of Agricultural and Food Chemistry, 1982, 30(5): 807-811.
[17] Liu H, Kuo M I. Ultra high pressure homogenization effect on the proteins in soy flour[J]. Food Hydrocolloids, 2016, 52: 741-748.
[18] Molina E, Papadopoulou A, Ledward D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001, 15(3): 263-269.
[19] Greta K, Vesna L, AnetrežEk J, et al. Influence of novel food processing technologies on the rheological and thermophysical properties of whey proteins[J]. Food Engineering, 2008, 87(1): 64-73.
[20] Wit de J N. Nutritional and functional characteristics of whey proteins in food products[J]. Journal of Dairy Science, 1998, 81(3): 597-608.
[21] Kato A, Osako Y, Matsudomi N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37.
[22] Jambrak A R, Lelas V, Mason T J, et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering, 2009, 93(4): 386-393.
[23] Jambrak A R, Mason T J, Lelas V, et al. Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J]. Journal of Food Engineering, 2014, 121(1): 15-23.
[24] Sui Xiaonan, Bi Shuang, Qi Baokun, et al. Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin: Its emulsifying property and emulsion stability[J]. Food Hydrocolloids, 2017, 63: 727-734.
[25] Gordon L, Pilosof A M R. Application of high-intensity ultrasounds to control the size of whey proteins particles[J]. Food Biophysics, 2010, 5: 203—210.
[26] Arzeni C, Martínez K, Zema P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472.
[27] Li Y Q, Chen Z X, Mo H Z, et al. Effects of pulsed electric fields on physicochemical properties of soybean protein isolates[J]. LWT-Food Science and Technology, 2007, 40(7): 1167-1175.
[28] Hu H, Fan X, Zhou Z, et al. Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre-treatments[J]. Ultrasonics Sonochemistry, 2013, 20(1): 187-195.
[29] Malhotra A, Coupland J N. The effect of surfactants on the solubility, zeta potential, and viscosity of soy protein isolates[J]. Food Hydrocolloids, 2004, 18(1): 101-108.
[30] Wong B T, Day L, Augustin M A. Deamidated wheat protein-dextran maillard conjugates: Effect of size and location of polysaccharide conjugated on steric stabilization of emulsions at acidic pH[J]. Food Hydrocolloids, 2011, 25(6): 1424-1432.
[31] Karlis B, Volker G, Elke W, et al. Ultra high pressure homogenization of almond milk: Physico-chemical and physiological effects[J]. Food Chemistry, 2016, 192: 82-89.
[32] Zhang Qiuting, Tu Zongcai, Xiao Hui, et al. Influence of ultrasonic treatment on the structure andemulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92: 30-37.
[33] Xia S, Li Y, Zhao Q, et al. Probing conformational change of bovine serum albumin-dextran conjugates under controlled dry heating[J]. Journal of Agricultural and Food Chemistry, 2015, 63(16): 4080-4086.
[34] Wu W, Hua Y, Lin Q, et al. Effects of oxidative modification on thermal aggregation and gel properties of soy protein by peroxyl radicals, Int[J]. Food Science and Technology, 2011, 46(9): 1891-1897.
[35] Puppo M C, Anon M C. Structural properties of heat-induced soy protein gels as affected by ionic strength and pH[J]. Journal of Agricultural and Food Chemistry, 1998, 46(9): 3583-3589.
[36] Hu H, Chan L,Wan L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloid, 2013, 32(2): 303-311.
[37] Ringgenberg E, Alexander M, Corredig M. Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J]. Food Hydrocolloids, 2013, 30(1): 463-469.
Ultrasonic treatment improving physical and chemical properties of soybean-whey mixed protein in different proportions
Wang Xibo1, Cui Qiang1, Zhang Anqi1, Wang Yuying1, Sun Hongrui2, Zhu Dandan3, Liu Yuefeng3
(1.,150030,; 2.,130000,; 3.,150090,)
Proteins are widely used in food ingredients because of their excellent nutritional and functional values. We investigated the effect of ultrasound on the functional properties of different ratios of soybean-whey mixed protein. In the experiment, we used soy protein and whey protein as raw materials, use the particle size, ζ-potential, endogenous fluorescence spectrum, their indices from scanning electron microscope, as well as the emulsification activity, emulsion stability, texture, water holding capacity were studied for physico-chemical properties and functional properties. The results showed that when the mass ratio of SPI-WPI mixture was 5:5, the emulsification activity and emulsion stability reach highest (65.5 m2/g, 16.3min), and the particle size distribution changed from double peak to single peak, the volume average particle size reached the minimum value (205.6 nm), and the absolute value of the ζ-potential reached the maximum (21.4 mV), the mixed system had the best stability at this time. The endogenous fluorescence spectrum showed that fluorescent substances released and the fluorescence intensity continued increasing, which indicated the protein structure of the mixed system was changed in ultrasonic treatment. After ultrasonic treatment, the mass ratio of mixed protein at 5:5 had the best gel properties, the highest hardness (475.61N) and the maximum water holding capacity (85.32%), the gel has a dense network structure, consistent with the results of the scanning electron microscope, which indicated the gel structure of the mixed protein system was uniform. In recent years, mixed proteins foods are more conducive to human health and have been acquired new texture, especially the mixture of plant proteins and animal proteins, which have received increasing attention. Whey Protein Isolate (WPI) and Soy Protein Isolate (SPI) are widely used in the food industry. However, the application of expanded protein in food and non-food field has been limited by poor gelation of WPI and poor emulsification of SPI, which lead to seriously restrict to the application of mixed protein in food. Research on mixed protein systems mainly focuses on improving the physical-chemical properties of mixed proteins and exploring the effects of different treatments on the interaction between mixed proteins. However, research on the functional properties of the SPI-WPI mixed protein system by ultrasonic has not been reported. We mainly explored the effects of the emulsification and gel property after the ultrasonic treatment (450 W, 30 min) of different mass ratios (1:9, 3:7, 5:5, 7:3, 9:1). The different mass ratios of without ultrasonic SPI-WPI mixed protein were designed as a control to explore the mechanism of ultrasonic treatment on the functional properties of mixed proteins. Our studies showed that the complementary effects of mixed proteins were mainly reflected in the interaction between soy protein isolate and casein or whey protein in milk forms a “key cluster” to promote efficient use of amino acids. This essay study aimed to prepare a high-emulsification and gelatinous mixed protein food to provide a theoretical basis for the development of new biprotein foods.
ultrasonics; emulsification; gelation; soy protein isolate; whey protein isolate
王喜波,崔 强,张安琪,王玉莹,孙洪蕊,朱丹丹,刘越峰. 超声处理改善不同比例大豆-乳清混合蛋白理化性质[J]. 农业工程学报,2018,34(22):299-305. doi:10.11975/j.issn.1002-6819.2018.22.037 http://www.tcsae.org
Wang Xibo, Cui Qiang, Zhang Anqi, Wang Yuying, Sun Hongrui, Zhu Dandan, Liu Yuefeng. Ultrasonic treatment improving physical and chemical properties of soybean-whey mixed protein in different proportions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 299-305. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.22.037 http://www.tcsae.org
2018-07-04
2018-10-11
十三五国家重点研发计划资助(2018YFD0400600)
王喜波,副教授,博士,研究方向为粮食油脂及植物蛋白工程。 Email:wangxibo@neau.edu.cn
10.11975/j.issn.1002-6819.2018.22.037
TS201.2
A
1002-6819(2018)-22-0299-07
