增氧地下滴灌改善土壤通气性促进番茄生长
2018-11-23雷宏军潘红卫徐建新
臧 明,雷宏军,潘红卫,刘 欢,徐建新
增氧地下滴灌改善土壤通气性促进番茄生长
臧 明,雷宏军※,潘红卫,刘 欢,徐建新
(华北水利水电大学水利学院/水资源高效利用与保障工程河南省协同创新中心,郑州 450046)
增氧地下滴灌将空气与灌溉水混匀后输送到作物根区,可实现作物提质增产和水肥高效利用,而其关键作用机制尚不明确。该文以番茄为供试作物,设置灌水量和增氧量2因素2水平完全随机区组试验,记为W1和W2(分别为作物-蒸发皿系数的0.6和1.0倍)、A和C(增氧和对照组),系统监测了壤质黏土条件下作物生长生理动态与土壤通气性状况,探究土壤通气性与作物生长之间的响应机制。结果表明,增氧地下滴灌对土壤溶解氧浓度、氧气扩散速率、氧化还原电位和土壤呼吸有一定的改善作用。与对照相比,W2A处理开花坐果期灌水后第2天的土壤溶解氧浓度、氧气扩散速率、氧化还原电位和土壤呼吸速率提高了25.71%、52.90%、41.99%和64.70%(<0.05)。土壤氧气扩散速率和氧化还原电位分别与溶解氧浓度和充气孔隙度呈极显著正相关(<0.01)。增氧地下滴灌促进了番茄生物量积累和养分利用,促进了作物的光合作用,表现为产量提高和品质改善。与对照相比,W2A处理3个时期的光合速率分别增大14.51%、21.72%和13.76%(<0.05),地上及地下部鲜质量分别增加了68.14%和55.18%(<0.05),根、茎、叶氮素吸收量增加了52.94%、42.03%和24.12%(<0.05),产量、可溶性固形物和维生素C含量增加了66.40%、51.77%和20.26%(<0.05)。1.0倍作物-蒸发皿系数灌水时增氧处理在改善土壤通气性,促进番茄生长,提高番茄产量方面的效果最为明显。作物产量与溶解氧浓度、氧化还原电位及土壤呼吸均值均呈显著正相关(<0.05),作物品质(可溶性固形物、总酸含量)与土壤溶解氧浓度、氧气扩散速率和土壤呼吸均值呈显著正相关(<0.05)。研究结果为揭示增氧地下滴灌对土壤通气性的改善效应提供了科学依据。
光合作用;生物量;灌溉;土壤通气性;作物生长;产量;品质;养分利用
0 引 言
农田灌溉–蒸散过程使得土壤处于干湿交替变化之中,即使高效的地下滴灌也会出现至少短期的根区缺氧[1]。土壤水分过多,驱替了土壤氧气,降低了土壤通气性,抑制了根系对养分的吸收,根系生理代谢和根系伸展受阻[2],制约了作物的生产潜能[3]。
通过地下滴灌系统将氧气或含氧物质与水混匀后输送到作物根区的一种新型灌水技术被称为增氧地下滴灌[1]。这项技术在提高灌溉水利用效率的同时,有效缓解了根区土壤缺氧状况[2-3],为发挥作物高产潜力提供了新的途径[4]。其中,土壤通气性的改善以及由此带来的根系吸收和运输功能的提高是作物增产的基础[5]。研究表明,增氧灌溉能促进作物生长和养分吸收,增加作物产量和水分利用效率[6-7]。
土壤通气性是表征土壤透气性和氧含量的综合指标,反映了土壤气体的组成及其对植物的作用,包括土壤气体的产生、吸附、交换等各个方面[8]。土壤通气性指标通常可归为3类:1)容量指标,土壤孔隙中气体填充的体积,即土壤充气孔隙度;充气孔隙度在一定范围内和根系生长速率呈正相关关系[9];史春余等通过改善土壤孔隙度改善了土壤通气性,增强了甘薯块根中ATP酶活性,提高了产量[10]。2)强度指标,土壤孔隙中的氧分压或土壤溶液中的溶解氧浓度;有研究指出,增氧灌溉可改善番茄根区土壤氧气含量,促进了土壤呼吸[11]。3)传输速率,氧气向土壤中某点的供应速率,即氧气扩散速率[12](oxygen diffusion rate,ODR);Lemon等[13]首次利用铂金电极模拟根系对氧气的吸收,ODR可以较好表征土壤向根系的供氧能力;已有研究表明,ODR与土壤氧气浓度存在良好的线性关系[14],土壤水分过多会造成ODR下降[15]。
目前关于增氧地下滴灌的研究多集中于作物生长与土壤微生物影响方面,对土壤通气性调控与作物生长之间的响应关系尚不明确。本试验以番茄为供试作物,设置不同的灌溉水平,以普通地下滴灌为对照,通过系统监测土壤通气性与作物生长生理状况,明确增氧地下滴灌对作物生长与土壤通气性的影响,揭示土壤通气性与作物生长之间的响应机制,为阐明增氧灌溉对土壤通气性的改善效应提供科学依据。
1 材料与方法
1.1 试验地点
试验于华北水利水电大学农业高效用水实验场现代化温室内(34°47′5.91″N,E113°47′20.15″)开展,属于暖温带亚湿润季风气候,多年平均气温14.3 ℃,年均降雨量632 mm,无霜期220 d,全年日照时间约2 400 h。试验期间温室微气候动态见图1所示。
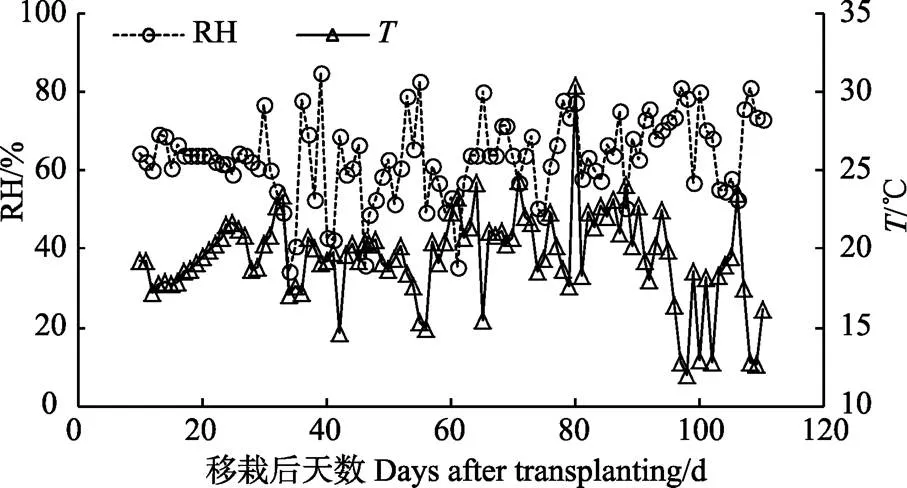
图1 作物生育期温室平均气温T和相对湿度RH动态
1.2 试验材料
供试土壤为壤质黏土,pH值7.1,容重1.1 g/cm3,砂粒、粉粒和黏粒质量分数分别为34.6%、31.9%和33.5%,种植前土壤有机质质量分数为13.21 g/kg,碱解氮、有效磷和速效钾质量分数分别为87.14、12.16和135.36 mg/kg。供试番茄品种为金鹏8号。
1.3 试验设计
采用盆栽试验,设置灌水量和增氧量2因素2水平完全随机区组试验,记为W1(0.6倍作物–蒸发皿系数)和W2(1.0倍作物–蒸发皿系数)、A(增氧处理)和C(对照处理),各5次重复。增氧处理通过将文丘里射流器(Mazzei air injector 684,Mazzei Corp,美国)置于水流干路上,利用偏压射流器从承压水箱顶部吸取空气,使用循环水泵将灌溉水往复通过文丘里射流器进行循环曝气。每次灌溉前曝气20 min,然后再进行灌溉,灌水压力为0.1 MPa,此时掺气比约15%[16-17]。
盆栽桶为圆形,高50 cm,直径40 cm,盆栽桶埋入土壤与地面齐平,以维持盆栽土温与环境土温相一致。每盆装土初始质量80 kg,初始质量含水率为25%。采用地下滴灌进行供水,每桶中心位置埋设一个滴头(Netafim,以色列奈特菲姆灌溉公司),滴头埋深15 cm,灌溉压力为0.1 MPa,流量2.2 L/h。
1.4 试验管理
于2017年9月27日作物处于4叶1心至5叶1心时移植番茄苗,每盆1株。移植当天浇透底水,移植后10 d开始增氧处理,株高30~40 cm时进行吊蔓,三穗果后打顶。番茄生育期共计124 d,生育期划分列于表1。灌水量依据式(1)计算[18]:
=·E·K(1)
式中为各处理每次的灌水量,L;为盆栽面积,m2;E为2次灌水时间间隔内蒸发皿的蒸发量,mm;K为作物–蒸发皿系数,充分灌溉处理时取1.0[11]。每天08:00—09:00 测定Φ601标准蒸发皿的蒸发量,以此控制灌水量。
采用的肥料为高钾型水溶性肥,N、P2O5、K2O、Fe、Mn、Zn、Cu、Mo、B的质量分数为15%、15%、30%、0.10%、0.05%、0.15%、0.05%、0.05%和0.10%(施乐多,中国康拓肥料有限公司)。播种前,基肥用量为30 g/盆,均匀搅拌施于表层土体的1/3处。分别于第64和94天通过水肥耦合方式追肥2次,每次10 g/盆。

表1 番茄生育期划分
1.5 试验观测内容及方法
1.5.1 土壤充气孔隙度与土壤温度
使用土壤温湿度智能采集系统(QS-3000,中国清胜电子科技有限公司)监测土壤的水分状况(体积含水率)。选择相同处理中3盆长势相对一致的番茄,于盆中埋设水分探头,埋设于距植株茎秆5 cm处,埋设深度为10 cm。于开花坐果期、果实膨大期和成熟期各选择一个完整的灌水周期测量土壤充气孔隙度与土壤温度,测量时间为每天09:00和15:00。
根据测量的土壤体积含水率计算充气孔隙度,公式如下[19]:
=1–ρ/ρ–θ(2)
式中为充气孔隙度,%;ρ为土壤容重,g/cm3,取1.1 g/cm3;ρ为土粒密度,g/cm3,比重瓶法[19]实测值为2.58 g/cm3;θ为土壤体积含水率,%。
1.5.2 土壤溶液溶解氧浓度
测量土壤水分的同时,采用光纤微氧传感器测定测定土壤溶解氧浓度(OXY4-mini,德国Presens公司)。选择与测定土壤湿度相一致的盆栽桶测量有关土壤通气性指标。探针距植株茎秆横向距离5 cm,深度为10 cm。播种前将探针埋设于土壤中,测量时待数据稳定后(5 min)自动保存数据,然后手动更换到下一连接探头,直至测量结束。
1.5.3 土壤氧化还原电位/氧气扩散速率
土壤氧化还原电位及氧气扩散速率测定的时间和盆栽选取与土壤充气孔隙度测定保持一致。于盆中埋设铂金电极、参比电极和铜对电极,电极距离植株横向距离5 cm处埋设,深度为10 cm。采用氧化还原电位测量仪(中国上海仪电科学仪器股份有限公司)完成土壤氧化还原电位及氧气扩散速率测定[20]。
1.5.4 土壤呼吸速率
采用土壤呼吸测量系统(ADC LCi-SD,英国Delta-T公司)测量土壤呼吸和土壤温度。测量前将土壤呼吸室底座提前埋设于待测土壤中,测量稳定后(2~3 min)读数。
1.5.5 净光合速率、蒸腾速率及气孔导度
使用光合测定仪(Li-6400XT,美国Li-COR公司),于开花坐果期、果实膨大期和成熟期测定所有盆栽植株的净光合速率、蒸腾速率和气孔导度。测定时间选择晴朗天气09:00—11:00。
1.5.6 生物量
作物收获后,立即对所有盆栽植株进行挖根处理,地上部和地下部分别称取鲜质量,之后放入烘箱中110 ℃杀青30 min,然后调至75 ℃保持72 h,测定其干质量。
1.5.7 产量及水分利用效率
采用0.01 g电子天平称量果实鲜质量,以盆为单位进行统计,并计算最终的单盆产量。采用单盆产量与灌水量比值计算水分利用效率。
1.5.8 果实品质
以盆为单位测定番茄果实品质,采用手持式折光糖度仪(PAL-1,日本爱拓公司)测定可溶性固形物含量;用2,6—二氯靛酚滴定法测定维生素C(VC)含量;采用酸碱滴定法测定总酸;采用Brandford法测量可溶性蛋白质[18]。
1.5.9 植株养分
分别测定根、茎、叶中全氮、全磷和全钾吸收量。植株样品烘干粉碎过筛后用H2SO4-H2O2消解,采用凯氏定氮仪(K9840,中国海能仪器股份有限公司)测定全氮,钼锑抗比色法测定全磷,火焰分光光度计法测定全钾[6]。相关指标计算公式如下:
=C·M/1000 (3)
=A/(4)
式中为各器官氮(磷、钾)吸收量,g/盆;C为各器官氮(磷、钾)含量,g/kg;M为器官干质量,g/盆;为植株氮(磷、钾)素吸收效率,g/g;A为植株总氮(磷、钾)吸收量,g/盆;为施氮(磷、钾)肥量,g/盆。
1.6 数据处理
土壤通气性指标(土壤充气孔隙度、土壤溶液溶解氧浓度、土壤氧化还原电位及氧气扩散速率)取相同处理的3次重复,其余指标(土壤呼吸速率、生理指标、生物量、产量、品质和植株养分等)以相同处理的5次重复进行统计,数据采用平均值±标准差表示。采用SPSS 22.0统计软件进行数据分析。
2 结果与分析
2.1 不同生育期增氧地下滴灌对土壤通气性的影响
2.1.1 对土壤充气孔隙度和溶解氧浓度的影响
于开花坐果期、果实膨大期和成熟期分别测量土壤充气孔隙度(,air-filled porosity)和溶解氧浓度(dissolved oxygen,DO),结果见图2。W1C、W1A、W2C和W2A的土壤充气孔隙度平均值分别为33.57%、34.88%、30.52%和31.12%,以W1A处理最高,W2C最低。相同灌水水平下,增氧处理和对照的土壤充气孔隙度无显著差异(>0.05)。灌水量的增加显著降低了土壤充气孔隙度,其中,W2C处理较W1C平均下降了9%,W2A较W1A平均下降了11%(0.05)。

注:W1和W2分别为0.6和1.0倍作物–蒸发皿系数,A和C分别为增氧和对照处理,下同
土壤DO呈现灌水后下降,而后逐步回升的趋势(图2d~图2f)。其中,以W2A最高,W1A次之,W1C和W2C最低。不同生育时期不同处理之间土壤溶液中DO的变化有所差异。与对照相比,开花坐果期灌水后第2天W2A处理增加了25.71%(<0.05),W1A处理增加了10.64%(<0.05);而在果实膨大期和成熟期的灌水周期内,各处理的DO值在灌水后的第2 天差异不再显著。
2.1.2 对土壤氧气扩散速率和氧化还原电位的影响
不同生育期的土壤氧气扩散速率(oxygen diffusion rate,ODR)和氧化还原电位(Eh)见图3。各处理ODR灌水后下降至最低值,而后逐步升高。其中,W1A和W2A较大,W1C和W2C较低。增氧处理的ODR较对照有显著提高,尤其在灌水后第2天,此时W2A和W1A已回升至较高水平,W2A处理3个生育期灌水后第2天ODR较对照分别提高了52.90%、38.00%和28.15%(<0.05),W1A在开花坐果期和果实膨大期提高了32.27%和27.91%(<0.05),成熟期无显著差异(>0.05)。
不同生育期土壤Eh动态变化趋势基本相同,灌水期间下降至最低,灌水结束后慢慢开始回升。增氧处理回升速度较快,灌水后第2天,W2A处理较对照有显著差异,开花坐果期和成熟期分别提高了41.99%和36.31%(<0.05),W1A分别提高了20.99%和21.72%(<0.05)。在开花坐果期和成熟期,增氧处理于灌水周期的第3天上午回升至灌水前水平,此时W2A较对照分别提高了36.15%和31.31%(<0.05),W1A提高了17.84%和20.62%(<0.05)。果实膨大期各处理均无显著差异(>0.05)

图3 不同生育期土壤氧气扩散速率和氧化还原电位动态
2.1.3 对不同生育期土壤呼吸和土壤温度的影响
图4给出了温室番茄不同生育期的土壤呼吸()和土壤温度()变化动态。大多情况下以W2A最大,W2C最小,且土壤呼吸随着土壤温度升高而增大。在3个灌水周期中,增氧处理对土壤呼吸速率均有显著的增强作用,在灌水后第2 天下午最为显著,W1A和W2A较对照分别增强了28.45%和64.70%(开花坐果期)、33.24%和14.17%(果实膨大期)、32.86%和56.91%(成熟期)(< 0.05)。灌水量对土壤呼吸速率的影响不显著(>0.05)。
2.2 增氧地下滴灌对温室番茄生长生理指标的影响
2.2.1 对温室番茄生理指标的影响
开花坐果期、果实膨大期和成熟期的叶片光合速率、气孔导度和蒸腾速率测定结果列于表2。W2A处理的光合速率较对照组有显著提高,3个时期W2A的光合速率分别增大了14.51%、21.72%和13.76%(<0.05);W1A仅果实膨大期增加了55.26%(<0.05),其余时期无显著差异(>0.05)。气孔导度和蒸腾速率也受到增氧处理的影响,开花坐果期W1A的气孔导度和蒸腾速率较W1C处理分别增大了10.91%和11.64%(<0.05),W2A的蒸腾速率较W2C增加了31.98%(<0.05);果实膨大期W1A的蒸腾速率较W1C增大了52.92%(<0.05)。
灌水量的增加对作物光合作用、气孔导度和蒸腾速率也有一定的改善作用。果实膨大期W2A和W2C处理光合作用较W1A和W1C分别增加了33.96%和70.87%(<0.05),气孔导度增大了76.92%和206.25%(<0.05),蒸腾速率增加了20.87%和78.21%(<0.05)。
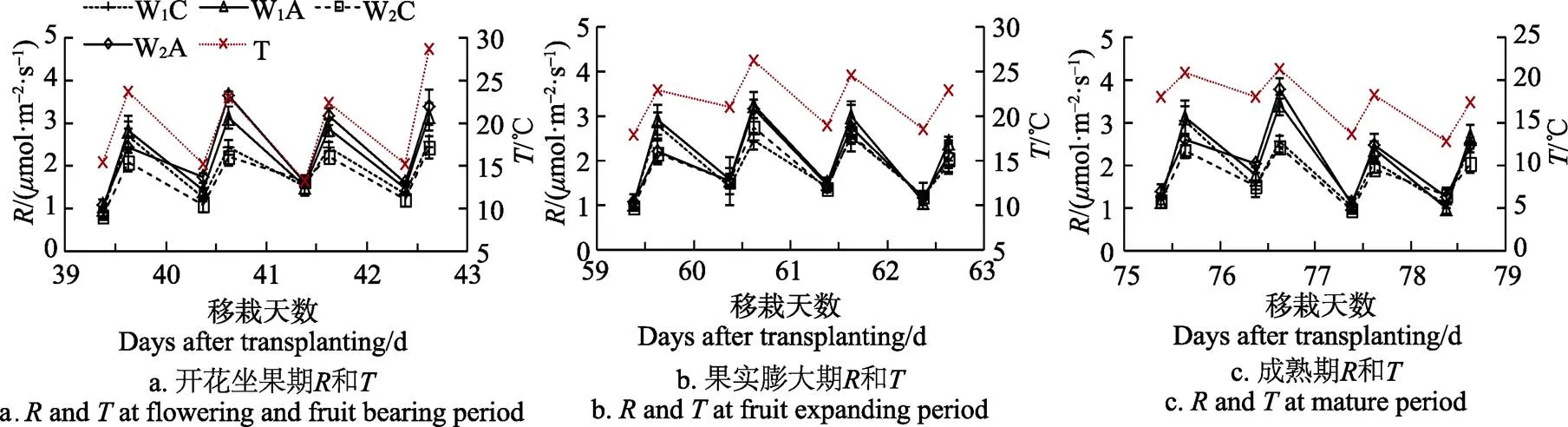
图4 不同生育期土壤呼吸和土壤温度变化动态

表2 不同时期番茄生理指标
注:相同指标同一列不同的小写字母表示0.05水平存在显著性差异。开花坐果期取移栽后第40天,果实膨大期取移栽后第60天,成熟期取移栽后第76天。下同。
Note: The different letters at a single parameter in same column indicates significant differences at the level of 0.05 and same as blow. Flowering and fruit bearing period data are on 40thday after transplanting, fruit expanding period data are on 60thday after transplanting, and mature period data are on 76thday after transplanting. same as below.
2.2.2 对温室番茄生物量积累、产量及品质的影响
不同处理对作物生物量的影响见表3。结果表明,增氧可显著提高番茄的生物量。W2A的地上部鲜质量、地上部干质量、地下部鲜质量和地下部干质量较对照分别增加了68.14%、22.88%、55.18%和39.53%(<0.05);W1A的地上部鲜质量、地下部鲜质量和地下部干质量增大了9.88%、45.37%和41.90%(<0.05)。除对照处理地上部生物量外,灌水量的增加可显著增加番茄的生物量。增氧处理下,W2A的地上部鲜质量、地上部干质量、地下部鲜质量和地下部干质量较W1A分别增大了46.38%、18.53%、23.57%和18.11%(<0.05);常规灌溉下,W2C的地下部鲜质量和地下部干质量较W1C增大了15.76%和20.11%(<0.05),地上部生物量无显著差异(>0.05)。
温室番茄的产量、水分利用效率和果实品质列于表3。与对照相比,W2A的产量增大了66.40%(<0.05),W2A和W1A的水分利用效率分别提高了66.38%和13.56%(<0.05)。常规滴灌低灌水量有较高的水分利用效率,W1C的水分利用效率较W2C增大了63.88%(<0.05)。
增氧处理可显著改善番茄品质。W2A的可溶性固形物、VC含量、总酸含量和可溶性蛋白质较对照分别增加了51.77%、20.26%、55.26%和63.64%(<0.05),W1A的可溶性固形物、VC含量和总酸含量较对照增大了43.55%、29.68%和71.43%(<0.05)。增氧条件下,高灌水量处理的VC含量和可溶性蛋白质有所提高,W2A较W1A增大了19.32%和50.00%(<0.05)。

表3 不同处理番茄生物量、产量、水分利用效率和果实品质
2.2.3 对温室番茄养分吸收利用的影响
番茄植株不同部分的养分吸收量和整个植株的养分吸收效率列于表4。与对照相比,W2A的根、茎和叶N素吸收量增大了52.94%、42.03%和24.12%(<0.05);W2A和W1A的茎部P素吸收量提高了36.00%和20.83%(<0.05),W2A的根部P素吸收量提高了74.07%(<0.05);W2A和W1A的根K素吸收量提高了56.52%和30.43%(<0.05),叶K素吸收量提高了22.44%和25.00%(<0.05),W2A的茎部K素吸收量提高了41.09%(<0.05)。增氧条件下高灌水量处理养分吸收量较多。与W1A相比,W2A的根、茎和叶N素吸收量增大了18.18%、40.00%和24.12%(<0.05),根和茎P素吸收量增大了34.29%和17.24%(<0.05),根、茎和叶K素吸收量增大了20.00%、40.00%和12.35%(<0.05)。在常规灌溉条件下,W2C的叶K素吸收量较W1C增大了14.71%(<0.05),其余无显著性差异(>0.05)。
与W2C相比,W2A处理N、P、K吸收效率分别提高了28.57%、35.71%、28.57%(<0.05);W1A处理P、K吸收效率较W1C提高了20.00%和15.79%(<0.05)。高灌水量增氧处理促进了作物养分吸收,W2A处理N、P、K吸收效率较W1A分别提高了25.58%、18.75%、22.73%(<0.05)。

表4 温室番茄植株以及不同部位的养分吸收
2.3 增氧地下滴灌土壤通气性对作物生长生理的改善效应分析
2.3.1 土壤通气性指标的相关分析
将同时段测量的土壤通气性指标进行相关关系分析,列于表5。土壤ODR与、DO、Eh呈现极显著正相关(<0.01);Eh与、DO呈现极显著正相关(<0.01);DO和呈极显著的正相关(=0.81~0.95,<0.01);不同处理的土壤呼吸()与土壤温度()呈现极显著的正相关(<0.01),对照处理的和DO呈显著负相关(<0.05)。
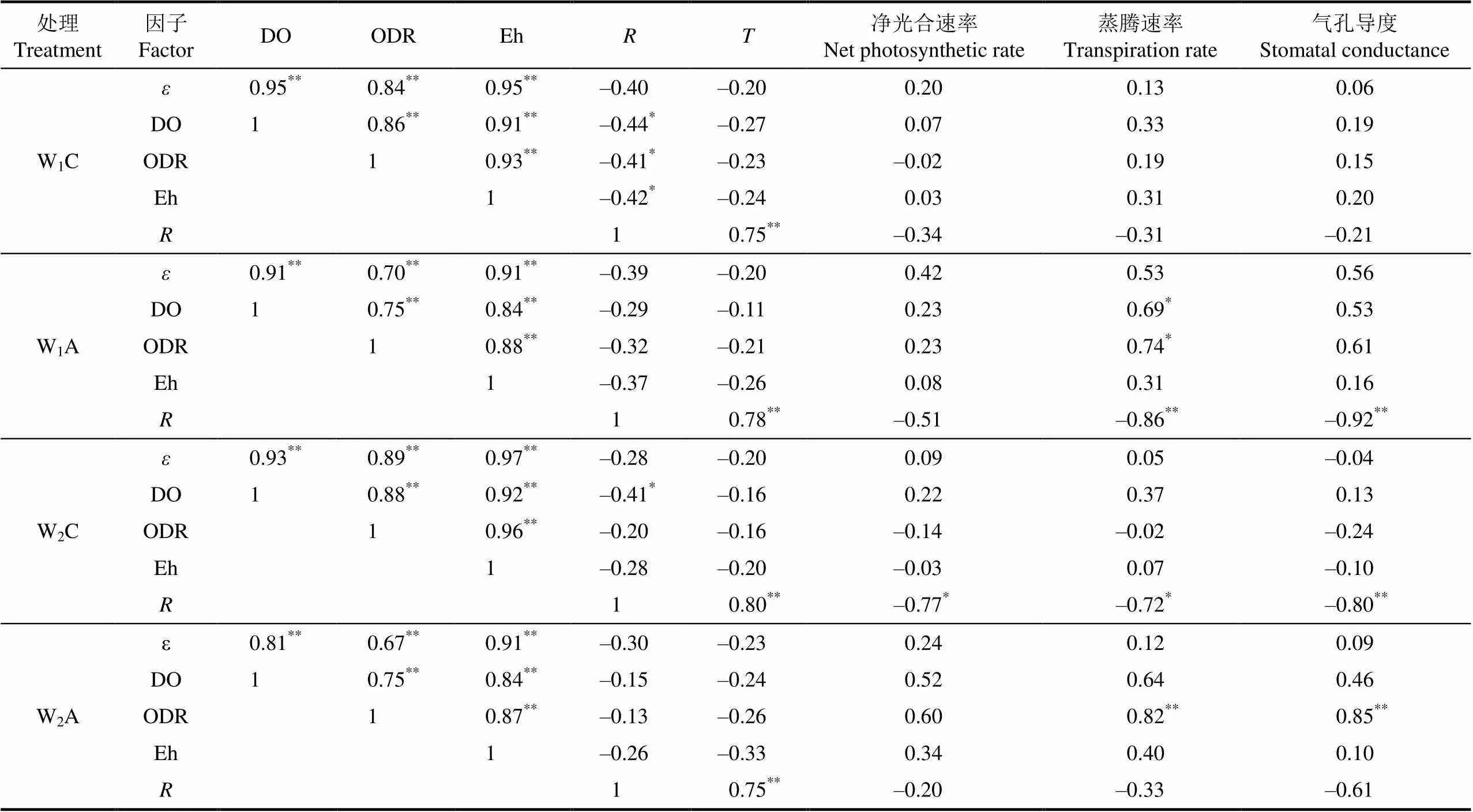
表5 充气孔隙度、溶解氧浓度、氧气扩散速率、氧化还原电位、土壤呼吸、土壤温度间及其与光合指标的相关关系
注:**表示极显著相关性(<0.01),*表示显著相关性(<0.05),=24,下同。
Note: ** indicates extremely significant (<0.01); * means significant (<0.05),=24, same as below.
2.3.2 土壤通气性和作物生理指标之间的相关分析
由图2和图3可知,灌水后第2天的土壤通气性改善最为明显,将灌水周期第2天上午的土壤通气性指标和同期的光合作用指标进行相关关系分析,列于表5。光合速率受光照强度等因素的影响较大,和土壤通气性指标的相关关系不显著(>0.05)。蒸腾速率受增氧处理的影响较大,W1A处理的DO、ODR和蒸腾速率呈显著的正相关关系(<0.05);W2A处理的ODR和蒸腾速率呈极显著的正相关关系(<0.01)。W1A和W2C处理的气孔导度和呈极显著的负相关关系(<0.01);W2A处理的ODR和气孔导度呈极显著的正相关关系(<0.01)。
2.3.3 土壤通气性和作物产量、品质及植株养分吸收效率的相关分析
将整个生育期不同灌水周期通气性指标的平均值视为该处理的值,将4种处理视为整体分析其与产量、品质和植株养分吸收效率的关系,列于表6。由表6可知,作物产量与DO和Eh呈极显著正相关(<0.01),与呈显著正相关(<0.05);可溶性固形物与ODR和呈显著正相关(<0.05),总酸含量与DO呈显著正相关(<0.05),与ODR和呈极显著正相关(<0.01)。
由表6可见,DO与和养分吸收效率呈显著的正相关(<0.05);ODR和P吸收效率呈显著正相关(<0.05);Eh和N吸收效率呈显著正相关(<0.05),和P、K吸收效率呈极显著正相关(<0.01)。

表6 充气孔隙度、溶解氧浓度、氧气扩散速率、氧化还原电位、土壤呼吸与作物产量、品质、植株养分吸收效率之间的相关关系
3 讨 论
3.1 增氧地下滴灌对作物根际土壤通气性的影响
土壤氧气临界浓度包括气相和液相两部分[21],土壤气相氧和土壤液相氧为土壤氧气环境的主要组成部分[22]。充气孔隙度与土壤含水率之和为土壤总孔隙度,二者存在互为消长关系。试验中相同灌水量时充气孔隙度差异并不显著(图2),增氧对土壤含水率的影响较小,与朱艳等[11]关于单次加气对充气孔隙度无影响的结论一致。土壤溶液中的溶解氧浓度受增氧地下滴灌的影响较大。增氧处理的土壤溶液溶解氧浓度较对照显著增大(图2)。有研究表明,加气灌溉下土壤溶解氧浓度增大了12%[23],这与本试验结论一致。
氧气扩散速率能反映氧气对植物的有效性,是最具代表性的土壤通气性指标[12]。通常认为低于40×10–8g/(cm2·min)时无法满足作物正常需求,低于20×10–8g/(cm2·min)时通气严重不良[12]。氧化还原电位可反映土壤的氧化还原状况[24],在调节土壤微生物环境方面起着重要作用[25]。通常认为氧化还原电位高于414 mV时土壤氧气状况较好,低于120 mV为缺氧状况[26]。增氧灌溉水气两相流中微气泡易附着土壤孔隙中[17],可持续向水中供氧,以维持土壤中良好的氧气环境,可维持24 h以上[27]。本试验中,增氧处理的氧气扩散速率和氧化还原电位有显著提高,改善效果最少持续了24 h(图3)。
土壤呼吸是土壤与大气之间进行气体交换的主要途径,主要来自作物根系的自养呼吸作用和土壤微生物的异养呼吸作用[28]。土壤温度、土壤水分及土壤通气状况均对土壤呼吸产生重要影响[29]。根系呼吸是植物活性最为敏感的指标,与土壤通气状况紧密相关,土壤通气不足首先表现为根系呼吸强度下降,进而影响土壤呼吸[30 ]。有研究表明增氧地下滴灌可显著改善作物根区的缺氧状况,根区土壤氧气浓度得到了提高[31],增强了根系的自养呼吸作用[3],促进了根区土壤中好氧微生物的增长[32],进而促进了土壤呼吸(图4)。
3.2 作物生长生理指标对土壤通气性改善的响应
增氧地下滴灌改善了根区缺氧环境,提高了作物的气孔导度、光合作用效率[33]以及蒸腾速率[34]。本试验中,光合作用有较大的改善,叶片蒸腾作用也受益于土壤通气性的改善,增氧处理的光合速率、蒸腾速率和气孔导度较对照处理有所提高(表2)。Sojka[35]的研究指出,根区的低氧环境会导致光合速率的降低,增氧灌溉改善了低氧胁迫,光合速率得到增强。水分过多时,根区的低氧环境会导致根系的水分利用效率降低[36],影响植株的生长,降低叶片的蒸腾速率。本试验中,作物生理指标同土壤通气性的反映一致,有研究指出,ODR值与植物的生理反应、营养特性和植物生长密切相关[12],这与本试验结论一致。
根区低氧胁迫会使根向冠层传递缺氧信号,影响水、植物生长素等生长物质的运输和储存,导致作物减产[37]。增氧灌溉将氧气或含氧物质输送到根区,满足根系生长的需求,可促进植株的生长发育,有效提高植株的生物量积累及产量[10,18,23]。本试验中,增氧处理促进了番茄的生物量累积,地上部和地下部生物量均有显著提高(表3)。增氧地下滴灌对根系有明显的增强作用,促进了根系的干物质积累,关于番茄和大豆的研究证明了这一点,增氧灌溉促进了植株根系的生长[31]。增氧处理促进了番茄的产量,本试验中番茄的产量和水分利用效率均有显著提高(表3),这与Lei等[27]所研究的在玉米产量受到增氧灌溉的增产效果相一致。作物产量和全生育期的蒸散量成正比[34],开花坐果期增氧处理的蒸腾速率较对照显著提高,与产量表现一致(表2)。
增氧地下滴灌改善了根系生长环境,增强了根系对养分的吸收和转运,促进了植株对养分的吸收利用[6]。本试验中,增氧处理各部分的养分吸收量均有显著提高,植株养分吸收效率也得到显著改善(见表4)。作物养分吸收状况改善对作物品质存在较大影响[18],增氧处理的VC含量、可溶性固形物和总酸含量都有了显著提高 (表3)。朱艳等[18]关于加气灌溉的研究同样证明了改善根区缺氧环境可以提高番茄品质。
3.3 作物生长生理指标与土壤通气性改善的关系
增氧灌溉将含氧物质输送到作物根区,提高了土壤气相和液相氧的数量,改善了土壤中的氧气扩散速率和氧化还原电位,增强了土壤呼吸[21]。土壤中的气相氧和液相氧作为土壤氧气环境的主要组成部分[22],对土壤通气性的影响较为明显,各处理的土壤氧气扩散速率及氧化还原电位和溶解氧浓度和充气孔隙度呈极显著的正相关关系(表5)。
土壤呼吸是作物根系和土壤微生物消耗氧气,释放二氧化碳的过程,与土壤温度密切相关,通常随着土壤温度的升高而增大[38]。本试验中,土壤呼吸与土壤温度呈显著正相关,和其他通气性指标的相关关系并不显著(表5)。这可能是由于土壤呼吸是消耗氧气的过程,增氧处理促进了土壤中气相氧和液相氧的流通和交互作用,即使因增氧处理土壤呼吸作用增强而耗氧增大,土壤氧气环境仍有显著改善。
根系的生长与土壤通气性息息相关,良好的根区氧气环境可以促使根系对水分的吸收和转运[37],影响作物的蒸腾速率和气孔导度[34]。本试验中,增氧处理作物蒸腾速率、气孔导度和氧气扩散速率呈显著正相关(表5),这可能是由于作物蒸腾除了和根区环境有关外,和所处的生长环境密切相关。增氧处理改善了根区的氧气环境,促进了根系呼吸[30],使根系代谢旺盛,增强了对作物蒸腾的影响,使其有显著的正相关关系。作物根区低氧胁迫直接影响作物叶片的光合速率和光合器官活性[33]。增氧处理可缓解根区低氧胁迫,改善光合作用,但是光合速率和通气性并没有显著的相关关系,这可能是由于根区缺氧影响光合器官活性进而影响光合速率,土壤通气性改善缺氧环境,恢复了光合器官活性,增强了光合作用,但是当光合器官恢复活性后,通气性对光合作用的改善效果会不再明显[39]。
土壤液相氧是维持根系生长及微生物呼吸所需的氧气直接来源[21]。增氧处理将水气二相流输送到作物根区,以最直接的方式改善了土壤中的氧气环境,促进了作物的养分吸收利用和品质改善[6,18]。可见,番茄产量与溶解氧浓度、氧化还原电位及土壤呼吸呈显著的正相关,可溶性固形物与氧气扩散速率及土壤呼吸呈显著的正相关,总酸含量与溶解氧浓度、氧气扩散速率和土壤呼吸呈显著正相关(表6);植株养分吸收效率和溶解氧浓度、氧化还原电位和土壤呼吸呈显著正相关(表6)。
4 结 论
该文以温室番茄为供试作物,研究了不同灌水量和增氧量条件下作物生长生理动态与土壤通气状况,探究了土壤通气性与作物生长之间的关系,结论如下:
1)增氧地下滴灌可显著改善土壤通气性。高灌水量下增氧处理的土壤溶解氧浓度、氧气扩散速率、氧化还原电位和土壤呼吸速率均有显著增强。
2)总体而言,增氧地下滴灌促进了番茄生物量积累和养分吸收利用,增强了植物的光合作用,表现为产量提高和品质改善。与W2C相比,W2A处理的生理指标有显著提高,产量增加了66.40%(<0.05),可溶性固形物和VC含量分别增加了51.77%和20.26%(<0.05)。1.0倍作物–蒸发皿系数的增氧处理在改善土壤通气性,促进番茄生长,提高番茄产量方面的效果更为明显。
3)土壤环境中的气相氧和液相氧对土壤通气性的影响较为明显。各处理的土壤氧气扩散速率及氧化还原电位和溶解氧浓度及充气孔隙度呈极显著正相关(<0.01)。
4)土壤通气性的改善和作物提质增产存在直接相关关系。各处理的产量、品质与溶解氧浓度、氧化还原电位及土壤呼吸等呈显著正相关(<0.05)。
[1] Bhattarai S P, Midmore D J, Su N. Sustainable irrigation to balance supply of soil water, oxygen, nutrients and agro-chemicals[M]//Biodiversity, Biofuels, Agroforestry and Conservation Agriculture. Netherlands: Springer, 2011: 253-286.
[2] Silberbush M, Gornat B, Goldberg D. Effect of irrigation from a point source (trickling) on oxygen flux and on root extension in the soil[J]. Plant and Soil, 1979, 52(4): 507-514.
[3] Meyer W S, Barrs H D, Smith R, et al. Effect of irrigation on soil oxygen status and root and shoot growth of wheat in a clay soil[J]. Australian Journal of Agricultural Research, 1985, 36(2): 171-185.
[4] Mukhtar S, Baker J K, Kanwar R S. Effect of short-term flooding and drainage on soil oxygenation[J]. Transactions of the ASAE, 1996, 39(3): 915-920.
[5] Bhattarai S P, Huber S, Midmore D J. Aerated subsurface irrigation water gives growth and yield benefits to zucchini, vegetable soybean and cotton in heavy clay soils[J]. Annals of Applied Biology, 2015, 144(3):285-298.
[6] 雷宏军,杨宏光,冯凯,等. 循环曝气灌溉条件下小白菜生长及水分与养分利用[J]. 灌溉排水学报,2017,36(11):13-18. Lei Hongjun, Yang Hongguang, Feng Kai, et al. Impact of continuous aerating irrigation on growth, water use efficiency and nutrient uptake of pak choi growing in different soils[J]. Journal of Irrigation and Drainage, 2017, 36(11): 13-18. (in Chinese with English abstract)
[7] 雷宏军,冯凯,张振华,等. 河南3种典型土壤曝气滴灌草莓生长与品质[J].排灌机械工程学报,2017,35(2):158-164. Lei Hongjun, Feng Kai, Zhang Zhenhua, et al. Growth and quality of potted strawberry under aerated drip irrigation in the three typical soils in Henan Province[J]. Journal of Drainage and Irrigation Machinery Engineering, 2017, 35(2): 158-164. (in Chinese with English abstract)
[8] Sojka R E, Lehrsch G A, Kostka S J, et al. Soil water measurements relevant to agronomic and environmental functions of chemically treated soil[J]. Journal of ASTM International, 2009, 6(1): 1-19.
[9] Zou C, Penfold C, Sands R, et al. Effects of soil air-filled porosity, soil matric potential and soil strength on primary root growth of radiata pine seedlings[J]. Plant & Soil, 2001, 236(1): 105-115.
[10] 史春余,王振林,余松烈. 土壤通气性对甘薯产量的影响及其生理机制[J]. 中国农业科学,2001,34(2):173-178. Shi Chunyu, Wang Zhenlin, Shi Songlie. Effects of soil aeration on sweet potato yield and its physiological mechanism[J]. Scientia Agricultura Sinica, 2001, 34(2):173-178. (in Chinese with English abstract)
[11] 朱艳,蔡焕杰,宋利兵,等. 加气灌溉改善温室番茄根区土壤通气性[J]. 农业工程学报,2017,33(21):163-172. Zhu Yan, Cai Huanjie, Song Libing, et al. Oxygation improving soil aeration around tomato root zone in greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(21): 163-172. (in Chinese with English abstract)
[12] Kirkham M B. Chapter 12-Oxygen diffusion rate [M]// Principles of Soil and Plant Water Relations. Burlington: Academic Press. 2014: 185-200.
[13] Lemon E R, Erickson A E. The measurement of oxygen diffusion in the soil with a platinum microelectrode[J]. Soil Science Society of America Journal, 1952, 16(2): 160-163.
[14] Wolińska A, Stpniewska Z. Soil aeration variability as affected by reoxidation[J]. Pedosphere, 2013, 23(2): 236-242.
[15] Feng G, Wu L, Letey J. Evaluating aeration criteria by simultaneous measurement of oxygen diffusion rate and soil-water regime[J]. Soil Science, 2002, 167(8): 495-503.
[16] 雷宏军,臧明,张振华,等. 循环曝气压力与活性剂浓度对滴灌带水气传输的影响[J]. 农业工程学报,2014,30(22):63-69. Lei Hongjun, Zang Ming, Zhang Zhenhua, et al. Impact of working pressure and surfactant concentration on air-water transmission in drip irrigation tape under cycle aeration[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(22): 63-69. (in Chinese with English abstract)
[17] 雷宏军,刘欢,张振华,等. NaCl及生物降解活性剂对曝气灌溉水氧传输特性的影响[J]. 农业工程学报,2017,33(5):96-101 Lei Hongjun, Liu huan, Zhang Zhenhua, et al. Impact of NaCl and biodegradable surfactant on water and oxygen transmission under aerated irrigation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(5): 96-101. (in Chinese with English abstract).
[18] 朱艳,蔡焕杰,宋利兵,等. 加气灌溉对番茄植株生长、产量和果实品质的影响[J]. 农业机械学报,2017,48(8):199-211. Zhu Yan, Cai Huanjie, Song Libing, et al. Impacts of oxygation on plant growth, yield and fruit quality of tomato[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(8):199-211. (in Chinese with English abstract)
[19] 苏志慧,吴兵,龚元石. 不同孔隙度土壤气体扩散系数测定[J]. 农业工程学报,2015,31(15):108-113. Su Zhihui, Wu Bing, Gong Yuanshi. Determination of gas diffusion coefficient in soils with different porosities[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(15): 108-113. (in Chinese with English abstract)
[20] Letey J, Stolzy L H. Measurement of oxygen diffusion rates with the platinum microelectrode. I. Theory and equipment[J]. 1964, 35(20): 545-554.
[21] Meyer W S, Barrs H D. Roots in irrigated clay soils: Measurement techniques and responses to root zone conditions[J]. Irrigation Science, 1991, 12(3): 125-134.
[22] 范爱武,刘伟,李光正. 土壤中热、湿、气及溶质耦合迁移的数学模型[J]. 华中科技大学学报:自然科学版,2005,33(9):59-61. Fan Aiwu, Liu Wei, Li Guangzheng. Modeling for simultaneous transfer of heat, moisture, gas and solute in soil with plants growing[J]. Journal of Huazhong University of Science and Technology: Natural Science Edition, 2005, 33(9): 59-61. (in Chinese with English abstract)
[23] Bhattarai S P, Pendergast L, Midmore D J. Root aeration improves yield and water use efficiency of tomato in heavy clay and saline soils[J]. Scientia Horticulturae, 2006, 108(3): 278-288.
[24] Bohrerova Z, Stralkova R, Podesvova J, et al. The relationship between redox potential and nitrification under different sequences of crop rotations[J]. Soil & Tillage Research, 2004, 77(1): 25-33.
[25] Pett-Ridge J, Firestone M K. Redox fluctuation structures microbial communities in a wet tropical soil.[J]. Applied and Environmental Microbiology, 2005, 71(11): 6998-7007.
[26] Unger I M, Motavalli P P, Muzika R M. Changes in soil chemical properties with flooding: A field laboratory approach[J]. Agriculture Ecosystems & Environment, 2009, 131(1): 105-110.
[27] Lei H, Bhattarai S, Balsys R, et al. Temporal and spatial dimension of dissolved oxygen saturation with fluidic oscillator and Mazzei air injector in soil-less irrigation systems[J]. Irrigation Science, 2016, 34(6): 1-10.
[28] 肖胜生,熊永,段剑,等. 基于组分区分的南方红壤丘陵土壤呼吸对植被类型转换的响应[J]. 农业工程学报,2015,31(14):123-131. Xiao Shengsheng, Xiong Yong, Duan Jian, et al. Responses of soil respiration to vegetation type conversion in south hilly red soil based on main components[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(14): 123-131. (in Chinese with English abstract)
[29] Orchard V A, Cook F J. Relationship between soil respiration and soil moisture[J]. Soil Biology & Biochemistry, 1983, 15(4): 447-453.
[30] 雷宏军,胡世国,潘红卫,等. 土壤通气性与加氧灌溉研究进展[J]. 土壤学报,2017,54(2):297-308. Lei Hongjun, Hu Shiguo, Pan Hongwei, et al. Advancement in research on soil aeration and oxygation[J]. Acta Pedologica Sinica, 2017, 54(2): 297-308. (in Chinese with English abstract)
[31] Bhattarai S P, Midmore D J, Pendergast L. Yield, water-use efficiencies and root distribution of soybean, chickpea and pumpkin under different subsurface drip irrigation depths and oxygation treatments in vertisols[J]. Irrigation Science, 2008, 26(5): 439-450.
[32] Li Yuan, Niu Wenquan, Wang Jingwei, et al. Effects of artificial soil aeration volume and frequency on soil enzyme activity and microbial abundance when cultivating greenhouse tomato[J]. Soil Science Society of America Journal, 2016, 80(5): 1208-1221.
[33] Zhu Lianfeng, Yu Shengmiao, Jin Qianyu. Effects of aerated irrigation on leaf senescence at late growth stage and grain yield of rice[J]. Rice Science, 2012, 19(1): 44-48.
[34] Chen X M, Dhunge J, Bhattarai S P, et al. Impact of oxygation on soil respiration, yield and water use efficiency of three crop species[J]. Journal of Plant Ecology, 2011, 4(4): 236-248.
[35] Sojka R E. Measurement of root porosity (volume of root air space)[J]. Environmental & Experimental Botany, 1988, 28(4): 275-280.
[36] Drew M C. Sensing soil oxygen[J]. Plant Cell & Environment, 2006, 13(7): 681-693.
[37] Pendergast L, Bhattarai S P, Midmore D J. Benefits of oxygation of subsurface drip-irrigation water for cotton in a Vertosol[J]. Crop & Pasture Science, 2013, 64(11): 1171-1181.
[38] 唐燕飞,王国兵,阮宏华. 土壤呼吸对温度的敏感性研究综述[J]. 南京林业大学学报:自然科学版,2008,32(1):124-128. Tang Yanfei, Wang Guobing, Ruan Honghua. A review on the sensitivity of soil respiration to temperature[J]. Journal of Nanjing Forestry University: Natural Sciences Edition, 2008, 32(1): 124-128. (in Chinese with English abstract)
[39] 黄清荣,祁琳,柏新富. 根环境供氧状况对盐胁迫下棉花幼苗光合及离子吸收的影响[J]. 生态学报,2018,38(2):528-536. Huang Qingrong, Qi Lin, Bai Xinfu. Effects of rhizosphere aeration on photosynthesis and ion absorption in cotton seedlings under salt stress[J]. Acta Ecologica Sinica, 2018, 38(2): 528-536. (in Chinese with English abstract)
Aerated subsurface drip irrigation improving soil aeration and tomato growth
Zang Ming, Lei Hongjun※, Pan Hongwei, Liu Huan, Xu Jianxin
(450046,)
Effects of aerated subsurface drip irrigation (ASDI) on yield potential and quality of crop, and relationships between soil aeration, crop yield and fruit quality are less known so far. In order to reveal the relationship between crop growth and soil aeration under ASDI, a pot experiment was conducted using tomato in the Efficiency Agriculture Water Experimental Farm of North China University of Water Resources and Electric Power (34°47′5.91″N, 113°47′20.15″E). Herein, 2 levels of irrigation amount (W1and W2as 0.6 and 1.0 times of the crop-pan coefficient, respectively) and 2 aeration treatments (A and C as ASDI and control treatment, i.e., non-aeration treatment by subsurface drip irrigation) were set up. During the trial, the soil aeration index under a loamy clay soil, such as air-filled porosity, soil dissolved oxygen (DO), oxidation-reduction potential (Eh), oxygen diffusion rate (ODR), soil respiration, photosynthesis index, crop aboveground biomass, root biomass, nutrient uptake, yield and fruit quality were monitored systematically. The correlation analysis was conducted among soil aeration index, photosynthesis index, nutrient uptake efficiency, yield, and fruit quality. Results showed that the ASDI improved the soil aeration. Compared to control treatment groups, the DO in W2A and W1A treatments were increased by 25.71% and 10.64% on the next day after irrigation at flowering and fruit bearing period (<0.05). In W2A and W1A, similarly, the ODR were increased by 52.90% and 32.27% and the Eh were increased by 41.99% and 20.99%, respectively (<0.05). In contrast with the control groups, the soil respiration in W2A and W1A were significantly increased by 64.70% and 28.45% during the flowering and fruit bearing period, 14.17% and 33.24% during the fruit expanding period, 56.91% and 32.86% during the mature period (<0.05). Meanwhile, there were obvious positive correlations between ODR and Eh and DO and air-filled porosity(<0.01). The ASDI had a positive effect on the crop photosynthesis, benefiting the increment in biomass,nutrient uptake and crop quality. Compared to the control groups, the net photosynthetic rate in W2A treatment at flowering and fruit bearing period, fruit expanding period and mature period were increased by 14.51%, 21.72% and 13.76%, respectively (<0.05). The net photosynthetic rate in W1A treatment at fruit expanding period was increased by 55.26% (<0.05). The aboveground fresh weight and root fresh weight significantly increased by 68.14% and 55.18% in W2A treatment, while the aboveground fresh weight and root fresh weight increased by 9.88% and 45.37% in W1A treatment (<0.05). Compared to the control treatment, nitrogen uptake in root, stem and leaf were increased by 52.94%, 42.03% and 24.12%, and phosphorus utilization in root and stem were increased by 74.07% and 36.00%, while the potassium accumulation in root, stem and leaf were increased by 56.52%, 41.09% and 22.44% in W2A treatment (<0.05). Similarly, the crop yield, fruit soluble solids, vitamin C content, total acid content and soluble protein in W2A were increased by 66.40%, 51.77%, 20.26%, 55.26% and 63.64%, respectively (<0.05). The fruit soluble solids, vitamin C content and total acid content in W1A treatment were increased by 43.55%, 29.68% and 71.43%, respectively (<0.05). The ASDI treatment at the irrigation of 1.0 times of the crop-pan coefficient showed the most efficient promotion on soil aeration, crop growth and fruit quality enhancement. There were significantly positive correlations between crop yield and DO, Eh and respiration under ASDI (<0.05). In addition, there were positive correlations between crop quality (soluble solids and total acid content) and soil aeration indexes (DO, ODR and respiration) (<0.05). In sum, these results would provide valuable information for the effect of ASDI on soil aeration, crop yield and fruit quality enhancement.
photosynthesis; biomass; irrigation; soil aeration; crop growth; yield; fruit quality; nutrient uptake
臧 明,雷宏军,潘红卫,刘 欢,徐建新. 增氧地下滴灌改善土壤通气性促进番茄生长[J]. 农业工程学报,2018,34(23):109-118. doi:10.11975/j.issn.1002-6819.2018.23.013 http://www.tcsae.org
Zang Ming, Lei Hongjun, Pan Hongwei, Liu Huan, Xu Jianxin. Aerated subsurface drip irrigation improving soil aeration and tomato growth[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(23): 109-118. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.23.013 http://www.tcsae.org
2018-06-25
2018-10-10
国家自然科学基金(NSFC-河南联合基金,U1504512);河南省科技创新人才项目(174100510021);水资源高效利用与保障工程河南省协同创新中心项目(2013CICWP-HN) ;国家重点研发计划课题(2017YFD0201703);华北水利水电大学博士研究生创新基金
臧明,博士生,主要从事节水灌溉理论与技术研究。 Email:790243068@qq.com
雷宏军,博士,教授,博士生导师,主要从事节水灌溉理论与技术研究。Email:hj_lei2002@163.com
10.11975/j.issn.1002-6819.2018.23.013
S152.5;S275.4
A
1002-6819(2018)-23-0109-10
