异黄绵马酸PB对红色毛癣菌生物被膜的抑制作用观察
2018-11-22刘雪萍林浩琪沈志滨庄素琪王丽丹唐春萍江涛
刘雪萍,林浩琪,沈志滨,庄素琪,王丽丹,唐春萍,2,江涛,2
(1广东药科大学,广州 510006;2广东省局部精准药物递药制剂工程技术研究中心)
以红色毛癣菌为代表的皮肤癣菌为临床常见致病真菌[1,2]。据估计,全球有20%~25%的人感染皮肤癣菌[3]。目前,抗真菌药物面临日益恶化的耐药问题,生物被膜的形成是其耐药的重要原因之一[4]。研究[5~7]发现,白色念珠菌和红色毛癣菌形成生物被膜后对药物敏感性增加2 000倍以上。目前对皮肤癣菌生物被膜及相关抑菌药物的研究较少,现亟需开发新的药物对抗皮肤癣菌的耐药问题。香鳞毛蕨,在民间被广泛用于治疗皮肤病。香鳞毛蕨中的间苯三酚类化合物是该属植物主要成分,也是其产生抗皮肤癣菌作用的主要成分[8, 9]。前期初步研究发现,香鳞毛蕨中异黄绵马酸PB对红色毛癣菌CMCC(F)T1b及石膏样小孢子菌CMCC(F)M2c具有良好的抗癣菌效果[10]。2017年9月~2018年1月,本实验观察了异黄绵马酸PB对红色毛癣菌生物被膜的抑制作用,并从生物被膜形态变化、麦角甾醇的生物合成通路研究其可能作用机制,为其进一步的开发利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 药物 香鳞毛蕨采购自黑龙江省,由哈尔滨商业大学药学院张德连教授鉴定,批号:XLMJ-20171007;异黄绵马酸PB为实验室自制,于香鳞毛蕨中提取分离而得,经高效液相色谱法测定,纯度>98%;盐酸特比萘芬(TBF)购自大连美仑生物技术有限公司,批号M0726A;两性霉素B(AMB,AMRESCO,批号A0414)。
1.1.2 菌种 红色毛癣菌标准株CMCC(F)T1a、CMCC(F)T1d,临床菌PYA1、PYA2,近平滑念珠菌ATCC-22019,均购于中国医学科学院皮肤病研究所(南京)。
1.1.3 试剂 XTT钠盐购自SIGMA-ALDRICH公司,批号SLBS3414V;TRIzol(9109)购自TaKaRa公司;BestarTMqPCR RT kit(2220)购自DBI公司;BestarTMqPCR MasterMix(2043)购自DBI公司;DEPC(6079)购自Macklin公司。
1.1.4 仪器 iMark酶标仪(美国BIO-RAD公司);E-1010离子溅射仪(日本株式会社日立高新科技那珂事业所);S-3400N扫描电镜(日本株式会社日立高新科技那珂事业所);Waters Acquity Uplctm H-Class UPLC超高效液相色谱仪(美国Waters公司);超微量紫外分析仪(Q6000UV)(Quawell Technology);紫外透射分析仪(ZF1-Ⅱ)(上海嘉鹏科技有限公司);核酸电泳仪(DYY-2C)(北京六一仪器);ABI real-time PCR仪(7500)(ABI公司);Stratagene real-time PCR仪(Mx3000P)(Agilent公司);PCR扩增仪(K960)(杭州晶格科学仪器有限公司)。
1.2 异黄绵马酸PB对红色毛癣菌最低抑菌浓度(MIC)及最低杀菌浓度(MFC)的测定 按M38-A2中微量稀释法[11],分别取培养好的各工作菌配制菌悬液,血细胞计数板计数;将异黄绵马酸PB、AMB、TBF溶于DMSO中分别制成32、6.4、0.2 mg/mL的储备液,用RPMI1640培养基稀释50倍至2倍终浓度。在96孔板中分别加入药液和菌液,使菌液终浓度为1×103~3×103CFU/mL,第1~11孔异黄绵马酸PB终浓度依次为320、160、80、40、20、10、5、2.5、1.25、0.625、0 μg/mL,AMB终浓度依次为64、32、16、8、4、2、1、0.5、0.25、0.125、0 μg/mL,TBF终浓度依次为2、1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625、0.007 8、0.003 9、0 μg/mL,即第11、12孔分别为含菌不含药正常对照、仅含培养基空白对照,于35 ℃培养箱中培养96 h,肉眼观察以真菌被100%抑制的最低药物浓度为MIC。以近平滑念珠菌ATCC-22019为质控菌,AMB为质控药,第48 h观察,质控结果MIC在0.5~4.0 μg/mL为合格。从不长菌的孔中每孔取100 μL至含PDA培养基的培养皿上继续培养7~10天,以不长菌的最低药物浓度为MFC。当MIC及MFC能准确重复或只差1个浓度梯度时结果可被接受,否则需重测。以上实验重复3次,取平均值。异黄绵马酸PB对红色毛癣菌的MIC、MFC范围分别在20~40、20~80 μg/mL;AMB对红色毛癣菌的MIC、MFC范围分别为0.5、0.5~1 μg/mL,TBF对红色毛癣菌的MIC、MFC范围分别为0.007 8~0.125 0、0.015 6~0.125 0 μg/mL。结果见表1。AMB对近平滑念珠菌ATCC-22019的MIC为1 μg/mL,在M38-A2标准中规定的0.5~4.0 μg/mL范围内,质量控制合格,提示测试结果可信。
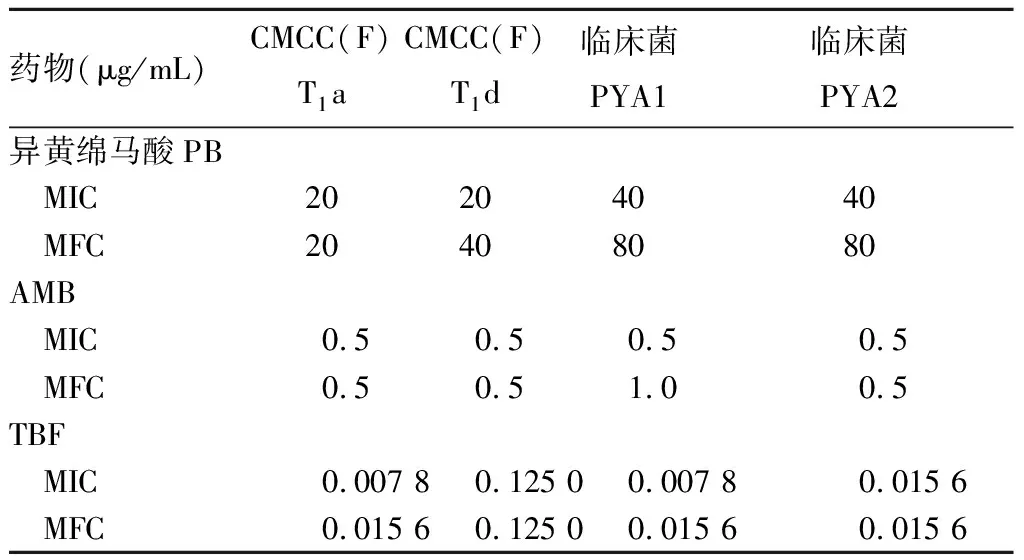
表1 异黄绵马酸PB对红色毛癣菌的MIC、MFC
1.3 红色毛癣菌生物被膜体外模型建立及异黄绵马酸PB对生物被膜最低抑菌浓度(sMIC)测定
1.3.1 生物被膜的建立 用含10%胎牛血清的RPMI1640液体培养基(FR)分别将红色毛癣菌CMCC(F)T1d、PYA1菌悬液稀释成1×106CFU/mL,接种到96孔板1~11列,每孔200 μL,35 ℃温箱中培养6 h,用PBS缓冲液洗去游离菌,加入FR继续培养到96 h至生物被膜成熟。
1.3.2 sMIC50、sMIC80测算 参照微量稀释法并微作调整,在空白96孔板上倍比稀释药物,使1~10列浓度分别为250.00~0.49 μg/mL。各菌株生物被膜成熟后,弃去培养基,加入稀释好的药物,继续培养48 h,加入XTT反应2 h,用酶标仪测定OD490值。与生长对照孔比,抑制50%及80%被膜生长的药物浓度即sMIC50、sMIC80。当sMIC50、sMIC80值能准确重复或只差1个浓度梯度时结果可被接受。实验重复3次,取平均值。
1.4 异黄绵马酸PB对红色毛癣菌生物被膜超微结构的影响观察 采用扫描电镜法。根据“1.3.1”在放有玻璃细胞爬片的6孔板中建立红色毛癣菌CMCC(F)T1d成熟生物被膜,弃去培养基。将生物被膜分为正常组和药物组(异黄绵马酸PB组、AMB组、TBF组)共4组,用FR培养基将异黄绵马酸PB、AMB、TBF分别稀释为125、2、125 μg/mL,分别加入各组成熟生物被膜孔,35 ℃继续培养48 h,用PBS洗去药物及培养基,按文献[6]固定、脱水、镀金,通过扫描电镜观察红色毛癣菌生物被膜的形态。
1.5 异黄绵马酸PB对红色毛癣菌生物被膜中麦角甾醇含量的影响观察
1.5.1 红色毛癣菌生物被膜前处理 根据“1.4”分组制备含药不含爬片生物被膜反应体系,48 h后将生物被膜转移至无菌EP管中。用无菌水冲洗,离心,去掉上清液,滤纸吸去水分。将各组菌团分别转移至10 mL EP中,称量湿菌重,分别加入3 mL新配制的25%氢氧化钾甲醇溶液,80 ℃水浴,冷却后加入2 mL去离子水及3 mL石油醚萃取3次。取醚层于80 ℃水浴挥去石油醚,用甲醇溶解并定容至2 mL,0.22 μm微孔滤膜过滤后低温密闭保存。
1.5.2 红色毛癣菌生物被膜中麦角甾醇含量测定 采用超高效液相色谱法(UPLC)。参考文献[12]并稍作调整进行系统适应性测定,色谱柱:Venusil MP C18(2.1×100 mm,2.5 μm);流动相:100%甲醇溶液;流速:0.50 mL/min;柱温:35 ℃;检测波长:281 nm。各实验组取平行制备而得的3份供试品溶液测定峰面积。样品主峰和其他杂质峰分离度大于1.5,以麦角甾醇浓度为横坐标(x),峰面积为纵坐标(y),绘制标准曲线得回归方程y=6 287x-361.06,r=0.999 7。结果表明,麦角甾醇对照品在4~40 μg/mL范围内线性关系良好;精密度良好,RSD=1.43%。稳定性试验中供试品溶液在24 h内稳定,回收率达99.21%,RSD值为1.37%,回收率良好。由标准曲线可知,生物被膜中麦角甾醇含量与麦角甾醇下降率计算公式如下:生物被膜中麦角甾醇含量(μg/g)=[(峰面积+361.06)×稀释倍数×进样量]/(6 287×湿菌重);麦角甾醇下降率(%)=(正常组生物被膜中麦角甾醇含量-药物组生物被膜中麦角甾醇含量)/正常组生物被膜中麦角甾醇含量×100%。
1.6 红色毛癣菌生物被膜中ERG1、MEP4 mRNA表达检测 采用qRT-PCR法。设置正常组、异黄绵马酸PB组及TBF组3个药物组,根据“1.4”制备含药不含爬片生物被膜反应体系,24 h后用冷PBS清洗,离心后将生物被膜转移至冻存管中,液氮中保存。取适量菌样,加入1 mL的TRIzol研磨,加入氯仿,震荡后离心,取上层水相加入异丙醇,混匀后离心去上清;用75% DEPC乙醇洗涤,离心弃去液体;室温晾干,加入DEPC处理过的ddH2O水,溶解RNA,浓度测定后于-80 ℃冻存备用。以4 μg总RNA为模板,按照Bestar qPCR RT Kit说明书配制逆转录反应体系,总体系为10 μL,合成cDNA第一链(普通逆转体系配制)。合成β-tubulin(内参)、ERG1及MEP4引物,引物序列(5′-3′)β-tubulin F为GCATCTTTTGTTGGCACCGT,β-tubulin R为TACCGGGCTTCAAATGTCCC;ERG1 F为GTGAAGATACCTTTCCCTAGCG,ERG1 R为TTATGGTAGAAACGGCCTTGG;MEP4 F为GCATGGACTTATGCTTGCGG,MEP4 R为TGGATATCTGGGGAAGGCGA。分别加入BestarTMSybrGreen qPCR MasterMix 10 μL、PCR Forward Primer(10 μmol/L)0.5 μL、PCR Reverse Primer(10 μmol/L)0.5 μL、cDNA模板1 μL 、ddH2O 8 μL,形成20 μL的real-time PCR扩增反应体系。反应条件:95 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,72 ℃ 20 s,40个循环。溶解曲线分析:94 ℃ 30 s,65 ℃ 30 s,94 ℃ 30 s。用Agilent Stratagene荧光定量PCR仪Mx3000P进行荧光定量PCR实验。以上操作重复3次,取平均值。采用2-ΔΔCt法计算目的基因的相对表达量。
2 结果
2.1 异黄绵马酸PB对红色毛癣菌生物被膜的抑制作用 异黄绵马酸PB对红色毛癣菌生物被膜sMIC80范围在62.50~125.00 μg/mL,AMB对生物被膜抑制作用下降,TBF对生物被膜的sMIC50、sMIC80均≥250.00 μg/mL,出现严重的耐药现象。结果见表2。
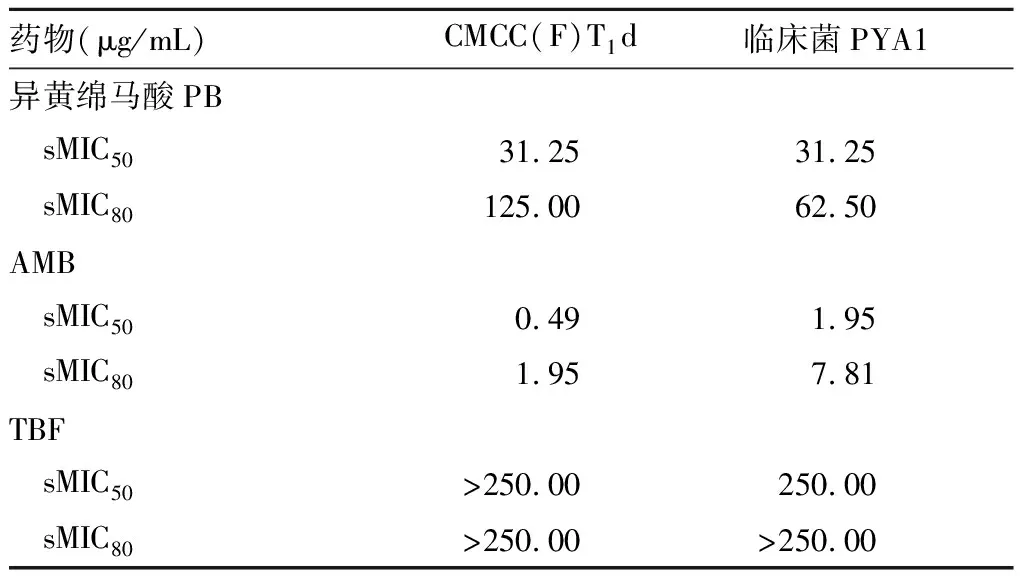
表2 异黄绵马酸PB对红色毛癣菌生物被膜的
2.2 异黄绵马酸PB对红色毛癣菌生物被膜超微结构的影响 扫描电镜观察发现正常组的红色毛癣菌生物被膜生长良好,菌丝充盈且粗细均匀,呈圆柱状,分生孢子形态饱满,菌丝表面有细胞外基质密布,菌丝间有大量呈黏连状的细胞外基质附着。与正常组相比,药物组成熟生物被膜均受到了一定程度的破坏。异黄绵马酸PB组生物被膜生长明显受到抑制,菌丝呈扁平状且出现大量断裂,未见分生孢子,仅有少量干瘪状细胞外基质。AMB组生物被膜紧贴爬片表面,菌丝表面凹凸不平,菌丝多处断裂,细胞外基质皱缩紧贴于菌丝表面。TBF组生物被膜生长被减弱,菌丝干瘪、粗细不均,无孢子,少见细胞外基质。电镜扫描结果见图1。
2.3 异黄绵马酸PB对红色毛癣菌生物被膜中麦角甾醇含量的影响 正常组、异黄绵马酸PB组、AMB组、TBF组红色毛癣菌生物被膜中麦角甾醇含量分别为(3.68±0.05)、(2.36±0.01)、(1.72±0.02)、(2.67±0.01)μg/g,后三组与正常组比较P均<0.01。

注:a为正常组;b为异黄绵马酸PB组;c为AMB组;d为TBF组。
图1扫描电镜下红色毛癣菌生物被膜的超微结构
与正常组相比,异黄绵马酸PB组、AMB组、TBF组对红色毛癣菌生物被膜中麦角甾醇下降百分率分别为35.87%、53.30%、27.40%。
2.4 异黄绵马酸PB对红色毛癣菌生物被膜中ERG1、MEP4 mRNA表达的影响 正常组、异黄绵马酸PB组、TBF组ERG1 mRNA相对表达量分别为1.36±0.03、1.00±0.06、0.41±0.02,MEP4 mRNA相对表达量分别为2.86±0.08、1.00±0.08、1.32±0.02,异黄绵马酸PB组、TBF组与正常组相比P均<0.01。
3 讨论
皮肤癣菌为临床常见致病菌。由皮肤癣菌导致的慢性感染中90%由红色毛癣菌引起[13]。癣菌病存在于浅表皮肤、指甲,且常见于免疫缺陷者[14]及老年患者体内[15],治疗周期长且反复难愈。现有抗菌药物的不合理使用等导致真菌的耐药性增加。在近几年真菌耐药性研究中发现,真菌不只是以浮游菌的状态存在,真菌黏附于载体表面后,以群体形式通过菌丝间相互交错传达信息,释放大量细胞外基质及新生孢子,层层叠加,不断形成更复杂的种群或群落即生物被膜[4]。生物被膜的形成可能是真菌产生耐药性并增加传染性的原因之一,生物被膜高度群体化几乎能对抗所有的抗真菌药物,使药物最低抑菌浓度增加几十倍[16]甚至上万倍[17]。近期研究发现,红色毛癣菌、须癣毛癣菌和犬小孢子菌也可形成生物被膜[6, 7],红色毛癣菌及犬小孢子菌形成生物被膜对抗菌药物TBF耐药性增大千倍以上[6]。针对皮肤癣菌的耐药问题,新药物的开发是重要解决策略。
本实验研究结果显示异黄绵马酸PB对红色毛癣菌游离菌的MIC范围是20~40 μg/mL,MFC范围是20~80 μg/mL,抗菌作用较强。因生物被膜和浮游菌生长状态不同,需对微量稀释法做出调整以测定药物对生物被膜的作用,XTT染色法可通过对药物孔与生长对照孔吸光度值的比较,检测红色毛癣菌生物被膜的代谢活性[7]。将药物对红色毛癣菌浮游菌MIC及对sMIC80比较,阳性药AMB对生物被膜抑菌浓度最大增加7.81倍,TBF对生物被膜抑菌浓度增加上千倍,说明TBF虽然对浮游菌抑菌效果最强,但生物被膜却对其产生严重的耐药现象;而异黄绵马酸PB对生物被膜抑菌浓度最大增加6.25倍,呈现出较好的抗生物被膜作用。
扫描电镜检测发现,相对于正常组红色毛癣菌生物被膜,各药物组生物被膜均受到明显抑制,异黄绵马酸PB组菌丝被抑制,变细变瘪且韧性降低,出现断裂,少见细胞外基质,AMB组三维结构变薄,菌丝不再规则失去条形结构,TBF组菌丝变扁平,无细胞外基质。药物发挥抗红色毛癣菌生物被膜作用时,会抑制生物被膜表面细胞外基质的产生,并可能通过渗透到菌丝中使其中物质泄漏或直接抑制菌丝的正常生长而使菌丝呈现干瘪状[16]。
现有的抗皮肤癣菌药多通过减少菌体中麦角甾醇发挥抗菌作用,AMB通过直接与麦角甾醇结合,TBF通过抑制角鲨烯环氧化酶,最终均使麦角甾醇含量降低。麦角甾醇含量的测定多用UPLC。Komoto等[18]用UPLC测定了红色毛癣菌浮游菌中麦角甾醇的含量。UPLC具有出峰时间短、灵敏度高等优点。本实验借助该方法发现,异黄绵马酸PB作用后生物被膜中麦角甾醇含量显著降低,说明其抗红色毛癣菌生物被膜作用可能是通过抑制癣菌被膜中麦角甾醇的合成,使生物被膜缺乏营养成分及结构形成的必须元素从而抑制被膜生长。
ERG1是角鲨烯环氧化酶形成的必需基因,而角鲨烯环氧化酶是麦角甾醇合成通路中重要的转化酶之一。以TBF为代表的烯丙胺类抗真菌药,可通过抑制鲨烯环氧化酶,并使鲨烯在细胞中蓄积而发挥杀菌作用。本实验结果发现,异黄绵马酸PB及阳性药TBF均抑制了ERG1,说明ERG1可能是异黄绵马酸PB的靶点基因。此外,生物被膜的形成加大了红色毛癣菌的侵袭力,其中MEP作为角蛋白酶的主要组成部分,被认为是皮肤癣菌入侵机体过程中的重要毒力因子和营养因子,以MEP4为代表的基因参与了该酶的合成[19]。本实验发现异黄绵马酸PB及TBF均能显著抑制MEP4的表达,说明MEP4可能也是其作用靶基因之一。sMIC结果显示红色毛癣菌生物被膜对TBF产生了耐药,而ERG1和MEP4 mRNA水平都下降且有统计学差异,说明将药物浓度增加1 000倍后,TBF仍可发挥一定的抑菌效果。
综上,异黄绵马酸PB对红色毛癣菌生物被膜具有较好的抑制效果,明显破坏生物被膜正常形态,并可通过抑制红色毛癣菌生物被膜中基因ERG1抑制麦角甾醇合成、抑制致毒基因MEP4发挥抗菌作用。本实验仅测定了异黄绵马酸PB对4株红色毛癣菌的浮游菌及2株红色毛癣菌的生物被膜的抗菌作用,因菌株之间对药物敏感性的差异,在后续实验中,需扩大菌株数量进一步确认其抗菌谱。生物被膜的耐药涉及到其麦角甾醇合成通路中复杂的酶促反应及基因调控[4],在本研究结果的基础上,仍需深入探讨异黄绵马酸PB抑制红色毛癣菌生物被膜的作用机制。
