基于piggyBac转座子系统的西方蜜蜂Rubia基因转移研究
2018-11-22胡小芬王子龙曾志将何旭江
柯 俐,胡小芬,王子龙,曾志将,何旭江
(江西农业大学蜜蜂研究所,江西南昌330045)
蜜蜂是一种真社会性昆虫,其独特的生物学特性受到广泛关注,是神经生物学、行为学和分子生物学的新兴模式生物[1]。蜜蜂的基因转移及转基因技术是研究蜜蜂生物学的重要手段。目前,精子介导法[2-4]、电穿孔法[5-6]和基因定点编辑法[7]已在蜜蜂中进行了大量试验,但均未获得良好效果。
piggyBac转座子最早发现于在鳞翅目昆虫粉纹夜蛾(Trichoplusiani)中,根据特征性的TTAA 四核苷酸靶位点在基因组上完成切除与转座。其与Minos、Hermes和mariner等其它的DNA转座子不同,piggyBac转座子家族因特异性识别TTAA序列并可以在基因组上自由移动,又被称为跳跃基因[8]。目前,piggyBac转座子在功能基因研究中拥有着强大的优势,具有转座频率高、转座后稳定,特别是物种适用性广泛等优点。该技术作为一种良好的外源基因导入手段,在许多鳞翅目和双翅目昆虫[9-11]中广泛应用。
目前,piggyBac在蜜蜂中的应用相对较少。2014年Schulte等[12]首次在蜜蜂中将piggyBac转座子与转座酶mRNA共注射,成功将外源性基因植入蜜蜂基因组中,并在子代中检测到荧光与插入染色体上位置。本研究基于piggyBac转座子系统,以西方蜜蜂为实验材料,利用显微注射技术将外源性Rubia红色荧光蛋白基因植入西方蜜蜂卵中,并检测其基因整合与荧光表达情况。该研究可为我国今后的蜜蜂转基因技术研究和分子育种技术提供科学理论基础。
1 材料与方法
1.1 实验昆虫
本实验西方蜜蜂(Apismellifera)选自江西农业大学蜜蜂研究所实验蜂场饲养的3群意大利蜜蜂(Apismelliferaligustica)。利用仿生免移虫王浆生产技术[13]获取蜂王产卵2 h内受精卵。
1.2 piggyBac质粒与菌株
感受态细胞Trans5α购自广州全式金公司,质粒pBac[6×P3-rubia]、质粒pBac Transposase,由德国Martin Beye实验室馈赠。
1.3 主要试剂药品
限制性内切酶EcoRI,2 kb、10 kb DNA marker购自大连Takara公司;质粒提取试剂盒Endofree Plasmid Midi Kit 50 preps购于康为世纪生物科技有限公司;OMEGA DNA提取试剂盒购自南昌赛尔生物公司;mMESSAGE mMACHINE®RNA转录试剂盒, MEGAclearTM回收试剂盒购自上海拜力生物科技公司。
1.4 显微注射与实验室培养
1.4.1 显微注射针 购自eppendorf公司,直径2~5 μm,针尖角度37°,长度5.1 cm,密封保存。
1.4.2 注射液体 质粒经质粒提取试剂盒提取,保存于-20 ℃,在注射前取至室温10 min;转座酶mRNA经转录试剂盒体外转录,保存于-80 ℃,在注射前取至室温10 min待用。
1.4.3 蜜蜂卵的准备 利用仿生免移虫产卵器[13]控王2 h,获得约80粒卵供下一步试验所用。
1.4.4 意蜂卵的显微注射 将卵与上样显微注射针分别调试在倒置显微镜视野的中央。转座子piggyBac质粒的浓度为20 μL/ng。调节注射压力在660 hPa,确认出液后备用,调整卵的角度至与针尖70°~90°。令显微注射针从蜜蜂卵的尾端1/3注入,停留1~2 s,看到蜂卵中出现液滴,移出针端。将注射后受精卵移至35 ℃,相对湿度75%的培养箱内的盒子中培养。
1.4.5 蜜蜂卵的实验室培养 蜜蜂幼虫饲料配方参照Vandenberg等[14]的方法,体外培养方法参照王倩等[15]的方法。
1.5 piggyBac质粒的提取与酶切
将菌株扩大培养后按照质粒提取试剂盒说明书提取转座质粒piggyBac,用限制性内切酶EcoRI进行酶切2 h,接着进行凝胶电泳,紫外成像观察。

表1 本研究用到的引物
1.6 转piggyBac蜜蜂的分子生物学方法鉴定
提取蜜蜂基因组总DNA。使用Primer primer 5.0软件设计引物两对,并由生工技术有限公司合成,分别为Rubia-F/r阳性引物与EA-piggy-fw/ piggy-out-rev阴性引物。piggyBac转座子在生物体内会在BacR、BacL两侧进行选择性剪切形成两个活性臂,并插入染色体中。阴性引物位于BacR活性臂两侧,该对阴性引物参考自Christina Schulte的文章[12]。目的产物胶回收产物送往生工生物工程(上海)股份有限公司进行测序。
1.7 荧光显微镜检测
将蛹期蜜蜂置于QLYMPUS-DP80荧光显微镜观察结果。由于红色荧光蛋白的6×P3启动子在神经系统中特异表达,本实验选择神经系统较发达的头部进行观察。
1.8 PCR体外扩增与基因序列测序
将显微注射卵培养至蛹期。当蜜蜂蛹眼睛发育成熟并未出现颜色时,取其头部与腹部进行总DNA提取,并用上述引物进行PCR扩增。扩增反应体系为25 μL,其中2×TaqMaster Mix 12.5 μL,2 μL模板DNA,上下游引物各1 μL,dd H2O补至终体积,94 ℃预变性2 min,30个循环(94 ℃变性,30 s;56.7 ℃退火,45 s;72 ℃延伸,90 s),72 ℃再延伸10 min。电泳后切胶回收。送至生工生物工程股份有限公司进行基因测序。
2 结果与分析
2.1 转座质粒连接后构建
连接后的重组质粒长度为8 777 bp,用酶切的方法鉴定piggyBac载体,用EcoRI限制酶酶切后在Marker 3 900 bp和4 800 bp附近或得两条目的条带(图1-A,2泳道),与预期的剪切结果一致。
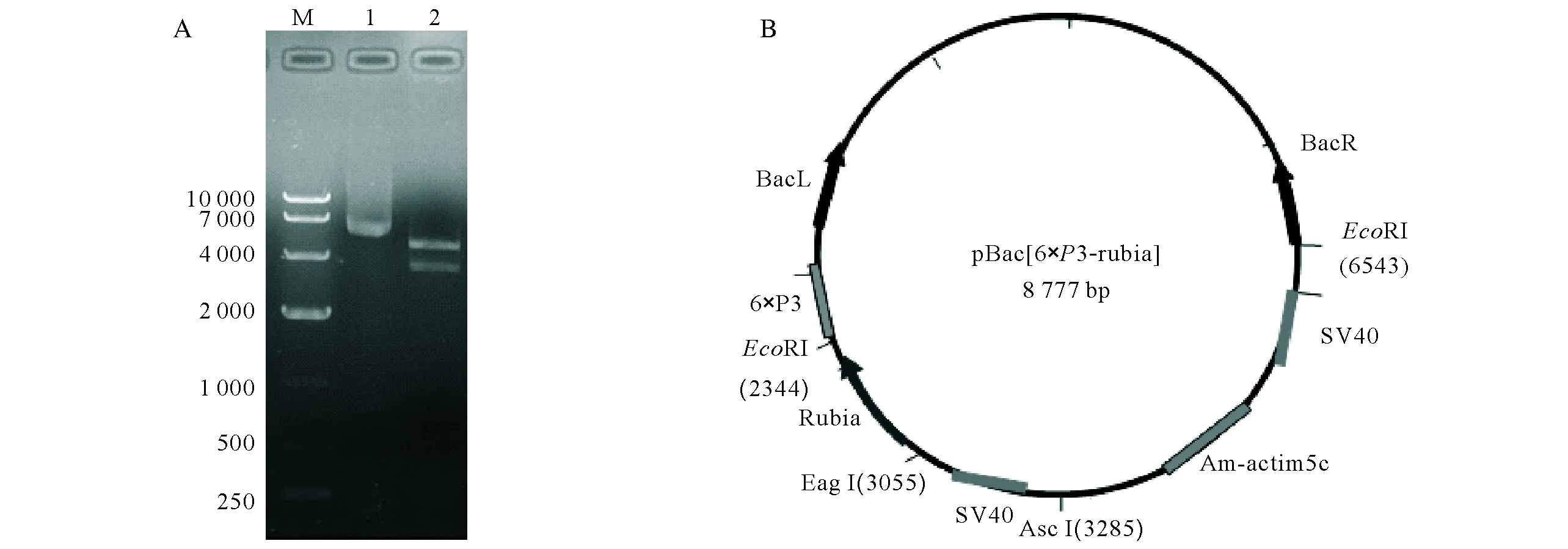
A,M:DNA Marker 10 000,1:pBac[6×P3-rubia]质粒;2:EcoRI酶切;B,pBac[6×P3-rubia]重组质粒图谱,BacR、BacL:piggyBac转座子的反向末端重复序列,6×P3:6个重复 Pax6 元件基因的核心启动子;SV40,SV40多聚位点;Am-actin5c启动子:蜜蜂actin5c基因的上游翻译起始位点启动子;rubia:编码红色荧光蛋白的报告基因A,M:DNA Marker 10 000;1:pBac[6×P3-rubia] plasmid;2:EcoRI digestion;B,pBac[6×P3-rubia] recombinant plasmid map,BacR,BacL:piggyBac transposon inverted terminal repeats,6 × P3:core promoter of six repeat Pax6 element genes;SV40,SV40 polyadenylation sites;Am-actin5c promoter:upstream translation initiation promoter of honeybee actin5c gene;rubia:reporter genes encoding red and fluorescent proteins图1 pBac[6×P3-rubia]重组质粒的酶切分析及图谱Fig.1 Restriction analysis and mapping of recombinant plasmid pBac[6×P3-rubia]
2.2 蜜蜂培养数据
显微注射232粒卵,在恒温恒湿培养箱中室内培养,平均孵化率达13.4%,成蛹率达7.3%(表2)。
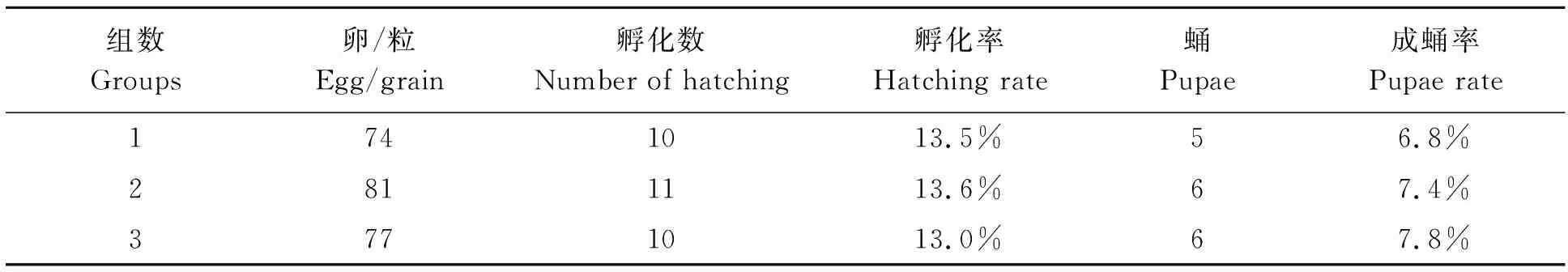
表2 注射转座子质粒与转座酶mRNA培养数据

M:DL 2000;1:注射piggyBac转座质粒后意大利蜜蜂DNA引物阳性克隆;2:注射piggyBac转座质粒后意大利蜜蜂DNA阴性引物对照;3:野生型意大利蜜蜂M:DL 2000;1:Positive clone of Apis mellifera ligustica honeybee DNA primer after piggyBac transposing plasmid injection;2:Apis mellifera ligustica honeybee DNA negative primer control after piggyBac transposing plasmid injection;3:Wild-type Apis mellifera ligustica honeybee DNA图2 转座子质粒Rubia基因PCR分析Fig.2 Transposon plasmid Rubia gene PCR analysis
2.3 转piggyBac蜜蜂表达鉴定
通过琼脂糖凝胶电泳,获得特异性的Rubia目的产物(图2),产物条带大小与预期目的片段大小基本一致。
2.4 荧光显微镜观察
荧光显微镜检测17只显微注射蜜蜂蜂蛹,结果表明:显微注射实验组蜜蜂头部的吻与复眼有微弱的红色荧光信号,而对照组无明显红色荧光信号,表明Rubia红色荧光蛋白可在注射组蜜蜂蛹中进行微量表达(图3)。
2.5 测序结果
回收产物进行测序,并在NCBI的blast进行比对。结果表明:目的条带的基因序列与piggyBac转座子质粒中Rubia基因原始基因序列配比率为81.23%(图4),序列基本一致。

A、B分别为注射piggyBac质粒后蜜蜂头部与野生型蜜蜂头部对照组的红色荧光照片A and B indicates the red fluorescence photos of the honeybee head with piggyBac plasmid injection and the wild type bee head control group,respectively图3 荧光在蜜蜂头部中的表达观察Fig.3 Fluorescent expression observation in honeybee
3 讨论
本实验通过在西方蜜蜂早期胚胎卵中注射piggyBac转座子和转座酶mRNA,研究了Rubia外源基因在蜜蜂受精卵中的转移与表达。本研究显微注射后的平均孵化率达13.4%,成蛹率达7.3%,与前人结果相近[16]。表明显微注射piggyBac转座子系统与幼虫人工体外培养技术具有良好的操作性和成功率。通过荧光显微镜观察,在注射组蜜蜂蛹头部出现部分红色荧光信号,而未在对照组发现信号。同时,PCR扩增也检测到了蜜蜂头胸部中外源基因Rubia片段。这一结果表明piggyBac转座系统可以将红色荧光蛋白Rubia转移入蜜蜂DNA,并进行微弱表达。
6×P3启动子已经成功在黑腹果蝇[17],赤拟谷盗[18],异色瓢虫[19],蝴蝶[20]等的基因转移研究中应用,在眼睛以及神经系统发育过程中至关重要[21]。目前还没有蜜蜂特异性启动子的报道。因此本实验选用6×P3启动子,但结果基因转移效率偏低,可能该启动子在西方蜜蜂细胞中启动活性较弱有关。另外,不同的启动子如Am-actin5c,elp2l,Am-hsp83 ,Am-hsp70,6×P3等在不同的时期与组织特异性表达。若能够选择构造出西方蜜蜂强表达特异性启动子,外源基因在西方蜜蜂中的表达将会显著提高。
荧光蛋白标记技术在分子实验中应用广泛。本实验中选用的是Rubia红色荧光蛋白,近年来用作果蝇[22],家蚕[23],斯氏按蚊[24]等昆虫转基因标记中。本实验中的阳性表达率与前人研究比较接近[25],

图4 PCR扩增产物测序与转座子piggyBac中Rubia基因序列比对结果Fig.4 Comparison of PCR amplification products Sequencing and Rubia gene sequences in piggyBac transposon
但荧光表达比较弱。这可能与显微注射过程中转座事件的发生概率较低有关。此外,蜜蜂受精卵从蜂王生殖腺脱离后就开始快速激烈的卵裂、活化和分化等不同发育过程[26]。本研究选取蜂王产卵2 h内的受精卵进行显微注射,可能受精卵已处于卵裂和分化等胚胎发育过程,影响了piggyBac转座系统的基因转移效率。实验组中幼虫的成活率比自然蜂群低,且孵化时间会延长。可能注射过程对受精卵有损伤效应,且外源基因Rubia对蜜蜂卵的孵化和幼虫发育也会造成一定影响。
蜜蜂是真社会昆虫,也是重要的经济昆虫。其社会分工、级型分化、单双倍体性别决定机制和工蜂监督等的生物学特性受到了广泛关注。piggyBac转座技术在蜜蜂独特生物学的研究中具有良好的应用前景,也为蜜蜂分子育种提供了良好的技术手段。本研究利用piggyBac转座系统成功将Rubia蛋白成功转移至蜜蜂受精卵中。虽然转移效率偏低,且仅形成了嵌合体蜜蜂个体,但随着该技术不断的改进与突破,必将广泛应用到在今后的蜜蜂分子生物学研究与分子育种生产实践中。
