水分胁迫对桃叶杜鹃菌根苗根系超微结构的影响
2018-11-22熊贤荣欧阳嘉晖龙海燕
熊贤荣,欧阳嘉晖,龙海燕,熊 丹,欧 静
(贵州大学林学院,贵州贵阳550025)
桃叶杜鹃(RhododendronannaeFranch.)是杜鹃花科杜鹃花属常绿灌木,为高山常绿杜鹃代表种[1],其花艳丽夺目,叶形美观,树冠圆满,花期5—6月,是一种观赏价值高、开发潜力大的园林树种,但其喜凉爽湿润气候,且根系为浅根系,不能伸入土层深处,不耐干旱,严重制约其引种栽培及园林应用。菌根(Mycorrhiza)是一类土壤真菌与高等植物根系形成的共生体系,其在自然生态系统中广泛存在[2],能够促进根系对水分的吸收,防止根系内水分的丧失,改善寄主植物的水分状况,提高植物的抗旱性[3]。
干旱影响植物生产发育的主要非生物胁迫之一,其对植物生长的影响直接体现在植物叶片失水,细胞膜遭到破坏,严重时破坏细胞器结构,加速其衰老进程,最终导致植物死亡[4]。目前对于干旱胁迫下接种菌根对植物根系的研究主要集中在植物根系形态解剖结构方面,如王如岩等[3]发现接种内生菌根能促进楸树根系形态发展,在正常水分和中度干旱条件下内生菌根真菌对楸树生长有一定的促进作用。张亚敏等[5]通过对小马鞍羊蹄甲幼苗接种AMF,发现AMF能显著影响幼苗根系形态特征和结构特征,更利于植物适应干旱环境。在自然环境条件下,杜鹃属植物根系能与一些土壤真菌形成典型特征的共生体,称为杜鹃花类菌根或欧石南类菌根(Ericoidmycorrhizal,ERM)[6],在杜鹃花类植物的生长发育中扮演着重要角色,它能促进植物生长,对植物克服恶劣环境、加强吸收养分起到很重要的作用[7-8],能增强宿主植物的竞争力和抗逆性[9],有研究证明ERM可以增强宿主抗旱性[10]。在超微结构方面,菌根的形成对寄主质膜及细胞骨架结构有一定的影响,而且菌根的形成会影响寄主质膜及细胞骨架结构从而影响细胞内的液泡、线粒体、细胞核等细胞器[11-12]。而关于干旱胁迫下菌根对植物细胞超微结构方面的研究还未见报道, 桃叶杜鹃的根系由大量细弱如发的须根组成,由1层表皮细胞、1~2层皮层细胞和中柱组成,本实验材料为1年生桃叶杜鹃幼苗,进行干旱胁迫处理,通过观察根系中柱细胞超微结构的变化,分析接种ERM真菌对桃叶杜鹃幼苗抗旱性影响,从而阐明接种菌根对植株抗旱性的作用效果。
1 材料与方法
1.1 试验地概况
试验在贵州大学南校区林学院苗圃进行,属于亚热带湿润温和型气候,年平均气温在15.3 ℃左右,海拔1 100 m。
1.2 供试菌株
供试的2个试验菌株为前期从野生桃叶杜鹃根系分离并筛选出的综合促生能力和侵染率较强的菌株[13-14]:TY29(AB158314:Trametesochracea),TY35(AB378554:Pochonia bulbill-osa)(括号中前者为国际GenBank中的登录号,后者为与试验菌株亲缘关系最近种),由课题组分离保存。采用PDA液体培养基对试验菌株进行培养,置于28 ℃摇床上振荡(160 r/min)暗培养15 d,打碎并制成液体菌剂备用。
1.3 试验苗木
试验苗为通过播种繁殖培养的1年生桃叶杜鹃幼苗,采用播种繁殖,播种方法采用撒播,100粒每盆,于2015年12月播种后放入人工气候箱内恒温培养(白天、夜间都为25 ℃,湿度为90%、光照12 h),2016年6月12日移栽到花盆中,每盆移植1株桃叶杜鹃幼苗,移栽成活后于每株苗根部各施入菌液5 mL,CK苗则做不浇菌液处理。同一个处理随机摆放,各处理之间相互隔离,进行常规育苗方法管理。栽植花盆规格为90 cm×60 cm×80 cm(口径×地径×高),土壤基质为腐殖土和石英砂按3∶1比例混合。
1.4 干旱胁迫处理
2016年8月选取生长一致的植株进行胁迫处理,每个处理15盆,每盆1株,各处理重复3次。用随机区组试验设计,因素A为接菌处理,设3个处理,分别是:TY29、TY35和对照CK;因素B为干旱胁迫处理,设4个胁迫梯度,按正常浇水(土壤含水率80%~90%,作为干旱胁迫的对照) 、轻度干旱(土壤含水率65%~75%) 、中度干旱(土壤含水率50%~60%)和重度干旱(土壤含水率35%~45%)进行处理。每天下午通过称重法维持土壤相对含水量保持在试验设计范围内,其他管理一致,每天傍晚补足白天损失的水分,连续处理30 d后测定各指标。
1.5 样品的制备观察与测定
(1)取材与固定:水分胁迫30 d后,取幼苗相同部位须根根尖2 mm左右的小段,将样品放入浓度为2.5%的戊二醛溶液中,在4 ℃条件下固定24 h以上。
(2)制片与观察:将样品取出,用pH为7.2的磷酸缓冲溶液漂洗3次,每次25 min,再经过30%、50%、70%、80%、90%和100%的乙醇脱水,每级停留30 min,然后用环氧丙烷置换过渡,Epon812渗透包埋,经超薄切片机切片后,用醋酸双氧铀和柠檬酸铅对染,最后置于Hu212A透射电镜下观测须根根尖中柱细胞并拍照(桃叶杜鹃细胞超微结构制片与拍照均在上海交通大学分析测试中心进行)。
(3)指标测定:2016年8月对菌根侵率进行测定,植株收获时菌根侵染率按Phillips[15]方法测定,涉及到的计算公式如下:
菌根侵染率=(菌根侵染的根段数/检测的根段总数)×100%
(1)
菌根依赖性=(接种植株平均干质量/对照植株平均干质量) ×100%
(2)
菌根贡献率=(接种植株平均干质量-不接种植株平均干质量)/接种植株平均干质量×100%
(3)
2 结果与分析
2.1 菌根侵染率
两种ERM菌株的侵染率存在差异,其中TY35的侵染率比TY29的侵染率要高,未接种的CK处理幼苗根系侵染率为0,极显著低于接种处理幼苗根系的侵染率。不同菌株对宿主植物根系表现出的亲和力具有差异性,即反映出了宿主植物对不同菌根真菌的依赖性不同。接种苗的菌根依赖性均大于100%,TY35达到147.89%,菌根贡献率为32.38%。TY29菌根依赖性达到118.23%,菌根贡献率为13.65%。
2.2 正常水分条件下的根细胞超微结构
正常水分条件下,桃叶杜鹃各处理幼苗的须根中柱细胞结构相同,细胞完整,膜清晰,紧贴细胞壁,细胞呈梯形或近长方形,细胞器丰富,各细胞器的超微结构均呈正常状态,位于细胞边缘,液泡较大,位于细胞中央(图1 a1、b1、c1)。桃叶杜鹃的线粒体呈圆形或椭圆形,双层膜清晰可见,内嵴丰富,着色较深。此外,正常的细胞内还分布着由数个扁平囊泡垛叠而成的高尔基体(图1 a2、b2、c2)。
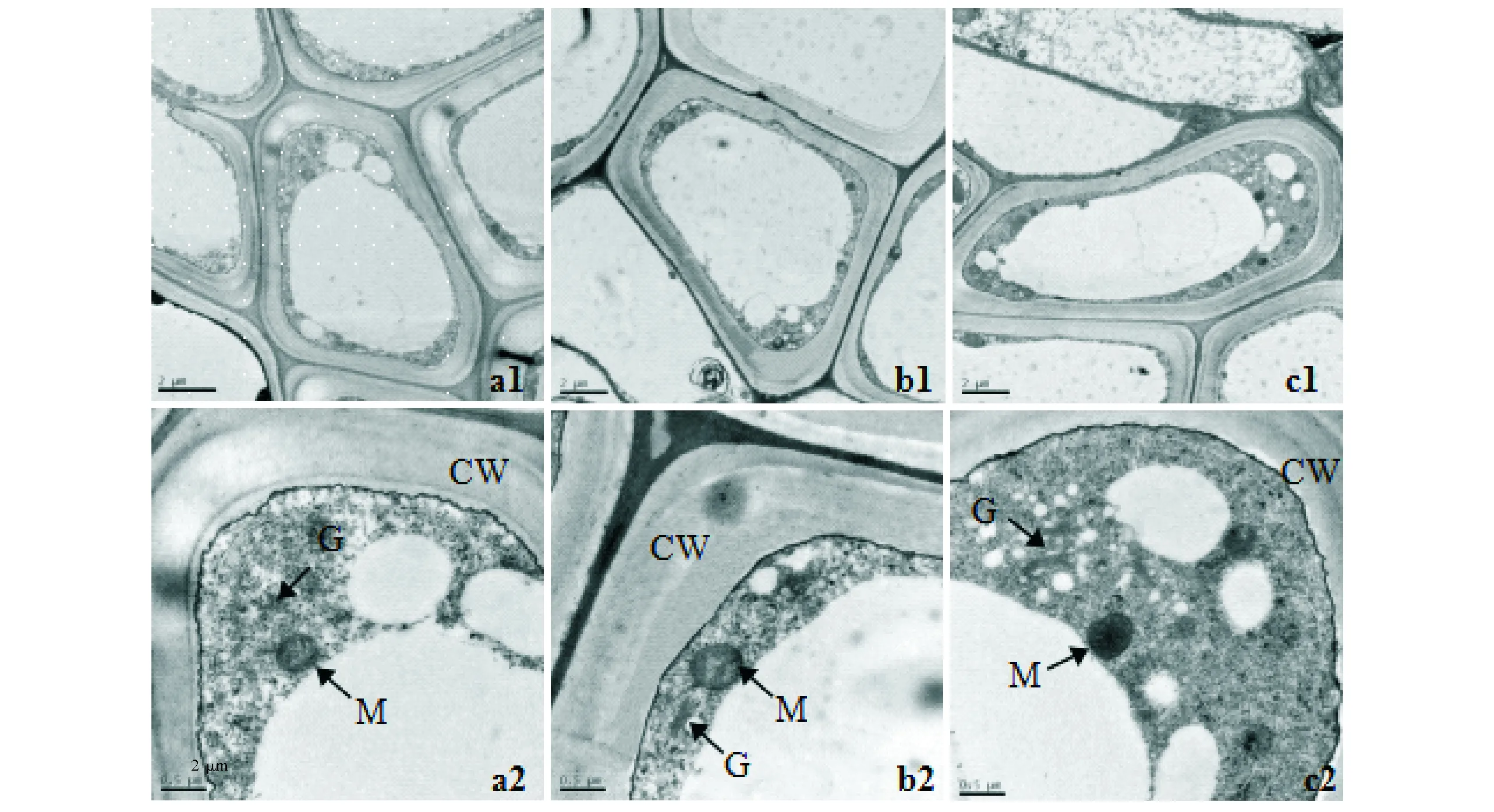
a1,a2为CK根细胞与线粒体;b1,b2为TY29根细胞与线粒体;c1,c2为TY35根细胞与线粒体;CW:细胞壁;M:线粒体;G:高尔基体;放大倍数:a1×6 000;a2×20 000;b1×5 000;b2×20 000;c1×5 000;c2×20 000a1,a2:CK root cells and mitochondrial;b1,b2:TY29 root cells and mitochondrial;c1,c2:TY35 root cells and mitochondrial;CW:cell wall;M:mitochondria;G:golgi;Magnification:a1×6 000;a2×20 000;b1×5 000;b2×20 000;c1×5 000;c2×20 000图1 正常水分条件下桃叶杜鹃幼苗根细胞超微结构Fig.1 Ultrastructure of root cells of Rhododendron annae seedlings under normal water conditions
2.3 轻度胁迫条件下的根细胞超微结构
轻度胁迫下,CK的须根中柱结构发生了变化,细胞膜结构受到一定的破坏,液泡内陷成许多小泡散布在细胞内部,多数细胞器开始向细胞中央聚拢(图2 d1)。线粒体增多,且体积变得膨胀,外膜结构消失,内部嵴开始出现断裂,片层结构紊乱,细胞中未见高尔基体的分布(图2 d2)。TY29局部细胞膜破裂,中央液泡也开始破裂,细胞内容物都在降解,但程度较轻,各细胞器没有贴壁分布(图2 e1)。线粒体外膜结构变得模糊,内部嵴减少,出现较多的嗜锇颗粒(图2 e2)。TY35的细胞未出现变形,细胞膜局部破损,但内部细胞质基本正常(图2 f1)。线粒体增多,双膜结构明显,内部嵴丰富,形态正常,高尔基体结构变得模糊,细胞内还出现了较多的淀粉粒(图2 f2)。
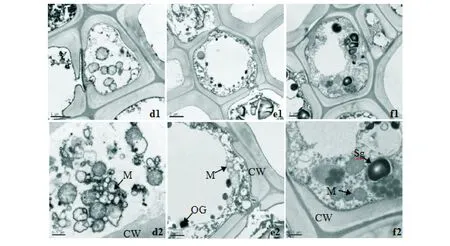
d1,d2:CK根细胞与线粒体;e1,e2:TY29根细胞与线粒体;f1,f2:TY35根细胞与线粒体;CW:细胞壁;M:线粒体;Sg:淀粉粒;OG:嗜锇颗粒;放大倍数:d1×10 000;d2×20 000;e1×5 000;e2×10 000;f1×8 000;f2×20 000d1,d2:CK root cells and mitochondrial;e1,e2:TY29 root cells and mitochondrial;f1,f2:TY35 root cells and mitochondrial;CW:cell wall;M:mitochondria;Sg:starch granules;OG:Osmium granule;Magnification:d1×10 000;d2×20 000;e1×5 000;e2×10 000;f1×8 000;f2×20 000图2 轻度胁迫条件下的桃叶杜鹃幼苗根细胞超微结构Fig.2 Ultrastructure of root cells of Rhododendron annae seedlings under mild stress
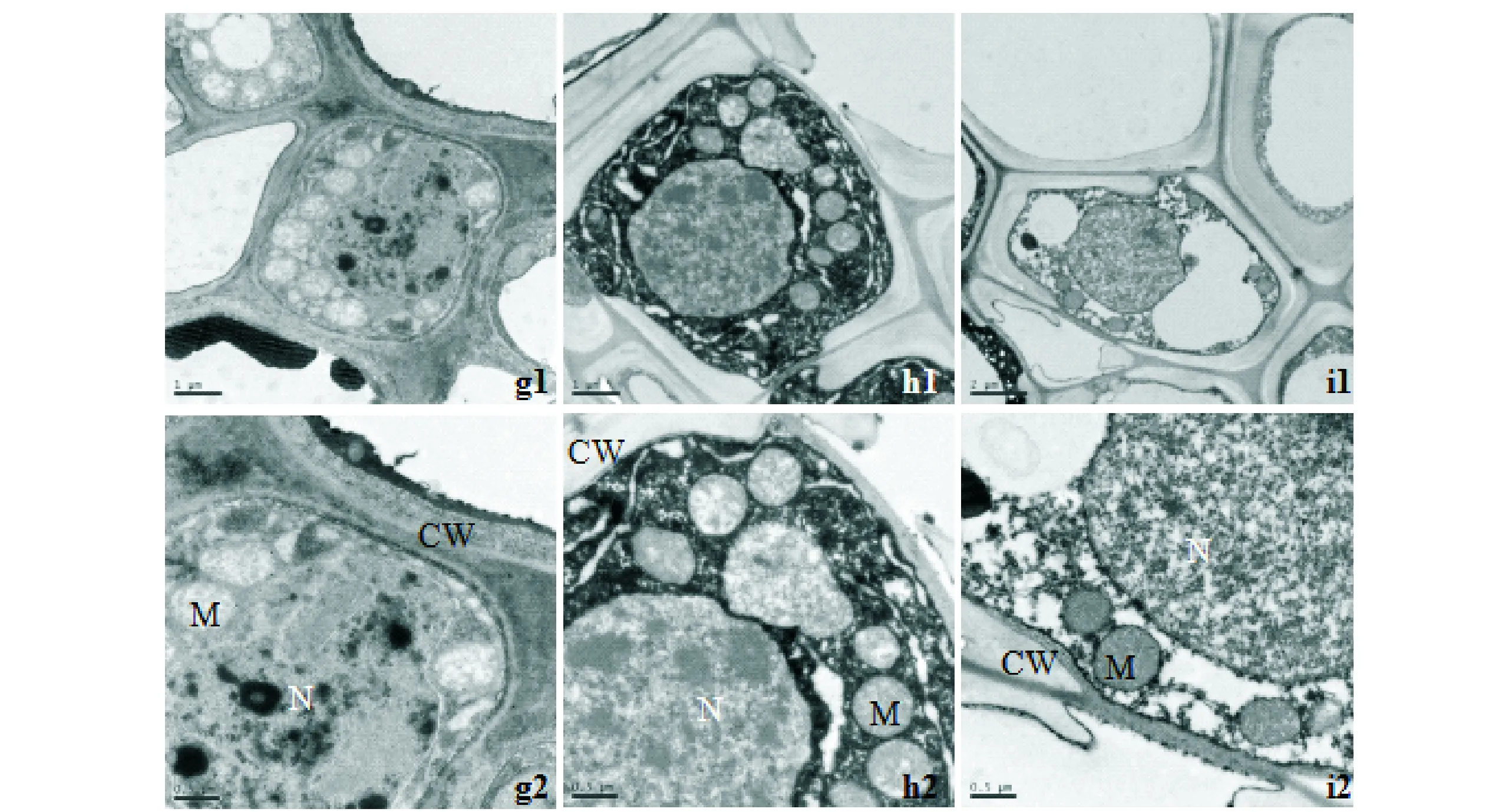
g1,g2:CK根细胞与线粒体;h1,h2:TY29根细胞与线粒体;i1,i2:TY35根细胞与线粒体;CW:细胞壁;M:线粒体;N:细胞核;放大倍数:g1×10 000;g2×20 000;h1×10 000;h2×20 000;i1×6 000;i2×20 000g1,g2:CK root cells and mitochondrial;h1,h2:TY29 root cells and mitochondrial;i1,i2:TY35 root cells and mitochondrial;CW:cell wall;M:mitochondrial;N:nuclear;Magnification:g1×10 000;g2×20 000;h1×10 000;h2×20 000;i1×6 000;i2×20 000图3 中度胁迫条件下的桃叶杜鹃幼苗根细胞超微结构Fig.3 Ultrastructure of root cells of Rhododendron annae seedlings under moderate stress
2.4 中度胁迫条件下的根细胞超微结构
随着胁迫加剧,各处理苗的细胞结构变化愈加明显,受伤害程度进一步加深。CK根细胞形态因失水变得收缩扭曲,细胞膜结构消失,细胞器结构遭到严重破坏,内含物流出,细胞核严重变形,核膜降解,细胞内染色质凝聚,细胞核降解为小碎片散布在细胞内部(图3 g1)。线粒体体积进一步膨大,内部结构降解(图3 g2)。TY29的根细胞变化程度小于CK,细胞轻微变形,膜破损,细胞内部基质凝聚成深色物质,细胞核外膜存在,但内部结构已经开始降解,与线粒体仍能较好的区分开来(图3 h1)。线粒体外膜消失,内部结构模糊(图3 h2)。TY35细胞膜开始降解,根细胞内部结构受到的伤害最小,细胞内部各细胞器能明显区分,仍可见液泡结构,细胞核核膜完好,细胞核内部染色质开始凝聚,核仁开始降解(图3 i1)。线粒体的外膜结构完好,内部嵴出现断裂,片层结构紊乱(图3 i2)。
2.5 重度胁迫条件下的根细胞超微结构
重度胁迫下,干旱处理对各幼苗根细胞的伤害进一步加深。CK的根细胞结构完全被破坏,细胞质、细胞器解体,细胞空泡化,仅留下一些细胞器的残骸(图4 j1、j2)。TY29的细胞壁出现断裂,细胞内部细胞器也大量降解,仅存少部分残存的线粒体,线粒体的内部结构也已经降解,内腔出现空洞(图4 k1、k2)。TY35的根细胞整体形态较完整,细胞内部基质凝聚成深色物质,细胞核外膜存在,细胞内染色质凝聚(图4 l1)。线粒体外膜仍较完整,嵴断裂严重,内部结构开始降解(图4 l2)。

j1,j2:CK根细胞与线粒体;k1,k2:TY29根细胞与线粒体;l1,l2:TY35根细胞与线粒体;CW:细胞壁;M:线粒体;N:细胞核;放大倍数:j1×10 000;j2×20 000;k1×5 000;k2×20 000;l1×10 000;l2×20 000 j1,j2:CK root cells and mitochondrial;k1,k2:TY29 root cells and mitochondrial;l1,l2:TY35 root cells and mitochondrial;CW:cell wall;M:mitochondrial;N:nuclear;Magnification:j1×10 000;j2×20 000;k1×5 000;k2×20 000;l1×10 000;l2×20 000图4 重度胁迫条件下的桃叶杜鹃幼苗根细胞超微结构Fig.4 Ultrastructure of root cells of Rhododendron annae seedlings under serious stress
3 讨论
菌根真菌能够提高植物的抗旱性,因为菌根真菌在土壤中具有庞大的菌丝网,可增大植物的吸收面积,降低土壤与植物之间的液流阻力,促进根系对水分的吸收,并且菌套还能防止根系内水分的丧失,改善寄主植物的水分状况,能够或减缓植物体内水分缺失的加剧[3],本实验结果从细胞层次验证了这一观点,即接种菌根真菌在各种水分处理下,菌根真菌的形成一定程度上减缓植物体内水分的缺失,使植株受旱害程度减轻,从而保护了植物细胞的完整性。研究还发现,接种不同的菌株对干旱胁迫的响应也不同,原因可能是不同菌株对寄主植物的侵染程度有所不同,或者菌株之间的功能也存在差异。
在相同水分胁迫处理下,桃叶杜鹃根系细胞超微结构发生了不同程度的变化,但随着水分胁迫程度的加强,桃叶杜鹃幼苗表现在细胞结构上的变化过程基本一致,由开始的根系细胞细胞膜破损,液泡膜破裂,类囊体肿胀,线粒体肿胀,基质变稀,脊减少,最终线粒体解体,其他细胞器消失,细胞空泡化。
在干旱胁迫条件下,比较观察3种处理下桃叶杜鹃的线粒体、细胞膜、细胞核等细胞器超微结构的变化规律,是判断其耐旱能力的方法之一。线粒体的形态结构、大小、数目和分布常因植物所处的环境条件不同而发生相应变化,尤其在逆境胁迫下其结构和生理功能的变化更为显著[16]。在本实验中,在轻度干旱胁迫下,3种处理植物根系细胞均开始受损,其中线粒体的损害程度:CK>TY35>TY29,细胞膜损坏程度:CK>TY29>TY35。此外水分胁迫下,淀粉粒很少见到,其原因是由于水分胁迫引起类囊体膜结构异常光合作用下降而导致光合产物减少,抑或因其被降解所致[17],但TY35在轻度干旱胁迫下还能产生较多的淀粉粒,这样既缓解了能量的短缺,保证细胞正常的生命活动。在中度干旱胁迫下,细胞受损程度进一步加深,CK苗外膜结构消失,细胞膜受损程度:TY29>TY35,细胞核受损程度:CK>TY29>TY35,线粒体的损害程度:CK>TY35>TY29,同时3种处理都出现细胞内染色质凝聚,其中CK苗内含物流出,细胞受到极大损害。在重度干旱胁迫下,CK苗细胞整个空泡化,TY29细胞出现小空洞,而TY35细胞结构仍完整。
4 结 论
水分胁迫显著影响桃叶杜鹃幼苗的根系细胞超微结构,接种ERM真菌能在轻度、中度水分胁迫下提高桃叶杜鹃幼苗根系细胞结构稳定性,维持细胞膜、线粒体等细胞器的完整,缓解干旱胁迫对各细胞器的伤害效应。干旱胁迫下桃叶杜鹃幼苗细胞超微结构的伤害表现与抗旱性相关。接种TY29与TY35的幼苗的根系细胞超微结构的受损程度在轻度、中度水分胁迫下均小于菌根苗,但重度胁迫下各处理幼苗细胞结构都受到严重破坏,根据各处理苗细胞器的受损情况来评价各处理苗的耐旱能力,即菌根苗的抗旱性较强。
