嗜酸性粒细胞性胃肠炎儿童胃黏膜血管活性肠肽及其受体表达与嗜酸性粒细胞数量及总IgE水平变化的关系
2018-11-22钱淑怡刘志峰吴润秋
钱淑怡,杨 辉,金 玉,刘志峰,朱 航,吴润秋,练 敏
嗜酸性粒细胞性胃肠炎(eosinophilic gastroenteritis,EG)是以胃肠道组织中嗜酸性粒细胞比例异常升高和浸润为特征的胃肠道疾病,其中胃是EG常累及的器官之一[1]。目前,中国儿童EG的发病率逐渐升高,其病因及发病机制尚不清楚,多数学者认为变态反应、遗传因素、免疫功能异常、营养因素以及药物、食物等原因均参与EG发病[2-4]。EG可发生于任何年龄,其临床表现多样且无特异性[5]。血管活性肠肽(vasoactive intestinal peptide,VIP)为分泌素/胰高血糖素超家族成员,由28个氨基酸残基组成,是一种非胆碱能非肾上腺能神经递质,广泛分布在胃肠黏膜[6],除具有舒张血管的作用以外,还具有抗炎、免疫调节、平滑肌舒张等多种功能,对胃肠道的生理、生化、免疫功能有重要的调节作用。慢性特发性荨麻疹中VIP可作用于血管活性肠肽2(vasoactive intestinal peptide type 2 receptor,VPAC2)而调节肥大细胞(mast cells,MCs)的脱颗粒过程[7]。研究证实哮喘患者采用雾化吸入VIP法可减轻哮喘发作的严重程度,并可一定程度上减轻气道平滑肌的增厚,从而抑制气道重塑[8]。但VIP在EG中的作用目前鲜见报道。本研究拟测定儿童胃黏膜中VIP和VPAC2表达的变化,探讨其与胃黏膜中和外周血嗜酸性粒细胞(eosinophils,EOS)数量及总IgE水平的关系,研究VIP和VPAC2在儿童EG中的作用。
1 对象与方法
1.1 对象
采用前瞻性非随机对照临床研究方法,纳入 2015年7月至2016年8月在南京医科大学附属儿童医院消化专科住院的20例EG患儿作为EG组,其中男16例,女4例,年龄0.44~13.58岁,平均(6.38±4.59)岁。EG纳入标准参照Talley标准[9],有反复腹痛、腹泻、恶心呕吐、便血、腹胀、腹腔积液等临床表现的患儿入院后行外周血EOS测定并计数,并行总免疫球蛋白E(immunoglobulin E,IgE)水平测定以及胃镜检查。选取同期同一年龄段胃镜下病理活检未见异常且EOS<10个/高倍视野、外周血EOS计数及总IgE测定正常的儿童为对照组,同时需排除幽门螺杆菌感染、变应性紫癜、寄生虫感染、自身免疫性疾病、炎症性肠病、结核、真菌感染、功能性胃肠病等。对照组受试者共20例,其中男15例,女5例,年龄1.08~12岁,平均(5.46 ±3.27)岁。EG组与对照组受试者年龄和性别的差异均无统计学意义(t=0.70,P=0.49;χ2=0.14,P=0.70)(表1)。本研究经南京儿童医院伦理委员会审批通过(批件号:201701015)。
1.2 方法
1.2.1 临床资料的收集:询问病史,记录患儿的一般情况(姓名、性别、年龄等)、临床表现、个人或家族成员变态反应史(哮喘、湿疹、变应性鼻炎、食物及药物变态反应史);行外周血EOS计数及总IgE水平测定;与患儿家长沟通,征得家长同意并签署知情同意书后在全身麻醉下行胃镜(OLYMPUS GIF-XQ 260,日本)检查并留取胃窦黏膜组织,对照组儿童活检部位为胃镜下未见明显异常的胃窦部或异常部位旁开5 cm正常胃窦处。取得的标本组织行苏木精-伊红染色和免疫组织化学染色,观察胃黏膜中EOS的数量变化,测定胃黏膜中VIP及VPAC2含量。EOS数量在20~40个/HPF者为轻度升高,40~60个/HPF者为中度升高,>60个/HPF者为重度升高。
1.2.2 石蜡切片的制备:将获得的胃肠黏膜组织标本置于质量分数4%多聚甲醛中固定、脱水,置于体积分数75%乙醇4 h、85%乙醇2 h、90%乙醇2 h、95%乙醇1 h,无水乙醇Ⅰ、Ⅱ中各30 min,二甲苯Ⅰ、Ⅱ 10 min,然后再浸于60℃石蜡中1 h,石蜡包埋。制备4 μm厚切片,60 ℃烘箱内烤片,待水烤干蜡烤化后取出常温保存。
1.2.3 EOS的苏木精-伊红染色:石蜡切片脱蜡至水,依次置于二甲苯Ⅰ、Ⅱ中脱蜡各20 min,按顺序置于梯度乙醇溶液中各5 min,蒸馏水洗3 min。苏木精染液中染核5~10 min,自来水冲洗约10 min。体积分数1%的盐酸乙醇分化数秒,待切片变红、颜色较浅时流水冲洗,质量分数0.6%氨水返蓝,流水冲洗。切片入伊红染液中染色1~3 min,依次放入95%乙醇Ⅰ、Ⅱ中各5 min、无水乙醇Ⅰ、Ⅱ中各5 min及二甲苯Ⅰ、Ⅱ各10 min,稍晾干,中性树脂封片,光学显微镜200倍下任意计数10个视野内胃肠黏膜EOS数量,取平均值,EG组要求EOS>20个/HPF,对照组要求<10个/HPF。
1.2.4 免疫组织化学法测定组织标本中VIP及VPAC2表达:将切片置于烤箱60 ℃烤片30 min使蜡熔化,依次经二甲苯Ⅰ、Ⅱ各20 min,脱蜡。梯度乙醇脱水各5 min,蒸馏水水化3 min,PBS(pH7.4)洗涤3次,每次5 min。组织切片置于枸橼酸抗原修复缓冲液(pH 6.0)中于微波炉内进行抗原修复。自然冷却后PBS洗涤3次,每次5 min。湿化盒内用免疫组化笔圈定切片上的组织,加1滴或50 μl内源性过氧化物酶抑制剂,室温下孵育10 min以阻断内源性过氧化物酶。PBS溶液洗涤3次,每次5 min。滴加山羊非免疫血清,室温封闭30 min。轻轻甩掉封闭液,滴加用一抗稀释液稀释的兔抗人VIP多克隆抗体或兔抗人VPAC2多克隆抗体(美国Abcam公司),切片平放于湿化盒内室温下孵育60 min或4 ℃孵育过夜。PBS洗涤3次,每次5 min。稍甩干后滴加羊抗兔IgG(中国上海碧云天生物技术有限公司),室温下孵育50 min。PBS溶液洗涤3次,每次5 min。滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育30 min,PBS洗涤3次,每次5 min。滴加新鲜配制的DAB显色液,自来水冲洗切片终止显色。苏木素复染,3 min,自来水冲洗返蓝。梯度乙醇各浸泡5 min,二甲苯Ⅰ、Ⅱ各浸泡20 min脱水透明,稍晾干,中性树胶封片。光学显微镜200倍下任意选取3个视野,应用Image-Pro Plus 6.0软件对图片进行判断,得出每张照片吸光度(A)值以及组织的像素面积。
1.3 统计学方法
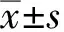
2 结果
2.1 患者一般情况
EG患儿临床主要表现为腹痛者占80%(16/20),其中上中部腹痛者占25%(4/16),其余患者均为全腹痛,EG组患者与对照组受检者腹痛、腹泻、呕吐、腹胀和排便困难的例数比较差异均无统计学意义(P=0.102、0.497、0.465、0.102、0.179);两组受检者大便带血和腹水例数比较差异均有统计学意义(P=0.001,P<0.001)(表1)。
2.2 受检者外周血EOS数目lgE水平的变化
EG患儿外周血EOS绝对值和外周血总Ig E水平较对照组受检者均明显升高,差异均有统计学意义(P<0.05,P<0.000)(表2)。EG组有哮喘、变应性鼻炎或湿疹等病史者占35%(7/20),父母有变态反应史者占30%,分别高于对照组的15%(3/20)和5%(1/20),组间比较差异均有统计学意义(均P<0.01)。对照组受检者外周血EOS% 为0.5%~5.0%、EOS#为0.05~0.5×109/L和总IgE水平为9.31~165.3 U/ml的例数均为0,EG组患者分别占75%(15/20)、75%(15/20)和60%(12/20)。
2.3 两组受检者胃镜下组织变化例数的比较
EG组患者胃镜检查发现黏膜充血水肿、糜烂、溃疡例数和比例明显高于对照组,差异均有统计学意义(均P<0.01)(表3,图1)。对照组未发现胃黏膜结节样隆起或增生者,而EG组4例出现上述改变。
2.4 两组受检者胃窦黏膜中EOS数量的比较
苏木精-伊红染色显示,EG组患者胃窦黏膜EOS数量增多(图2),其中EOS数量为20~40个/HPF者11例,40~60个/HPF者7例,>60个/HPF者2例,平均(42.89±19.47)个/HPF,明明显多于对照组的(7.83±2.32)个/HPF,差异有统计学意义(P<0.05)。

表1 两组患儿不同临床症状例数比较[n(%)]Table 1 Comprison of patients with different clinical symptoms between two groups[n(%)]
Fisher精确概率法; EG:嗜酸性粒细胞性胃肠炎
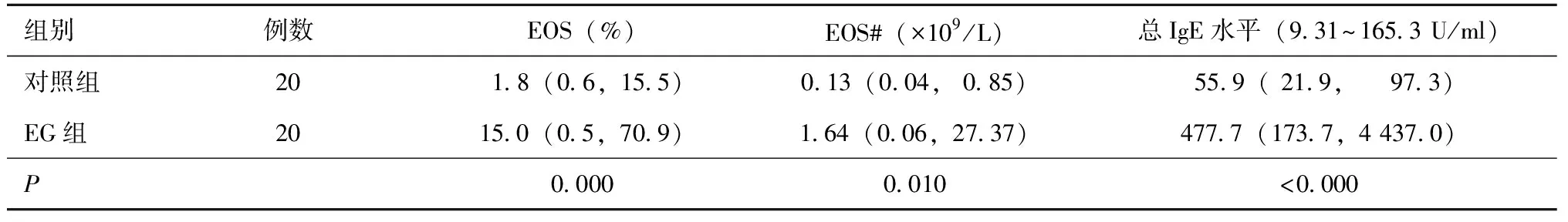
表2 两组受检者外周血EOS计数和lgE水平比较[M(Q1,Q3)]Table 2 Comprison of peripneral EOS number and IgE level between two groups[M(Q1,Q3)]
Mann-Whitney U检验; EG:嗜酸性粒细胞性胃肠炎;EOS: 嗜酸性粒细胞;EOS%参考范围:0.5~5%;EOS#参考范围:0.05~0.5×109/L;外周血总IgE水平参考范围:1.31~165.3 U/ml
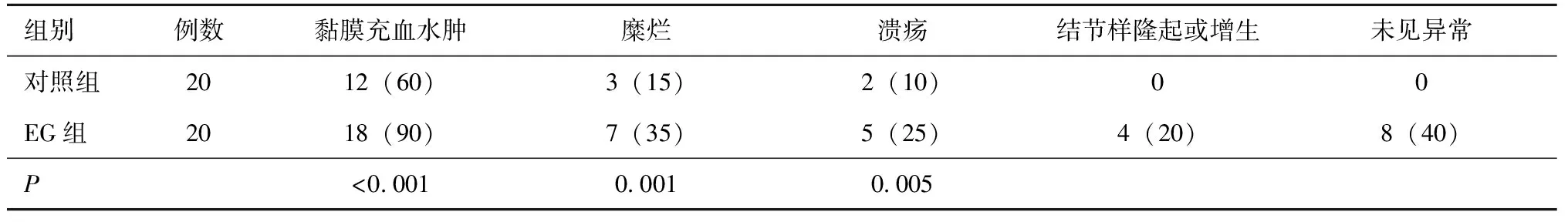
表3 两组受检者胃镜下异常表现例数比较[n(%)]Table 3 The number comprison of abnormal findings in gastric mucosa between two groups[n(%)]
Fisher精确概率法; EG:嗜酸性粒细胞性胃肠炎
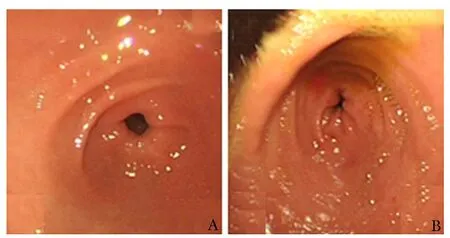
图 1 两组受检者胃镜下胃黏膜表现Fig 1 Comparison of gastrointestinal mucosa findings in the patients between two groupsA:对照组患儿胃窦黏膜正常; B:EG组患儿胃窦黏膜充血伴散在出血点
2.5 两组受检者胃窦黏膜组织中VIP及VPAC2表达变化
胃窦黏膜组织中VIP及VPAC2阳性表达为棕褐色染色。对照组受检者胃窦黏膜组织中VIP阳性表达A值为0.059±0.023,EG组患者胃窦黏膜组织中VIP阳性表达A值为0.012±0.009,明显低于对照组,差异有统计学意义(P<0.05)。对照组受检者胃窦黏膜组织中VPAC2阳性表达A值为0.075±0.018,明显高于EG组患者的0.032±0.019,差异有统计学意义(P<0.05)(图3,4)。

图2 胃窦黏膜组织EOS常规组织病理学检查(HE ×200)
Fig3 Pathological manifestation of EOS cells in gastrointestinal mucosa(HE ×200)
A:对照组患儿胃窦可见少量EOS细胞; B:EG组患儿胃窦黏膜组织中EOS数量对照组患儿
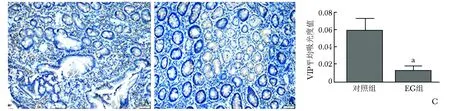
图3 胃窦黏膜VIP的表达(DAB ×200)
Fig3 Expression of VIP in gastrointestinal mucosa(DAB ×200)
A:对照组患儿胃窦黏膜中可见VIP阳性细胞多; B:EG组患儿胃窦黏膜中VIP阳性细胞少于对照组患儿; C:2个组间患儿胃窦黏膜组织中VIP阳性表达相对值比较,与对照组比较,*P<0.01(独立样本t检验)

图4 两组患儿胃窦黏膜中VPAC2表达(DAB ×200)
Fig4 Expression of VPAC2 in gastrointestinal mucosa(DAB ×200)
A:对照组患儿胃窦黏膜中VPAC2阳性表达较强,呈棕色染色; B:EG组患儿胃窦黏膜中VPAC2表达较弱; C:2个组间患儿胃窦黏膜中VPAC2表达值(A值)的比较,与对照组比较,*P<0.05(独立样本t检验)
2.6 EG患者胃窦黏膜中VIP和VPAC2与EOS和IgE水平的关系
EG患者胃窦黏膜组织中VIP阳性表达量与胃窦黏膜EOS数量和外周血总IgE水平均呈明显负相关(rs=-0.81、-0.83,均P<0.01)(图5);EG患者胃窦黏膜组织中VPAC2阳性表达量与胃窦黏膜EOS数量和外周血总Ig E水平均呈明显负相关(rs=-0.72,P<0.01;rs=-0.77,P<0.05)(图6)。
3 讨 论
EG是以胃肠道EOS异常浸润为特征的胃肠道疾病,近年来儿童EG的发生率逐年增高。儿童EG临床表现多样,主要临床症状有腹痛、腹泻、便血、呕吐、腹胀、腹水等。Khan等[10]根据EOS累及部位和浸润深度的不同将EG分为3型:(1)黏膜型(Ⅰ型) 最常见,占整个EG的50%以上,病变主要侵犯胃肠黏膜,表现为蛋白丢失性肠病、出血、吸收不良、生长落后、贫血。(2)肌层型(Ⅱ型) 以肌层病变为主,可引起肠壁增厚及肠梗阻,胃肠痉挛、腹痛、恶心呕吐等症状常频繁发生,也可表现为盲肠梗阻或肠套叠。(3)浆膜型(Ⅲ型) 以浆膜下病变为主,此型较少见,占整个EG的10%左右,患者通常表现为腹水,主要为渗出液,含有丰富的外周EOS。这三型EG可单独存在,亦可并存。
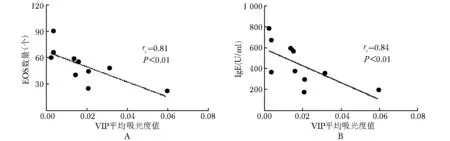
图5 EG组患儿胃窦黏膜VIPA值与胃窦黏膜EOS及外周血总IgE水平的关系
Fig5 Comelations of VIP absorbancy in gastrointestinal mucosa with EOS number or IgE level in EG group
A:胃窦黏膜组织VIPA值与EOS数量呈负相关(rs=-0.81,P<0.01); B:胃窦黏膜组织VIPA值与血总Ig E水平呈负相关(rs=-0.83,P<0.01)(Spearman秩相关分析)
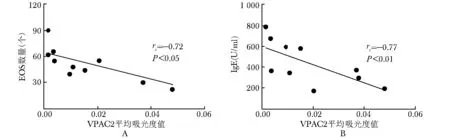
图6 EG胃窦黏膜VPAC2 A值与胃窦黏膜EOS及外周血总IgE水平的关系
Fig6 Comelations of VPAC2 absorbancy in gastrointestinal mucosa with EOS number or IgE level in EG group
A:EG组患儿胃窦黏膜组织VPAC2A值与EOS数量呈负相关(rs=-0.72,P<0.01)B:EG患儿胃窦黏膜组织VPAC2A值与血总Ig E水平呈负相关(rs=-0.77,P<0.05)(Spearman秩相关分析)
本研究纳入的20例EG患儿均存在消化道症状,其中腹痛最为常见,其余依次为腹泻、呕吐、大便带血、腹胀、腹水、排便困难。本研究20例EG患儿以Ⅰ型为主,仅4例为Ⅲ型,患儿出现腹腔积液且EOS计数明显增加,未发现Ⅱ型,其原因可能与胃镜活检钳所能夹取的深度不够有关[11-12]。Kinoshita等[13]对144例日本成人EG进行分析,患者主要表现为腹泻(54%)、腹痛(53%)、胸痛(15%)。Reed等[14]报道了34例美国儿童EG,平均年龄7.9±9.9岁,主要临床表现为呕吐(74%)、腹痛(53%)、腹胀(6%)、腹泻(29%)及便秘(38%)。杨素芳等[15]报道了76例中国儿童EG,平均年龄(5.42±3.97)岁,主要临床表现为反复腹痛(55.3%)、呕吐(39.5%)和便血(38.2%)。这些结果表明,EG的临床表现除了与EOS累及部位、浸润深度有关外,可能也与年龄和地域有关。
研究表明多数EG外周血EOS计数及总IgE水平升高,且对疾病的严重程度有一定的提示作用[16]。本研究75%的EG患儿外周血EOS计数升高,与Kinoshita等[13]的报道结论相符。本研究EG患儿中60%外周血总IgE水平明显高于对照组。
目前EG诊断主要依靠胃肠镜下多点活检[14](6个部位及以上),且常规病理组织学检查示至少有1处EOS>20个/HPF[17]。本研究20例EG患儿胃镜下表现以黏膜充血水肿为主,其余表现有黏膜糜烂、溃疡、结节样隆起或增生。胃窦黏膜组织EOS数量较对照组增多。
VIP作为胃肠黏膜中含量最丰富的神经内分泌肽之一,对胃肠道病理生理具有重要的调节作用。研究发现,支气管哮喘患儿血浆中VIP 含量较健康儿童降低,予以外源性VIP治疗后,哮喘症状得到缓解, VIP基因敲除哮喘小鼠模型和卵清蛋白(ovalbumin, OVA)致敏并诱发支气管哮喘的大鼠模型中得到了相同的结果[18-20]。目前关于EG患儿胃窦黏膜中VIP含量与EOS数量的相关研究尚未见报道。本研究采用免疫组织化学法检测EG患者胃窦黏膜组织中VIP及VPAC2含量,发现EG组患者胃窦黏膜组织中VIP及VPAC2含量较对照组减少。人体胃肠道黏膜分布着密集的VIP能神经纤维,与周围的肥大细胞、EOS毗邻并相互作用,形成神经-内分泌-免疫网络[21]。Wu等[22]报道VIP可以抑制肥大细胞释放介质EOS的迁移及产生IL-16。VIP可增强EOS的浸润,从而导致食管动力障碍,本研究结果与之不相符。本研究发现EG患儿胃窦黏膜组织中VIP含量和VPAC2含量分别与胃窦黏膜组织EOS数量、外周血总Ig E水平均呈负相关。
综上所述,胃窦黏膜VIP含量减少可能与EG的发生有关,结合文献报道[23],VIP能抑制血小板激活因子诱导的EOS嗜酸性过氧化物酶活性的增加效应, 抑制EOS脱颗粒反应,并抑制EOS与血管内皮细胞的黏附,推测其机制可能是胃窦黏膜VIP含量减少后其与EOS表面VIP受体2的结合减少,对EOS与胃窦血管内皮细胞黏附、浸润的抑制作用减弱,从而导致胃窦EOS聚集并发生脱颗粒反应,释放损伤性介质而导致EG的发生。
