生物制药过程中一次性储液袋的可提取物研究
2018-11-21秦孙星张昕蓓刘志
秦孙星 张昕蓓 刘志

摘 要 分别采用纯化水、1 mol/L醋酸溶液(pH=3)、4 mol/L氯化钠水溶液和10%聚山梨酯80溶液对一次性储液袋于40 ℃进行70 d提取,提取样品通过电感耦合等离子体质谱法(ICP-MS)、电感耦合等离子体原子发射光谱法(ICP-OES)、超高效液相色谱-二极管阵列检测器-质谱仪(UPLC-DAD-MS)、气相色谱-质谱仪/火焰离子检测器(GC-MS/ FID)和顶空进样-气相色谱-质谱仪(HS-GC-MS)进行杂质元素、不挥发物、半挥发物和挥发物、小分子挥发物等可提取物的分析测试。结果显示一次性储液袋有微量未知物质溶出。
关键词 生物制药 一次性储液袋 可提取物
中图分类号:R944.1 文献标志码:A 文章编号:1006-1533(2018)21-0075-04
Analysis of extractables in single-use bags in biopharmaceutical process
QIN Sunxing*, ZHANG Xinbei, LIU Zhi
(Shanghai Lepure Biotech Co., Ltd., Shanghai 201612, China)
ABSTRACT Single-use bags were extracted for 70 days at 40 ℃ by purified water, 1 mol/L acetic acid solution (pH=3), 4 mol/L sodium chloride solution or 10% polysorbate 80 solution, respectively. The impurity elements, non-volatiles, semivolatiles and volatiles, small molecule volatiles and other extractables in the extracts were analyzed by inductively coupled plasma mass spectrometry (ICP-MS), inductively coupled plasma atomic emission spectrometry (ICP-OES), UPLC-DAD-MS, gas chromatography- mass spectrometer/flame ion detector (GC-MS/FID) and headspace injection-gas chromatography-mass spectrometry (HS-GC-MS), respectively. The results showed that there was a trace amount of unknown substance dissolved in the single-use bags.
KEy WORDS biopharmaceutical; single-use bag; extractables
一次性儲液袋的应用在我国起步较晚,和欧美发达国家相比还存在一定差距,但是,一些成功使用的实践已为我国制药企业使用它提供了坚实的基础。目前,一次性储液袋已经广泛应用于液体储存、液体转移和混匀工艺。药液在直接接触一次性储液袋的过程中,膜材质的残留单体、添加剂或降解产物可能会迁移、溶出到药液中,对人体造成危害。因此,需要对一次性储液袋进行可提取物研究,检测储液袋中可能存在的可提取物种类和含量,这对保障药品安全有十分重要的意义[1]。
在本研究中,我们选取纯化水作为中性、极低离子强度、温和性溶液的模型溶剂;选取醋酸(1 mol/L,pH=3)作为酸性、较低离子强度类溶液的模型溶剂;选取NaCl水溶液(4 mol/L)作为中性、高离子强度类溶液的模型溶剂;选取10%聚山梨酯80作为表面活性剂类的模型溶剂对一次性储液袋中的可提取物进行检测[2]。选取上述四种生物制药过程中常用的溶剂进行提取检测,一方面为了证实一次性储液袋满足储液系统对密封性的要求,为药品生产提供储液预期的使用功能;另一方面证实一次性储液袋与大多数液体具有良好的相容性,即不会引入存在安全性风险的可提取物,或可提取物水平符合安全性要求[3]。
1 材料和方法
1.1 实验仪器
Optima 8000电感耦合等离子体发射光谱仪(ICPOES)、NexION 300D电感耦合等离子体质谱仪(ICP-MS)(铂金埃尔默公司);1290 UPLC-DAD和6130 MSD超高效液相色谱-二极管阵列检测器-质谱仪(UPLC-DAD/MS)、7890B GC和5977A MSD气相色谱-质谱仪/火焰离子检测器(GC-MS/FID)、7697A HS和7890B GC和5977B MSD顶空进样-气相色谱-质谱仪(HS-GC-MS)(安捷伦公司)(通标标准技术服务(上海)有限公司提供)。
1.2 材料
冰醋酸(分析纯,批号20170930)、聚山梨酯80(化学纯,批号20170227)、氯化钠(分析纯,批号20170802、20170620)均购自国药集团化学试剂有限公司;纯化水(Millipore公司)
一次性储液袋(货号:SB0500-LEP-2R,上海乐纯生物技术有限公司),由厚度为0.325 mm的5层共挤薄膜制成,膜的液体接触层是ULDPE材质,中间层是EVOH,最外层是PE。一次性储液袋规格为500 ml,经过25~45 kGy的伽马辐照。本次实验确保除了一次性储液袋袋体本身之外,没有外来污染物存在。
1.3 样品溶液制备
用于提取的溶液A、B、C、D分別为纯化水、1 mol/ml醋酸(pH=3)、4 mol/ml氯化钠溶液、10%聚山梨酯80,每个储液袋中各加入一种溶液301 ml,密封后置于40 ℃提取70 d后待测;用玻璃瓶替代储液袋,同法处理作为各自的空白对照。
1.4 分析方法
运用电感耦合等离子体质谱法(ICP-MS)测试28种元素,用电感耦合等离子体原子发射光谱法(ICP-OES)测试5种元素,用超高效液相色谱-二极管阵列检测器-质谱仪(UPLC-DAD-MS)测试不挥发性物质,用气相色谱-质谱仪/火焰离子检测器(GC-MS/FID)测试半挥发性和挥发性物质,用顶空进样-气相色谱-质谱仪(HS-GC-MS)测试小分子挥发物。上述测试均委托通标标准技术服务(上海)有限公司测试。
1.5 分析评价阈值(AET)
根据《化学药品与弹性体密封件相容性研究技术指导原则》[4]的建议,AET为一个阈值,当某个化合物的浓度超过该阈值时,化学家应对该化合物进行鉴定、定量和报告,并且有可能提交到毒理学家进行毒理评估。研究中若没有化合物超过AET时,则报告为无可报告的化合物。
本研究的AET被设立在0.02 mg/cm2。每个储液袋的接触表面积为1 806 cm2,提取时每个储液袋加入提取液301 ml,则AET=0.02 mg/cm2×1 806 cm2=36.12 mg/袋=0.12 mg/ml。
任何超过AET的化合物会通过数据库检索或者人工检查的方式尽可能被鉴定,鉴定程度分为四种:①肯定的 保留时间和质谱与标准品物质是相同的;②很可能的有充分的数据确定待测物的组成或者结果(对于GC典型的数据库匹配≥70%);③不确定的 数据不充分,仅显示和某些分子类似;④未知的 没有充分的数据,无法对化合物进行定性。
2 结果
2.1 ICP-MS测试28种元素及结果
通过标准曲线进行定量并计算,4种提取样品中Co、Cd、Hg的含量为<0.83 ng/cm2,其余25种元素Ni、Cu、Se、Ru、Rh、Pd、Sn、Os、Sb、Ba、W、Ir、Pt、Pb、As、Mo、V、Ti、Cr、Ag、Li、Mn、B、Zn、Al的含量均为<8.3 ng/cm2。任何在提取样品中检测到的元素量均须扣除空白对照的量,当元素结果小于样品LOQ溶液时,元素的结果报告为“<样品LOQ”。
2.2 ICP-OES测试5种元素
样品溶液由铂金埃尔默生产的Optima 8000 ICP-OES进行测试。同法对一组浓度为0.1 mg/ml、0.5 mg/ml、1 mg/ml和2 mg/ml的混合标准溶液进样分析。
通过混标的响应对5种元素进行定量并计算(表1)。任何在提取液中检测到的元素均会扣除控制空白,当元素结果小于样品LOQ时,元素的结果被报告为小于“<样品LOQ”。
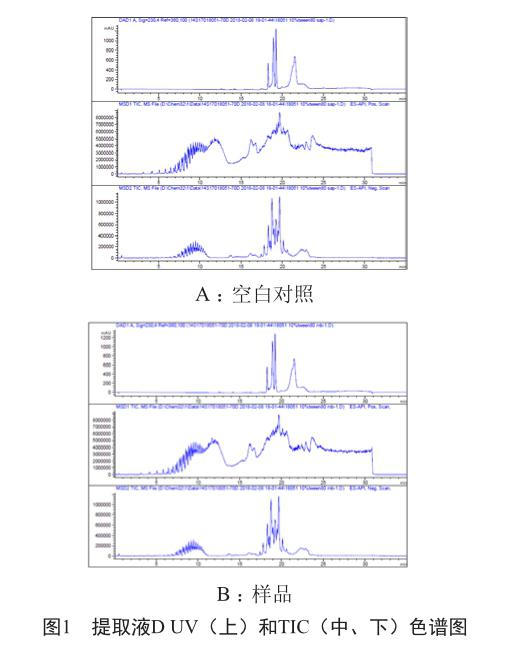
2.3 UPLC-DAD-MS测试不挥发性物质
检测结果为无可报告的化合物(图1)。
2.4 GC-MS/FID测试半挥发性和挥发性物质
提取液D中有23 ng/cm2的未知化合物,其余提取液中未检出>20 ng/cm2的化合物(图2)。
2.5 HS-GC-MS分析小分子挥发物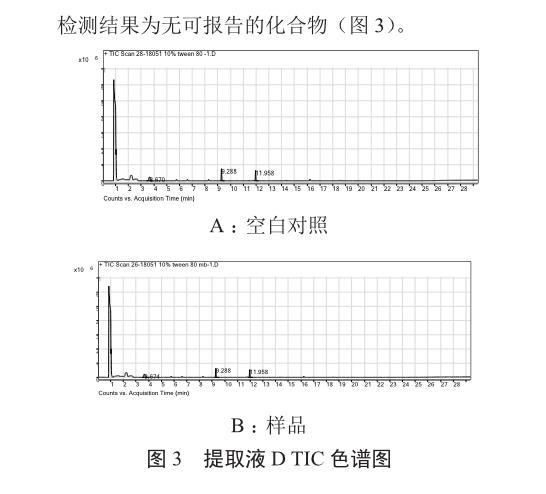
3 讨论
用4种提取溶剂进行了元素和有机物测试,共检测到3种元素,分别为Ca、Zn和Si,还有1个含量较低的未知物。Zn在《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》[5]中规定的PDE为1 300 mg/d。Ca和Si在ICH7 Q3D元素杂质[6]、《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》和《化学药品注射剂与塑料包装材料相容性研究技术指导原则》[7]中均没有规定的PDE值,属于毒性较低的元素。
一次性储液袋具有保护性、安全性、相容性和功能性,为生物制药行业中的液体储存、液体转移、无菌过滤等工序提供了一种更安全、更高效、更灵活的选择。一次性使用系统(SUS)和组件在临床和商业生物制药领域的用量在近几年来有很大的提升,但在实际应用工作中还面临着巨大的挑战,例如SUS的使用认证、SUS的关键数据定义及采集、SUS系统物理化学属性不足导致的缺陷引起工艺或操作偏差所属方的认证及赔偿问题等。这些既属于风险控制又与使用法规相关联的问题必须具有顶层设计的战略解决方式。为了确保药品工艺和药品质量处于连续不断的受控状态,并能够持续改进,我们正积极配合制药企业提供试验数据[8]。
参考文献
[1] Jenke D, Castner J, Egert T, et al. Extractables characterization for five materials of construction representative of packaging systems used for parenteral and ophthalmic drug products[J/ OL]. PDA J Pharm Sci Technol,2013,67(5): 448-511.http://journal.pda.org/content/67/5/448.full.pdf+html.
[2] Product Quality Research Institute(PQRI). Safety thresholds and best practices for extractables and leachables in orally inhaled and nasal drug products[EB/OL]. (2006-09-08)[2018-02-27]. http://pqri.org/wp-content/uploads/2015/08/pdf/LE_ Recommendations_to_FDA_09-29-06.pdf.
[3] European Medicines Agency. Guideline on the limits of genotoxic impurities [EMEA/CHMP/QWP/251344/2006][EB/OL]. (2016-06-2)[2018-02-27]. https://www.gmpcompliance.org/gmp-news/ich-publishes-new-draft-guidelineon-genotoxic-impurities.
[4] 國家食品药品监督管理总局药品审评中心. 化学药品与弹性体密封件相容性研究技术指导原则[20161228][EB/OL].(2016-12-30)[2017-09-30]. http://www.cde.org.cn/zdyz. do?method=largePage&id;=252.
[5] 国家食品药品监督管理总局. 化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)[2015年第40号通告][EB/OL]. (2015-07-28)[2018-02-27]. http://www. sda.gov.cn/WS01/CL0087/126004.html.
[6] International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). Guideline for Elemental Impurities [ICH Q3D Current Step 5 version] [EB/OL]. (2014-12-16)[2017-09-30]. http://www.cde.org.cn/policy.do?method=policy_ index&frameStr;=9.
[7] 国家食品药品监督管理总局. 化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)[国食药监注[2012]267号][EB/OL]. (2012-09-07)[2017-09-30]. http:// www.sda.gov.cn/WS01/CL0844/75197.html.
[8] International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). Assessment and control of DNA reactive(Mutagenic) impurities in Pharmaceuticals To Limit Potential Carcinogenic Risk M7 Current Step 4 version[EB/OL]. (2014-06-23)[2017-09-30]. http://www.ich.org/fileadmin/Public_ Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/ M7_Step_4.pdf.
