FeVO4-H2O2体系中酸性品红的降解性能研究
2018-11-21欧晓霞王驭晗时佳荣周庆宇
欧晓霞,王驭晗,时佳荣,周庆宇
(大连民族大学 环境与资源学院,辽宁 大连 116605)
目前,中国染料总产量占世界总产量的60%,居世界首位[1]。来源于纺织品、印刷厂、皮革厂、酿酒厂、电镀厂、造纸厂和食品工业的有机染料废水,对人类健康和地球生态系统有着很大的危害[2]。大多数染料是有毒的,具有致癌、诱变和致畸的特性,染料废水的处理成为人们关注的焦点[3-5]。传统的水处理方法如吸附、混凝、膜分离等都有较高的运行成本,甚至产生二次污染物[6]。
高级氧化技术是近二十多年来兴起的一种重要的环境净化技术,处理高效、快速,有着广阔的应用前景。其中多相类芬顿(Fenton like)催化剂因其在处理有机废水时没有严格的pH值限制而备受关注,主要是负载型Fe(III)和铁氧化物等[7]。此外,有报道指出阴离子(如V)与铁阳离子结合形成多相Fenton like催化剂FeVO4,能有效地催化降解有机污染物[8-9]。
本研究考察了酸性品红在FeVO4-H2O2体系中的降解规律,研究了双氧水的初始浓度、催化剂用量和反应温度对脱色率和反应速率常数的影响;并分析确定实验条件下类Fenton氧化体系的反应动力学过程,计算了反应活化能。本研究为利用多相Fenton like催化剂方法处理含酸性品红的印染废水提供理论依据。
1 材料与方法
1.1 仪器及试剂
80-2型离心沉淀机(巩义市英峪予华仪器厂),WFJ2100型可见分光光度计(尤尼科上海仪器有限公司),超声仪(上海科导超声仪器有限公司),DF-101S集热式磁力加热搅拌器(大连科锐生物工程有限公司),DHG-9246A型电热恒温鼓风干燥器(上海精宏实验设备有限公司);酸性品红、偏钒酸铵、九水合硝酸铁、丙酮、过氧化氢(H2O2,质量分数30%),均为分析纯。实验中均用超纯水(18.2 MΩ·cm)配制溶液和进行反应。
1.2 实验方法
1.2.1 FeVO4的制备
FeVO4的制备方法[8]如下:在75 ℃恒温条件下,将0.26 mol·L-1的Fe(NO3)3溶液快速倒入完全溶解的NH4VO3溶液(4.27×10-2mol·L-1)中,同时不断搅拌,反应1 h。反应结束后,将反应溶液冷却至常温并离心沉淀,倒掉上清液,收集下层沉淀物。用去离子水漂洗离心后的物质8~10遍,直到漂洗水酸碱接近中性。过滤漂洗后的FeVO4沉淀,并用丙酮进行漂洗。最后将滤干的沉淀物放在40 ℃的烘箱中烘干4 h。取出后,用研钵将FeVO4研细。
1.2.2 酸性品红的降解实验过程
称取一定量的酸性品红,配成200 mg·L-1的品红储备液,冰箱避光保存。取200 ml烧杯,加入一定体积的品红储备液,再加入去离子水至100 ml,摇匀并在545 nm下测吸光度A0,然后加入一定量的FeVO4催化剂配成反应悬浊液,在恒定的温度下进行磁力搅拌30 min以达到吸附/解吸平衡。加入给定体积的H2O2溶液(质量浓度为30%)启动反应(计时开始),在固定时间t取出水样,用膜过滤,测过滤后的溶液在545 nm下的吸光度At。
酸性品红的去除率:
w%=(1-At/A0)×100% 。
(1)
式中:A0为反应前吸光度值;At为反应tmin后吸光度值。
1.2.3 反应动力学常数测定
若反应中,某反应物A的消耗速率与反应物A的物质的量浓度一次方成正比,则为一级反应。其微分速率方程为
(2)
积分后得到反应的积分速率方程:
ln(CA,0/CA)=kAt。
(3)
如果水中染料的催化降解反应为一级反应,则其反应的动力学方程式为一级动力学方程
ln(A0/At)=kAt。
(4)
式中,kA为反应物A的动力学反应速率常数。
2 结果与讨论
2.1 不同浓度的过氧化氢对酸性品红降解的影响
在pH 7.0±0.1时,控制酸性品红质量浓度为20 mg·L-1,FeVO4用量为0.5 g·L-1,反应温度25 ℃,不同浓度的H2O2对酸性品红降解的影响如图1。酸性品红降解一级动力学拟合曲线如图2。
含0.5 g·L-1FeVO4溶液中酸性品红的降解率随着H2O2浓度的增加先增加后降低。反应1 h后,4.5 、9.1 、13.6、18.2 mmol·L-1的H2O2浓度分别对应51.3%、61.2%、77.7%和72.8%的酸性品红去除率,对应的一级反应速率常数分别为0.010、0.014、0.023和0.019 min-1。FeVO4催化剂和H2O2的反应如式(5)-(9)所示[10-12]。H2O2可以同时与铁物质(≡FeⅢ/FeⅡ)和钒酸盐物质(≡VⅤ/VⅣ)反应生成·OOH和·OH。增加H2O2浓度将有利于通过上述两种途径或更多途径来提高·OH的形成速率。但是,过量的H2O2也会消耗·OH(反应(9))。因此,选择H2O2的初始浓度是13.6 mmol·L-1。
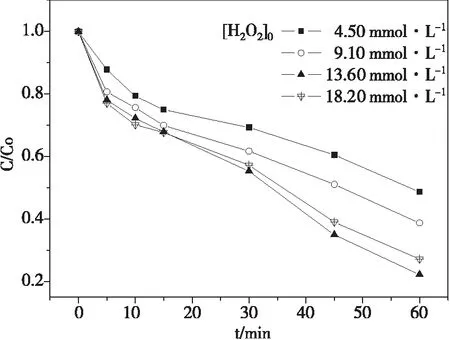
图1 不同浓度H2O2对酸性品红降解的影响
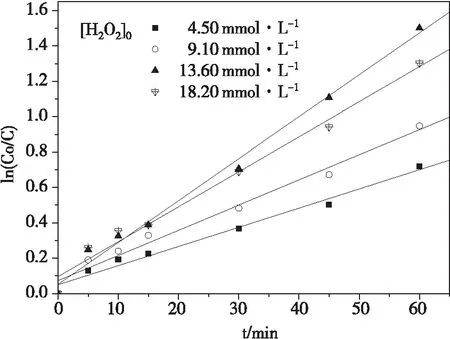
图2 拟合的酸性品红降解一级动力学曲线
≡FeⅢ+ H2O2→≡FeⅡ+ ·OOH + H+
(5)
≡FeⅡ+ H2O2→≡FeⅢ+ ·OH + OH-
(6)
≡VⅤ+ H2O2→≡VⅣ+ ·OOH + H+
(7)
≡VⅣ+ H2O2→≡VⅤ+ ·OH + OH-
(8)
H2O2+ ·OH → HO2·+ H2O
(9)
2.2 FeVO4投加量对酸性品红降解的影响
在pH 7.0±0.1时,控制酸性品红质量浓度为20 mg·L-1,H2O2用量浓度为13.6 mmol·L-1,反应温度25 ℃,FeVO4投加量对酸性品红降解的影响如图3。酸性品红降解一级动力学拟合曲线如图4。
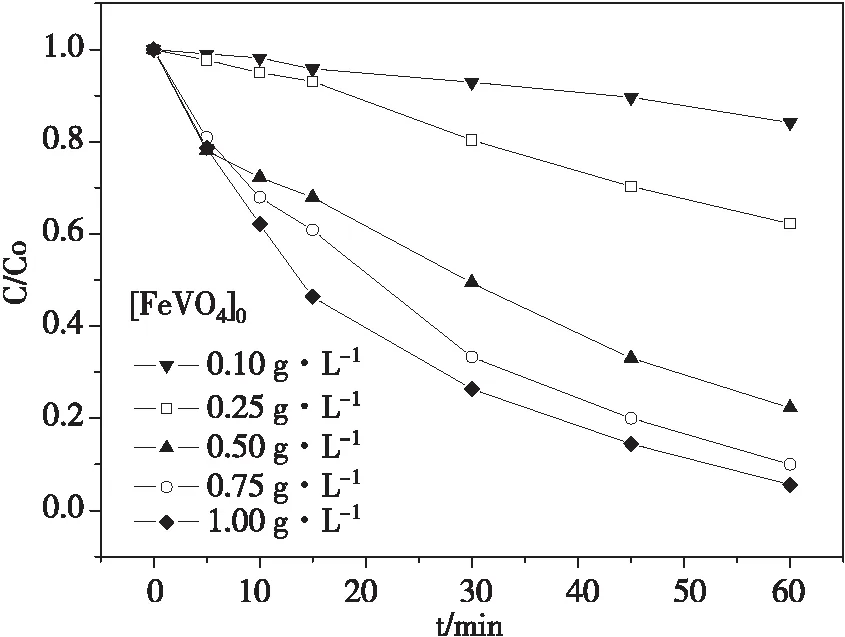
图3 FeVO4投加量对酸性品红降解的影响
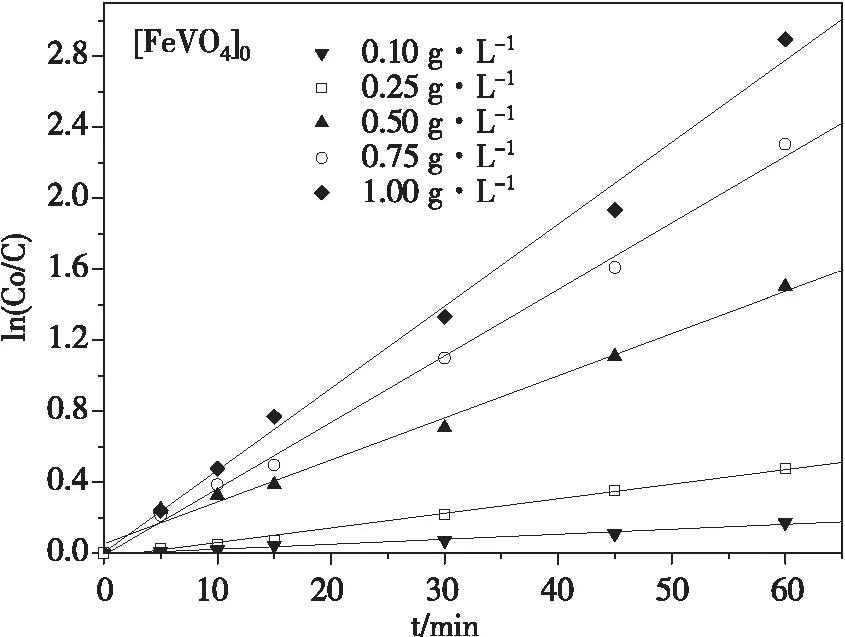
图4 酸性品红降解一级动力学拟合曲线
酸性品红的降解率随着FeVO4投加量的增加而增加。反应1 h后,0.10、0.25、0.50、0.75和1.00 g·L-1的FeVO4投加量分别对应于15.89%、37.8%、77.7%、90.1%和94.5%的酸性品红去除率,对应的一级反应速率常数分别为0.002、0.008、0.023、0.037和0.046 min-1。这说明,高浓度的催化剂投加量有利于催化反应的进行,催化剂投加量的增加不仅在反应体系中引入了更多的催化活性中心[13],而且提高了FeVO4与染料分子之间的接触面积,使其能够吸附更多的染料分子,加强了FeVO4对染料降解反应的促进作用。
2.3 反应温度对酸性品红降解的影响
在pH 7.0±0.1时,控制酸性品红质量浓度为20 mg·L-1,FeVO4用量为0.5 g·L-1,H2O2用量浓度为13.6 mmol·L-1,设定反应温度为15、25、30、40和45 ℃ 5个梯度,考察酸性品红的去除效果,实验结果如图5。
温度越高,酸性品红降解得越快。15 ℃时,降解曲线还比较平缓,这时品红的残留量比较大,去除率不高。随着温度的增加,残留量降低越来越快,当温度达到45 ℃时,酸性品红在45 min时的残留量已经达到零,即去除率达到100%。这表明,温度对提高反应速率有显著影响,温度的提高不仅给反应提供了热量,促使了自由基生成的反应;同时又提供了催化剂适宜的反应温度,当温度过低时,催化剂活性不高,因而反应速率不高,提高温度使催化剂的活性大幅提高,直接导致反应速率加快。因此,提高反应温度可以提高催化剂的活性。
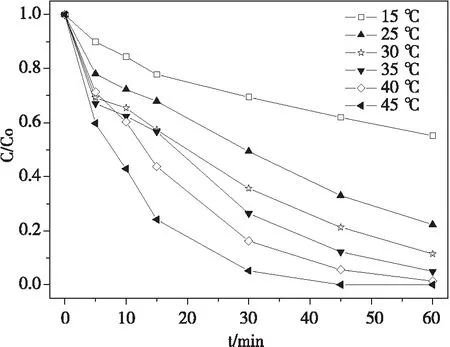
图5 不同温度对酸性品红降解的影响
为了进一步说明反应速率随温度的变化程度,可以对反应活化能Ea进行计算。Arrhenius方程为
k= Aexp (-Ea/RT) 。
(10)
式中:A为指前因子或频率因子;Ea为反应活化能,单位为kJ·mol-1;R为气体常数,其值为8.314 J·(K·mol)-1;T为温度,单位为K。
对方程式(10)中的等式两边取对数,可得
lnk= lnA-Ea/RT 。
(11)
以lnk对1/T作图,从直线的斜率和截距可以求出该反应条件下的Ea。
运用一元线性回归方程对图5中酸性品红的部分降解动力学数据进行分析,如图6,所得到的一级回归方程的速率常数k见表1。

图6 不同温度下酸性品红的降解动力学曲线
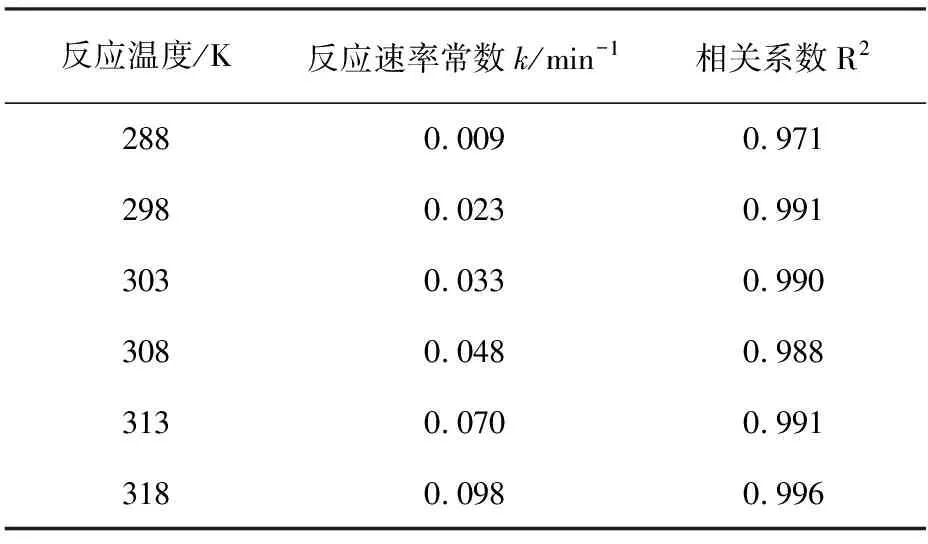
表1 不同温度下酸性品红脱色降解的反应速率常数
依据表1中的数据,lnk对1/T线性拟合后得到图7。直线方程为y = -7246x + 20.49,相关系数R = 0.998,计算得Ea = 60.24 kJ·mol-1。FeVO4降解酸性品红的Ea较大,说明这个反应对温度较为敏感,升温会提高反应速率。有报道显示,通常在Ea > 100 kJ·mol-1时,化学反应需要适当加热才能进行[14-15]。FeVO4降解酸性品红的Ea小于100 kJ·mol-1。因此,可以认为FeVO4降解酸性品红的反应能够在室温下进行。
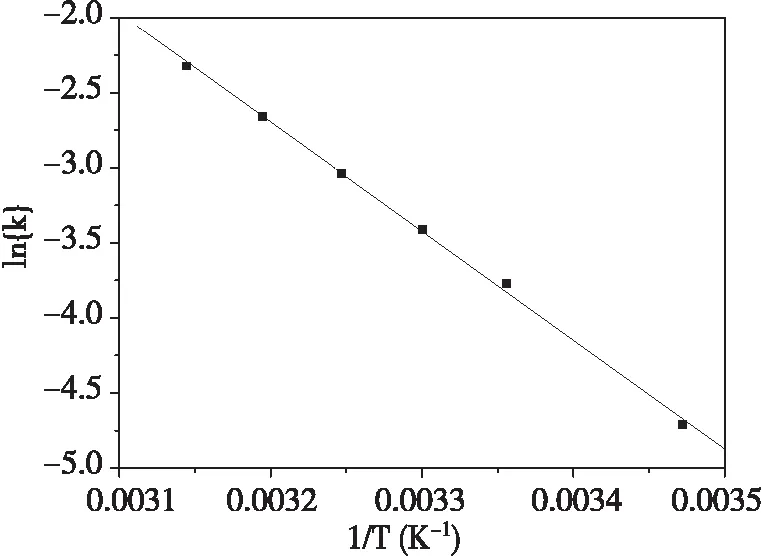
图7 ln{k}~{1/T}关系
3 结 论
(1) FeVO4- H2O2体系中,酸性品红发生降解主要是由·OH引发的。
(2)本实验条件下的FeVO4-H2O2体系(25 ℃)中,H2O2的初始浓度为13.6 mmol·L-1,溶液的pH=7.0±0.1,酸性品红的初始浓度为20 mg·L-1,投加1.0 g·L-1的FeVO4时,反应60 min酸性品红的去除率达到94.5%。
(3)升高反应温度,有利于FeVO4-H2O2体系中酸性品红的降解;计算得到反应的活化能为60.24 kJ·mol-1。
