磁性Fe3O4纳米颗粒的制备及其催化降解水中磺胺甲恶唑研究
2018-11-20胡春华郭昌胜吴代赦
陈 苗, 胡春华, 郭昌胜, 吴代赦, 徐 建
(1.南昌大学 资源环境与化工学院,鄱阳湖环境与资源利用教育部重点实验室, 江西 南昌 330031; 2.中国环境科学研究院 环境基准与风险评估国家重点实验室, 北京 100012)
1 研究背景
磺胺类抗生素是一种重要的抑菌试剂,因其杀菌效果明显,价格低廉、具有广谱性等优点而广泛应用于医疗、畜牧养殖和渔业养殖等领域[1]。该类抗生素在被人或动物服用后,仅20% ~ 40% 能被吸收并发挥药效[2],其余大部分药物不能被有机体完全代谢,大量未被利用的母体化合物及代谢产物可能通过各种不同的方式进入水环境。传统工艺的污水处理厂由于对磺胺类药物去除效率有限,未经去除的抗生素最终扩散到地表水、地下水或沉积物,从而影响整个生态系统的良性循环,可能诱导产生大量的耐药致病菌,最终影响到人类的健康[3]。磺胺甲恶唑(sulfamethoxazole,SMZ)是磺胺类抗生素的一种,因其含有大量抑菌性有机物,难以用生物法将其去除[4]。水体中SMZ的去除方法主要有吸附法,高级氧化技术(AOPs)、光催化降解法等,但这些水处理技术均存在一定的缺陷,例如,吸附法易造成二次污染,AOPs存在高能耗、高成本等问题,光催化降解无法投入大范围实际生产等[5-8]。因此,研发一种高效且成本低、效益好的去除水环境中抗生素类污染物的技术非常重要。
磁性纳米材料因其良好的分散性、稳定性及易回收的特性受到研究者的广泛关注[9]。纳米Fe3O4属立方晶系,呈反尖晶石结构,因其具有粒径小、比表面积大等优点,广泛应用于医疗、染料废水及生活污水中有机污染物和重金属的去除[10-15]。近年来研究表明,纳米Fe3O4粒子具有类似于过氧化物酶的特性[16],可以催化氧化过氧化氢产生·OH,从而降解水环境中的有机污染物。传统的均相Fenton法是利用Fe2+与H2O2反应产生·OH来氧化降解污染物。其主要存在pH响应范围窄、催化剂无法循环利用、H2O2利用效率低等问题[17]。而磁性Fe3O4纳米颗粒催化H2O2的非均相类Fenton反应在处理水体中污染物时能克服以上缺点,其运行成本低、催化剂可循环利用且不产生二次污染[18]。何洁等[19]利用纳米Fe3O4/H2O2类Fenton体系降解邻苯二酚,发现纳米Fe3O4能快速去除溶液中的邻苯二酚和总有机碳(TOC),并能迅速催化H2O2分解。孙正男等[20]以纳米Fe3O4/CeO2为催化剂的非均相类Fenton体系对3,4-二氯三氟甲苯的降解率最高可达99.7%。然而,目前针对采用磁性Fe3O4纳米颗粒的Fenton法去除水中的磺胺类抗生素研究鲜见报道。本文采用溶剂热法制备了顺磁性Fe3O4纳米颗粒,对其结构进行了表征,并将其运用于Fenton法去除水体中的SMZ,并探讨不同pH值、H2O2浓度及催化剂用量对SMZ降解效率的影响,加入·OH捕获剂叔丁醇来探讨降解机制,为治理抗生素的环境污染提供理论和技术支持。
2 材料与方法
2.1 实验试剂
六水合氯化铁(FeCl3·6H2O),聚乙烯吡咯烷酮(PVP),醋酸钠(NaAc),乙二醇(C2H6O2),叔丁醇(C4H10O),质量分数为30%的双氧水(H2O2),盐酸(HCl)和氢氧化钠(NaOH)均为分析纯,购买自国药集团化学试剂有限公司。磺胺甲恶唑(纯度>98%)由Sigma-Aldrich 公司提供。甲醇、乙腈为色谱纯,购买自德国Merck公司,实验用水均为超纯水。
2.2 催化剂的制备与表征
2.2.1 纳米Fe3O4的制备 分别称取1.5 g的六水合氯化铁,1.0 g的PVP,2.0 g的醋酸钠溶解在30 mL的乙二醇溶液中,混合搅拌2 h至完全溶解,然后转移至50 mL反应釜中在200 ℃条件下反应8 h,自然冷却后用外加磁场进行分离,分离后用乙醇和水分别洗涤3次,真空60 ℃干燥24 h即可得到磁性Fe3O4纳米颗粒。
2.2.2 纳米Fe3O4的表征 采用X射线衍射仪(XRD, D8 advance,德国Bruker公司)对样品的晶体结构进行分析。使用场发射扫描电子显微镜(SEM,JMS-6301F,德国里奥公司)和透射电镜(TEM, 日立, HT7700)分析复合材料的表面形貌、晶粒尺寸和微观结构。合成样品的磁滞曲线通过振动样品磁强计(VSM, LakeShore 7307)测定。
2.3 实验方法
在室内自然环境下,将SMZ置于50 mL聚乙烯塑料瓶中,反应溶液为20 mL,SMZ的初始浓度为20 mg/L。溶液中加入一定剂量的纳米Fe3O4材料,超声处理1 min,溶液pH值用0.10 mol/L的氢氧化钠和盐酸溶液调整到设定值。反应溶液在可控温度摇床中(T=25 ℃)以200 r/min的速度平衡60 min,取1 mL反应溶液测定降解前SMZ的浓度,然后在溶液中加入特定剂量的H2O2(质量分数为30%),开始反应,每隔一定时间取样1 mL。将取出的样品经磁分离后,取上清液测定SMZ的浓度。
2.4 分析方法
上清液中SMZ的浓度采用Agilent 1200高效液相色谱仪(HPLC)分析检测,色谱条件:检测器为二极管阵列检测器;色谱柱为Agilent Zorbax Eclipse XDB-C18 (2.1×100 mm,3.5 μm) ;流动相由体积比为甲醇∶水(含0.1%甲酸)=35∶65的溶液组成,流速为0.2 mL/min,进样体积为20 μL,紫外检测波长为265 nm,柱温为30 ℃。
3 结果与讨论
3.1 物相与形貌的表征
图1为溶剂热法制备的Fe3O4纳米颗粒的XRD图谱,将其与Fe3O4标准谱图(JCPDS PDF #65-3107)作对比,发现本次制备的Fe3O4的XRD衍射峰与其完全吻合,并且没有其他杂质衍射峰,而2θ=18.12°,30.18°,35.49°,43.11°,53.61°,57.15°和62.82°对应于Fe3O4标准图谱中的反尖晶石结构。说明成功制备了Fe3O4纳米材料,且所制备的Fe3O4纳米颗粒纯度较高。合成样品衍射峰的峰形尖锐,说明样品的结晶度良好。
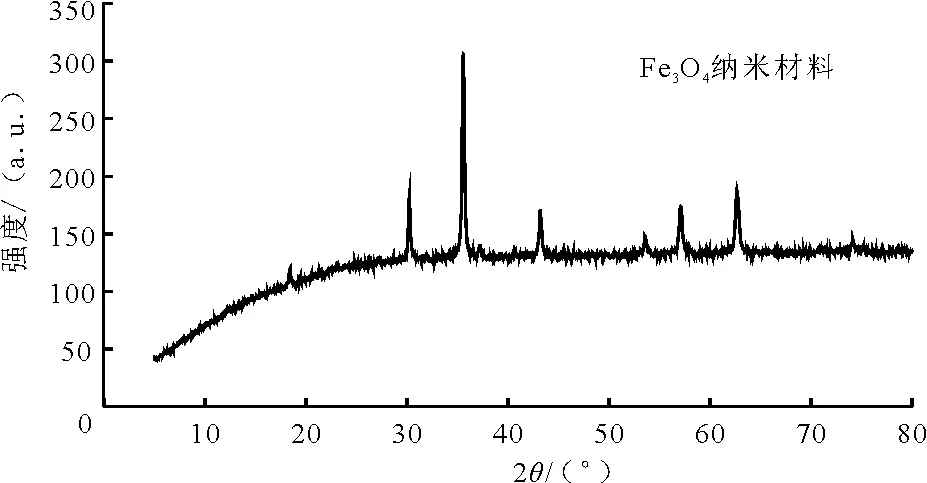
图1 Fe3O4纳米颗粒的X射线衍射图谱
图2为本研究制备的Fe3O4纳米颗粒不同放大倍数的SEM图,从图2可以看出,制备的Fe3O4纳米颗粒形态规整,呈规则的球形,尺寸在200~250 nm之间。Fe3O4纳米颗粒部分颗粒发生了团聚,这是由于磁性材料的颗粒之间存在磁吸引的原因。

图2 Fe3O4纳米颗粒的扫描电镜图
图3为Fe3O4纳米颗粒的磁滞回线,由图3可知,纳米Fe3O4颗粒的磁滞和矫顽力均为0,表明纳米Fe3O4具有很强的顺磁性。饱和磁强度为88.6 Am2/kg,有报道表明当磁性材料的最大饱和磁强度为16.3 Am2/kg时,用一个普通磁铁即可将其从溶液中分离出来[21]。因此,本实验中制备的Fe3O4纳米颗粒可以满足磁分离的要求。
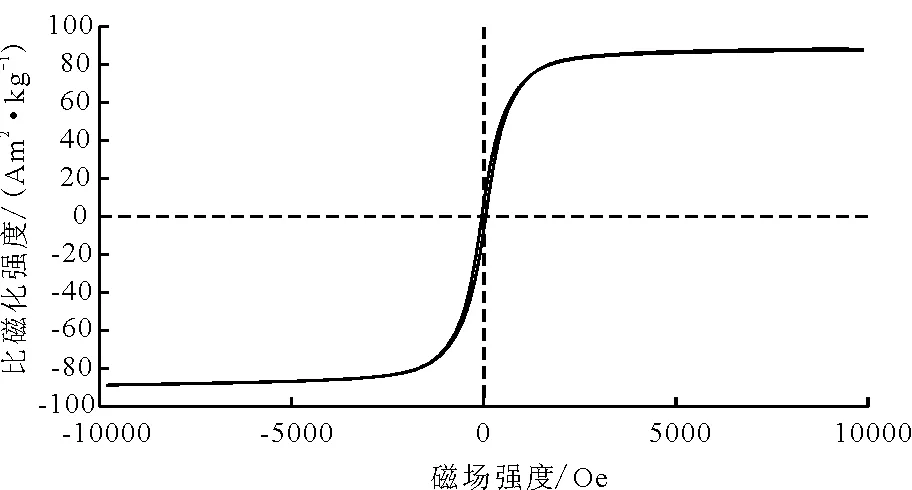
图3 Fe3O4纳米颗粒的磁滞回线
3.2 Fe3O4纳米颗粒催化降解SMZ的影响因素

图4 不同pH 值下SMZ的降解效果
3.2.2 不同H2O2浓度的影响 在催化剂用量为1.0 g/L,溶液pH=3,T=25℃的条件下,考察了H2O2浓度(0~10.0 μL/mL)对SMZ降解的影响。如图5所示,未加H2O2时,SMZ基本未发生降解。随着H2O2浓度的增加,SMZ的降解率显著升高。H2O2的量为1.0 μL/mL时,60 min后SMZ的降解率为38.9%。当H2O2浓度升高至5.0 μL/mL时,SMZ在5 min时降解率为86.4%,至60 min时,降解率达98.7%,是浓度为1.0 μL/mL时的2.5倍。而当H2O2浓度提高至10.0 μL/mL时,SMZ的降解率达到最高值,其在2 min时的降解率高达96.3%,60 min时降解率达99.6%。相比H2O2浓度为5.0 μL/mL时,10.0 μL/mL的H2O2对SMZ在30 min后的降解率相差不大,二者降解效果无显著差距,为考虑实际应用中成本问题,因此后续实验中将H2O2浓度为5.0 μL/mL视为最佳H2O2浓度。随着H2O2浓度的提高,如方程(1)所示反应体系中产生的·OH也越多,SMZ降解速率也越快,但降解速度不会一直提高,当H2O2浓度过高时,没有足够的催化剂来催化其产生·OH,同时会产生如方程(2)所示反应,致使·OH被消耗,而HO2·的氧化性较弱且HO2·能够捕获·OH导致·OH含量减少,进而导致SMZ降解效率下降[27]。

(1)

(2)
相关研究[28-30]表明,过低浓度的H2O2不足以产生足量的·OH来降解污染物,而当H2O2过量时,会分解产生过量的·OH,它们之间可能会相互作用以清除·OH。此外,高浓度的H2O2也会对·OH产生清除作用。
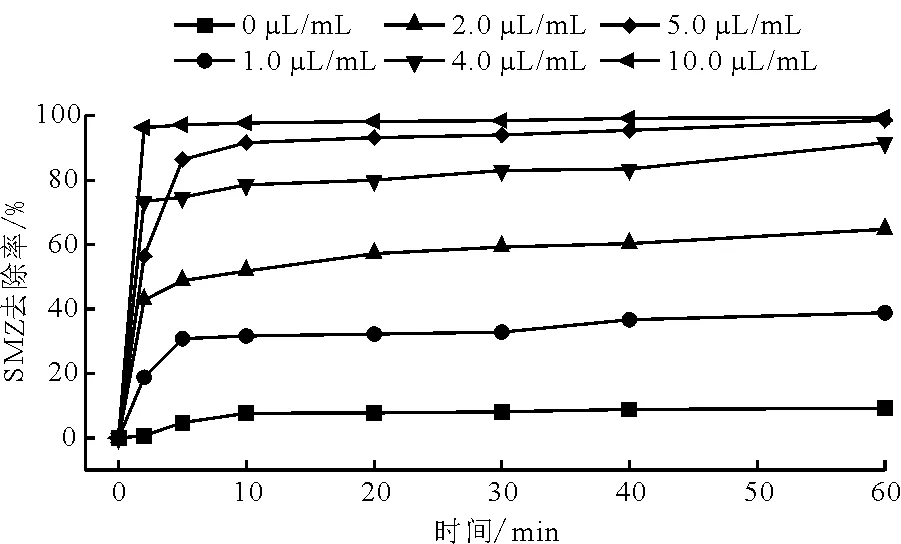
图5 不同H2O2浓度下SMZ的降解效果
3.2.3 不同催化剂用量的影响 溶液pH=3,H2O2的量为5.0 μL/mL时,T=25 ℃下,考察了催化剂Fe3O4用量(0~1.0 g/L)对SMZ降解率的影响,结果如图6所示。由图6可见,未加催化剂时,SMZ基本未降解,而随着催化剂用量的增加,SMZ的降解率显著提升。当催化剂用量为0.1 g/L时,SMZ降解效果不明显,60 min时降解率仅为11.5%。当Fe3O4用量提高到0.5 g/L时,SMZ 在60 min时的降解率也不高,仅为54.9%。这是因为此时催化剂用量太少,将H2O2催化为·OH的数量有限,导致催化效率较低。随着催化剂用量持续增加,SMZ降解率逐渐提高,此时催化剂提供了更多的活性位点,且反应体系中产生了更多的·OH,促进了降解反应的进行[31]。当催化剂浓度为0.8 g/L时,SMZ在2 min时的降解率为88.0%,至60 min时SMZ降解率达98.1%,此时SMZ几乎完全被降解。但随着催化剂浓度进一步提高至1.0 g/L时,SMZ在2 min的降解率为91.3%,其在60 min时的降解率为98.5%,相比Fe3O4用量为0.8 g/L时,SMZ在前60 min的降解率并没有明显提高。一方面可能是因为此时催化剂用量已经接近饱和,H2O2几乎完全消耗,即使再增加催化剂也没有H2O2能与之反应,且此时Fe3O4颗粒部分发生团聚,减少了催化剂与H2O2的接触面积[25]。另一方面,由于·OH的大量产生和较短的存在寿命,致使部分·OH在与SMZ反应之前已经自身相互发生反应而猝灭,从而导致·OH浓度的降低[32]。以上这些因素可能是导致SMZ降解效率没有随着催化剂用量的提高而进一步提升的原因。综合考虑Fe3O4用量为1.0 g/L和0.8 g/L时SMZ在40 min后的降解率相差不大及实际应用成本问题,将Fe3O4用量为0.8 g/L作为最优催化剂用量条件。
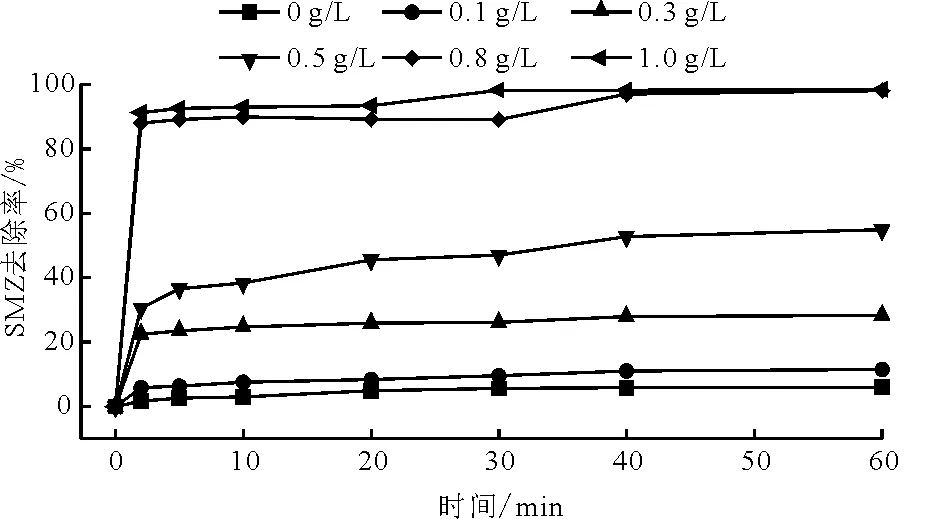
图6 不同Fe3O4用量下SMZ的降解效果
3.2.4 回收循环实验 按照上述步骤,在纳米Fe3O4-H2O2类Fenton 反应后,使用磁铁分离纳米Fe3O4颗粒,用去离子水洗涤并干燥后,再连续重复使用4 次(反应条件:溶液pH=3,H2O2用量为5.0 μL/mL,催化剂Fe3O4用量为0.8 g/L,反应时间为30 min,T=25℃),随着循环使用次数的增加,SMZ降解率稍有降低,SMZ的去除率由98.3% 降到了86.3%(图7)。有研究表明,纳米Fe3O4在水溶液中容易团聚,而在潮湿的空气中又极易被氧化,这可能是造成纳米Fe3O4类Fenton 性能不稳定性的主要原因[33]。同时,降解过程中逐渐增多的副产物占领了催化剂表面的活性位点,也可能是导致催化剂不能完全发挥作用的原因。纳米Fe3O4颗粒循环使用5次后对SMZ的降解率仍然能达到86.3%,说明所制备的纳米Fe3O4颗粒具有较好的稳定性和可循环利用性。
3.3 降解机制探讨
已有研究表明,Fe3O4纳米颗粒催化H2O2降解污染物,是由于生成具有强氧化性的·OH与污染物反应,属于类Fenton反应[31, 34-35],为了验证这种机理,在溶液pH=3,H2O2浓度为5.0 μL/mL,催化剂Fe3O4用量为0.8 g/L,T=25 ℃条件下,考察了·OH清除剂叔丁醇(TBA)的用量对SMZ降解率的影响,结果见图8。由图8可见,未加入叔丁醇时,SMZ降解效果最好,在5 min内即可达到94.5%。当叔丁醇用量为1 mmol/L和10 mmol/L时,30 min内SMZ的降解率分别只有48.9%和37.9%;当叔丁醇的用量为100 mmol/L 时,30 min时SMZ降解率仅为18.9%。溶液中加入叔丁醇对SMZ的降解有明显地抑制作用,说明Fe3O4-H2O2系统中能够产生·OH,而且·OH是降解SMZ最主要的氧化剂。类Fenton反应机理为:当溶液中存在H2O2时,Fe3O4纳米颗粒表面的Fe2+和Fe3+与H2O2发生如方程式(1)和(3)所示的反应,生成的·OH和HO2·等自由基均为氧化剂,它们可以无选择性地氧化降解有机污染物[36]。另有研究[37-38]也得出了类似的结论:Fe3O4-H2O2类Fenton体系降解污染物过程是Fe3O4中Fe2+与H2O2发生反应生成·OH,如方程(1)所示,而后·OH能够进一步氧化降解污染物,如方程(4)所示。
(3)

(4)

图 7 Fe3O4-H2O2降解SMZ的回收循环实验
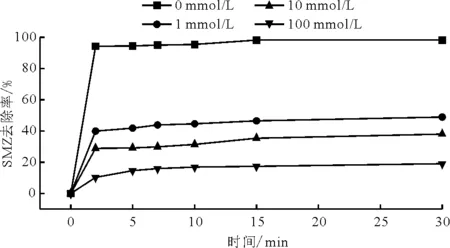
图8 不同TBA浓度下SMZ的降解效果
唐和清等[39]的研究表明,采用溶剂热法制备的Fe3O4纳米颗粒具有较大的比表面积,比表面积越大,其与污染物接触面积越大,降解效率越高。降解反应完成后纳米Fe3O4可通过磁分离从环境中去除而没有铁离子溶出。因此,磁性纳米Fe3O4-H2O2体系不仅对污染物的降解效率高,而且不产生二次污染,是可投入实际运用的环境友好型污染物氧化体系。
4 结 论
(1)通过溶剂热法成功制备了Fe3O4纳米颗粒,其呈规则的微球状,尺寸在200~250 nm之间,且具有较强的顺磁性。
(2)纳米Fe3O4-H2O2体系能够有效地降解水中的SMZ,且溶液初始pH值、H2O2浓度及催化剂Fe3O4的用量显著影响SMZ的降解率,20 mg/L的SMZ在pH=3、H2O2浓度为5.0 μL/mL及催化剂用量为1.0 g/L时达到最佳降解效果,在5 min时降解率达到92.5%。
(3)当反应体系添加叔丁醇后,SMZ的降解率明显下降,说明·OH是纳米Fe3O4-H2O2体系的主要活性基团,且该反应体系降解SMZ属于类Fenton反应。
(4)循环实验表明,所制备的Fe3O4纳米颗粒具有较好的稳定性。该材料的稳定性、可回收利用性及对SMZ良好的降解性能表明该材料可望用于去除实际水体中的SMZ。
