胸腺素 β4和 β10表达促进小鼠乳腺癌细胞转移
2018-11-20石荣珍邓九零邵锦晖高建莉
马 丽,石荣珍,邓九零,邵锦晖,高建莉
(浙江中医药大学,浙江杭州 310053)
乳腺癌是最常见的恶性肿瘤之一,近年来我国乳腺癌的发病率逐年上升,严重危害了女性健康。乳腺癌早期不具有典型的症状及体征,一旦发现往往已处于晚期。乳腺癌的远处转移是引起患者死亡的最重要原因。乳腺癌一般通过淋巴结转移、血道转移及直接蔓延转移至肺、骨、肝等器官,转移过程迅速。因此,研究乳腺癌转移机制具有重要意义。
胸腺素最早是从小牛胸腺中提取获得的一组小分子多肽,分为α,β和γ家族,其中胸腺素β4(thy⁃mosin β4,Tβ4)和Tβ10是Tβ家族中的2类,是由多个氨基酸残基组成的肌动蛋白单体结合蛋白[1-2]。有文献报道,Tβ4和Tβ10在肺癌、肝癌、食管癌和结肠癌等多种恶性肿瘤组织中表达明显增强,且与肿瘤的转移及侵袭密切相关[3-4]。在肿瘤转移、血管生成、细胞凋亡和创伤愈合等多种生理病理过程中发挥重要作用。但Tβ4和Tβ10对乳腺癌的影响尚不清楚。
肿瘤转移过程极其复杂,涉及多种基因。大量资料证明,基质金属蛋白酶2(matrix metallopro⁃teinase-2,MMP2)和MMP9在胃癌、肺癌、子宫内膜癌及膀胱癌等恶性肿瘤组织中的表达显著上升,并与肿瘤细胞迁移有关[5];信号转导与转录活化因子3(signal transducers and activators of transcrip⁃tion 3,Stat3)能影响肿瘤细胞的增殖、迁移及侵袭;癌基因c-myc是调节肿瘤细胞生长的癌基因之一,可激活肿瘤细胞生长抑制基因;骨髓基质细胞衍生因子1(stromal cell-derived factor-1,Sdf1)是由骨髓基质细胞及其他相关细胞分泌的一种趋化因子,与肿瘤细胞增殖、浸润及定向迁移有关。本课题组前期研究发现,Tβ4和Tβ10在小鼠乳腺癌组织及正常组织中的表达水平存在显著差异,但关于Tβ4和Tβ10对小鼠乳腺癌增殖、转移及侵袭的影响目前尚未有相关报道。本研究旨在通过体内外实验探究Tβ4和Tβ10对小鼠乳腺癌转移的影响,并初步探索其可能的作用机制。
1 材料与方法
1.1 动物、细胞、试剂和仪器
雌性BALB/c裸小鼠,SPF级,4~6周龄18只,体质量14~16 g,许可证号码:SCXK(沪)2013-0016,上海西普尔必凯实验动物有限公司;饲养条件:温度 22~25℃,湿度 60%~80%,光照时间7∶00-19∶00,每日更换水、饲料和垫料。本实验内容经浙江中医药大学实验动物管理与伦理委员会通过,所有实验动物操作均按浙江省实验动物管理办法进行。小鼠乳腺癌细胞4T1和荧光素酶标记的4T1-Luc细胞由芝加哥大学何通川教授惠赠,细胞用DMEM完全培养基(含10%胎牛血清、青霉素1×105U·L-1和链霉素0.1 g·L-1),在37℃,饱和湿度及5%CO2的细胞培养箱内培养,每1~2 d按1∶4传代。
胎牛血清(批号:A66E00F,美国Gemini公司);DMEM培养基(批号:8117065,赛默飞世尔仪器有限公司);对照腺病毒(pENTER)、Tβ4过表达腺病毒(TMSB4X)和Tβ10过表达腺病毒(TMSB10)(山东维真生物科技有限公司),Tβ4检测引物,F:AGAAGCTTCCAGCAACCATGTCCGA;R:GCATTTTGGATCCTGCAAGACATCTT;Tβ10 检测引物,F:TGGCAGACAAACCAGACATGG,R:CGAAGAGGACGGGGGTAGG;胰蛋白酶(杭州吉诺生物医药技术有限公司);磷酸盐缓冲液粉末、青霉素-链霉素溶液、Hoechst 33258染色液(碧云天生物技术研究所);四甲偶氮唑蓝(methyl thiazolyltetrazolium,MTT)、二甲亚砜、聚凝胺(美国Sigma公司);甲紫(结晶紫,中国上海标本模型厂);异氟烷(深圳瑞沃德生命科技有限公司);乙酸(杭州化学试剂有限公司);甲醛溶液(上海凌峰化学试剂有限公司);基质胶、24孔板和Transwell小室(美国BD Biosciences公司)。培养板和培养皿(美国BD Falcon公司);BJ-2CD超净工作台(上海博讯实业有限公司);离心机(德国Eppendorf公司);MULTISKAN-FC酶标仪(美国Thermo公司);MCO-18AIC细胞培养箱(日本三洋公司);PMI-3000B荧光倒置显微镜(德国徕卡公司);7500型实时荧光定量PCR(美国ABI公司)。
1.2 MTT和甲紫法检测4T1细胞增殖
取对数生长期的4T1细胞,按每孔1×104均匀接种于96孔板,待细胞长至85%~90%,分别加入0.5 μL pENTER,TMSB4X或TMSB10病毒液,每孔加入2 μL聚凝胺以促进感染,每组3个复孔,培养24,48和72 h后,参照文献[6]中MTT法,测定每组吸光度(A)值,实验重复3次,计算细胞增殖抑制率。细胞增殖抑制率(%)=〔1-(TMSB4X 或TMSB10组A值-空白组A值)/(pENTER组A值-空白组A值)〕×100%。甲紫法检测4T1细胞增殖能力:取对数生长期的4T1细胞,按每孔5×104均匀接种于24孔板,待细胞长至85%~90%,分别加入2.5 μL pENTER,TMSB4X或TMSB10病毒液,每孔加入2 μL聚凝胺以促进感染,每组3个复孔,培养24,48和72 h,弃去培养液,每孔加入400 μL 0.2%结晶紫染液,室温染色30~40 min后弃去染料,干燥后每孔加500 μL 20%醋酸,摇床振荡10 min,用酶联免疫检测仪在波长560 nm处读取A值,实验重复3次,计算细胞增殖抑制率。
1.3 划痕法检测4T1细胞迁移能力
4T1按每孔5×104细胞均匀接种于24孔培养板内,过夜后,使用200 μL规格的枪头在板底划“一”字形划痕。每孔分别加入2.5 μL对应腺病毒,每孔加入7 μL聚凝胺提高感染率,培养24 h。弃培养液,显微镜下随机选取6个视野拍照,实验重复3次。细胞迁移率(%)=〔(0 h宽度-24 h宽度)/0 h宽度〕×100%。
1.4 Transwell法检测4T1细胞侵袭能力
不同腺病毒感染后的4T1细胞培养24 h,收集细胞并制备细胞悬液。参考文献[7]的方法,上室加5×1044T1细胞,下室加500 μL含3%FBS的培养液。培养箱中放20 h后,取出小室并擦去小室内部的基质胶和未迁移细胞,多聚甲醛固定20 min,Hoechst33258染色30 min,取下小室底部薄膜,显微镜下每组随机选取5个视野拍照计数穿孔细胞,计算侵入到下室的细胞数目。实验重复3次。
1.5 小鼠乳腺癌模型制备
选取健康BALB/c裸小鼠18只,2%异氟烷气雾麻醉小鼠后,于左侧倒数第2对乳腺脂肪垫皮下接种分别感染了对照腺病毒(pENTER组)、过表达Tβ4腺病毒(TMSB4X组)或Tβ10腺病毒(TMSB10组)腺病毒36 h的荧光素标记4T1细胞(每只1×106细胞),制备4T1乳腺癌小鼠模型[8]。造模成功后,每周于小鼠瘤体内注射10 μL对应腺病毒。每隔5 d用游标卡尺测量瘤体长径L(mm)和短径W(mm),计算瘤体积(V)。V(mm3)=(L+W)×L×W×0.2618。
1.6 小鼠活体荧光成像观察肿瘤生长和转移
造模成功后第7天开始,每周每只小鼠腹腔注射荧光素酶底物0.1 mL,自由活动5 min后放入吸入式麻醉机麻醉后进行活体荧光成像,检测小鼠肿瘤生长和转移(连续5周)。第35天,颈椎脱臼处死。剖取肺及肿瘤组织,肉眼观察脏器色泽、质地并称质量。肺组织用甲醛固定48 h后,计数肺组织表面转移灶数量,游标卡尺测量瘤灶大小,计算肺转移率。肺转移率(%)=(发生肺转移的小鼠数/每组小鼠总数)×100%。
1.7 RT-PCR检测4T1细胞MMP2,MMP9,Stat3,c-myc和Sdf1 mRNA水平
取1×1064T1细胞分别感染相应腺病毒24 h后,根据说明书用Trizol试剂分离提取细胞总RNA,逆转录得到cDNA。按说明书(2×SGFast PCR Master Mix)配制反应体系,每个样本设置3复孔,PCR仪进行扩增,扩增条件为:94℃ 15 s,53℃20 s,72℃ 41 s,共41个循环,75℃延伸3 min。基因相对表达用2-△△Ct计算,以GAPDH作为内参基因,引物序列见表1。

Tab.1 Sequence of primers
1.8 统计学分析
实验结果数据用表示。使用SPSS 19.0分析数据。通过单因素方差分析(one-way ANOVA)和t检验评估平均值差异的显著性,P<0.05表示差异有统计学意义。
2 结果
2.1 胸腺素 β4和 β10对4T1细胞增殖的影响
甲紫和MTT结果显示(图1,表2),Tβ4 和Tβ10过表达腺病毒作用4T1细胞24,48和72 h时,与pENTER组相比,TMSB4X和TMSB10组4T1细胞增殖及增殖抑制率无明显变化。
Fig.1 Effect of thymosin β4(T β 44)and T β10 on prolifer⁃ation of 4T1 cells by crystal violet viability assay.4T1 cells were infected with 2.5 μL control adenovirus (pENTER),Tβ4 overexpression adenovirus (TMSB4X)and Tβ10 overexpression adenovirus (TMSB10).Inhibition of cell proliferation was detected at 24,48 and 72 h,respectively.
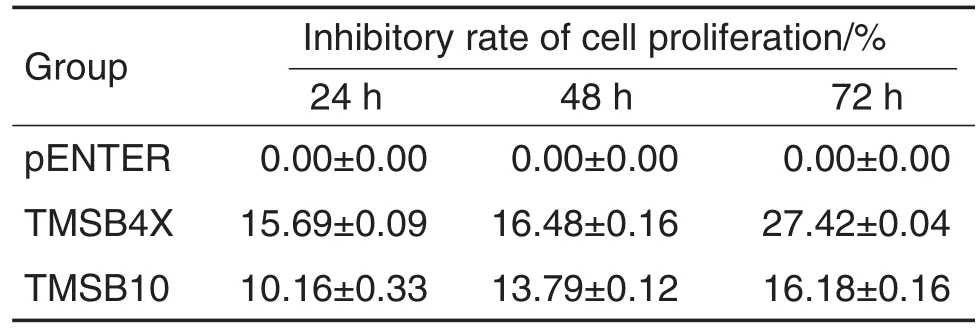
Tab.2 Effect of T β4 and T β10 on proliferation of 4T1 cells by MTT
2.2 胸腺素 β4和 β10对4T1细胞迁移能力的影响
划痕实验结果(图2)显示,不同腺病毒作用4T1细胞24 h后,对照pENTER组细胞迁移率为(22±7)%,TMSB4X和TMSB10组细胞迁移率分别为(36±6)%和(36±4)%(P<0.05),表明Tβ4和Tβ10明显促进了4T1细胞的迁移。
2.3 胸腺素 β4和 β10对4T1细胞侵袭能力的影响
Transwell法结果(图3)显示,不同腺病毒作用4T1细胞20 h后,pENTER组穿过小室的细胞数目为179±25,TMSB4X和TMSB10组穿过小室的细胞数目分别为197±30和230±27,差异无统计学意义,提示Tβ4和Tβ10对4T1细胞的侵袭无明显影响。
2.4 胸腺素 β4和 β10对乳腺癌模型小鼠4T1细胞生长和转移的影响
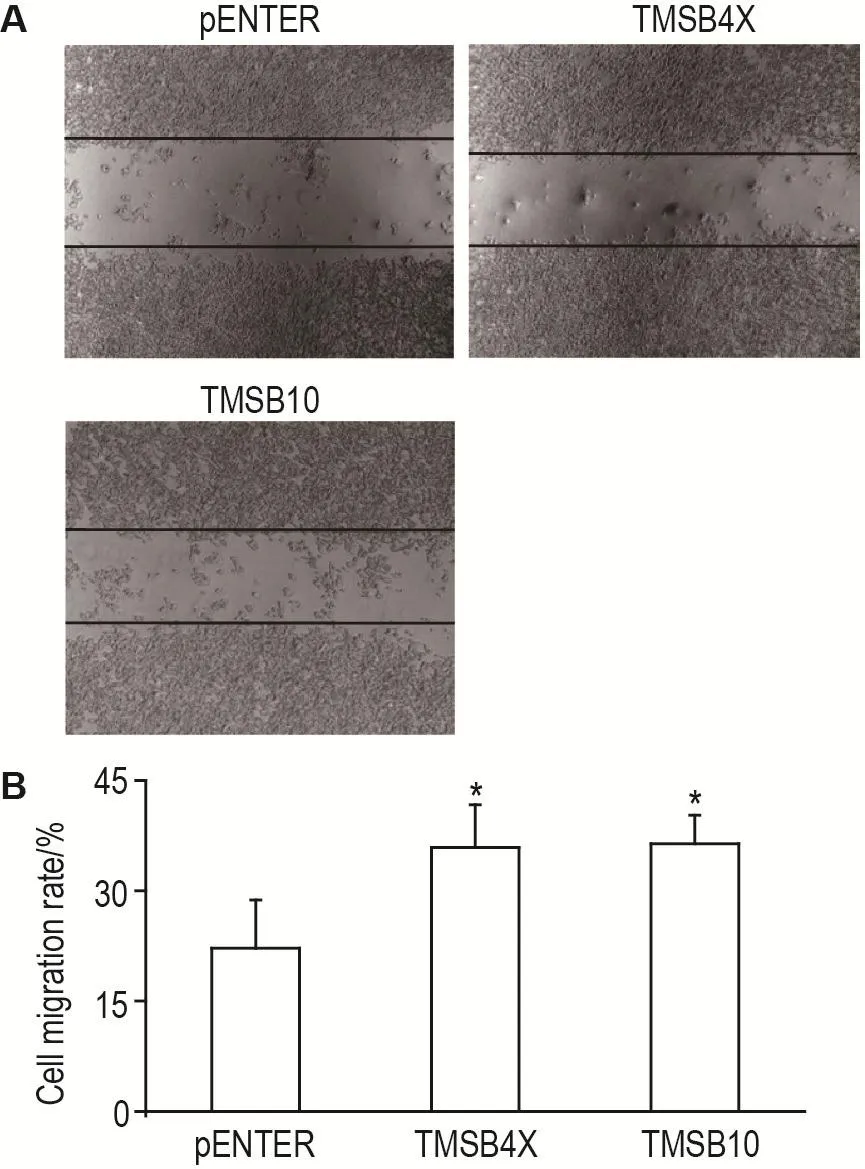
Fig.2 Effect of thymosin β4 and β10 on migration of 4T1 cells.See Fig.1 for cell treatment.Cell migration rate was detected at 24 h post infection.B was the semi-quantitative result of A.,n=3,*P<0.05,compared with pENTER group.
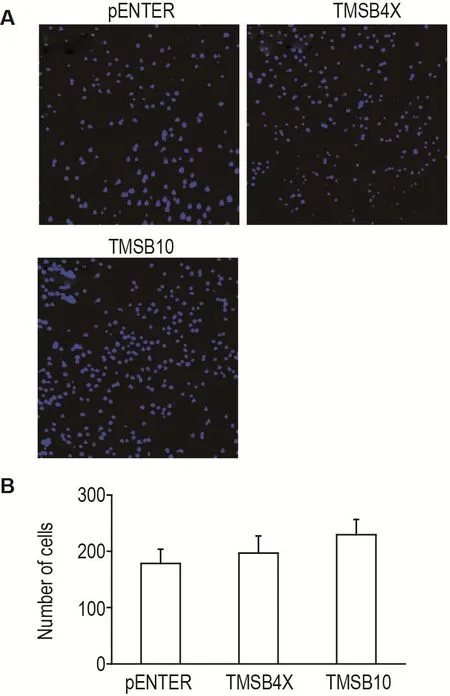
Fig.3 Effect of T β4 and T β10 on invasion of 4T1 cells.See Fig.1 for the cell treatment.Number of cells passing through Transwell was detected at 20 h.B was the semi-quantitative result of A.
乳腺癌模型小鼠实验结果(图4A)显示,各组小鼠瘤体积无统计学差异。小鼠活体荧光成像数据(图4B)显示,28 d时,pENTER组小鼠乳腺癌未出现转移,TMSB4X和TMSB10组小鼠乳腺癌开始出现转移。与pENTER组相比,TMSB4X和TMSB10组小鼠肺表面结节增多(P<0.05),肺转移率较高,但瘤质量变化无统计学意义(表3)。表明Tβ4和Tβ 10对小鼠乳腺癌转移具有促进作用。
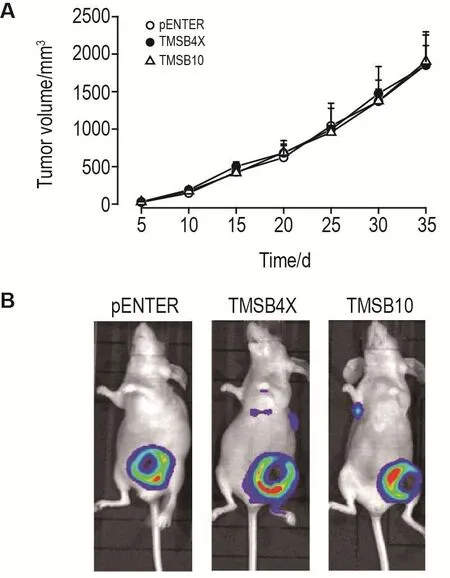
Fig.4 Effect of T β4 and T β10 on growth and metastasis of breast cancer in mice.Breast cancer mice were injected with 10 μL pENTER,TMSB4X,or TMSB10 per week for 5 weeks,Tumor volume was measured every 5 d,tumor growth and metastasis in mice were observed by bioluminescence imaging every week.A:Tumor volume;B:Bioluminescence imaging at 28 d.*P<0.05,compared with pENTER group.
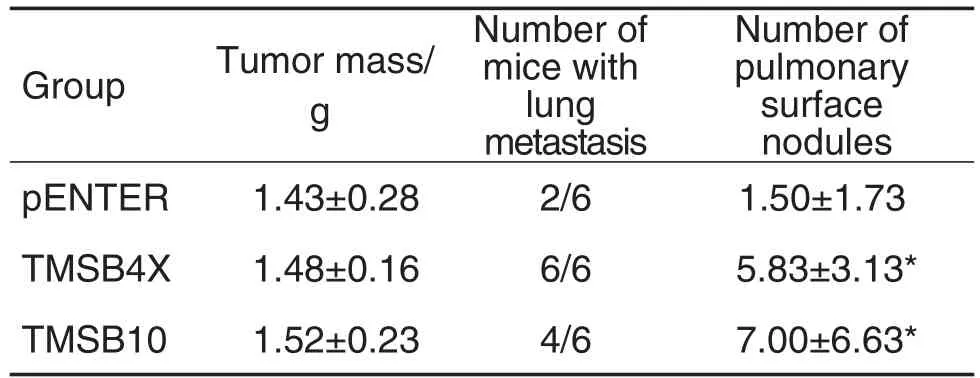
Tab.3 Effect of T β4 and T β10 on tumor mass,lung metastasis and pulmonary surface nodules of breast cancer in mice
2.5 胸腺素 β4和 β10对4T1细胞MMP2,MMP9,Stat3,c-myc和Sdf1 mRNA水平的影响
RT-PCR结果(图5)显示,不同腺病毒作用4T1细胞24 h后,与pENTER组相比,TMSB4X和TMSB10组4T1细胞MMP2,MMP9,Sdf1和Stat3mRNA水平显著上调(P<0.05,P<0.01),c-mycmRNA水平较pENTER组无差异。
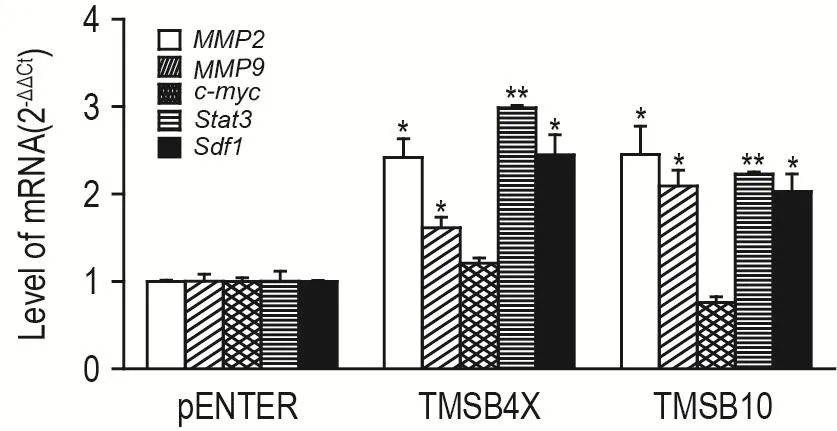
Fig.5 Effect of T β4 and T β10 on mRNA level of MMP2,MMP9,Stat3,c-myc and Sdf1 in 4T1 cells by RT-PCR.4T1 cells were infected with 12.5 μL pENTER,TMSB4X or TMSB10 for 24 h before detected.,n=3,*P<0.05,**P<0.01,compared with pENTER group.
3 讨论
本研究结果表明,Tβ4及Tβ10均显著促进小鼠乳腺癌的转移。两者体外均能促进4T1细胞的迁移,但对增殖和侵袭无显著影响。其促进乳腺癌转移的作用可能与上调MMP2,MMP9,Sdf1和Stat3mRNA水平有关。
在细胞水平研究发现,Tβ4能显著促进4T1细胞的迁移,对增殖和侵袭无显著影响。与以前报道的Tβ4可明显促进黑色素瘤B16-F10细胞的迁移、而对B16-F10细胞的侵袭及增殖无明显影响一致[9]。Ryu等[10]研究发现,Tβ4能诱导蛋白激酶磷酸化,进而负性调节糖原合成酶激酶3α、β连环素和E钙黏糖蛋白表达,促进胃癌细胞的迁移。Tβ4的肽链结构能与肌动蛋白结合,影响肿瘤细胞的运动[11]。Tβ4能够使细胞中E钙黏糖蛋白表达下调,β连环素表达增加,细胞间黏附性降低进而促进肿瘤细胞的生长[12]。但Tβ4对不同肿瘤细胞增殖的作用差异较大,机制尚不明确。有报道称,结肠SW480细胞中Tβ4过表达能导致细胞骨架中微丝结构的破坏,促进细胞大量增殖[13]。Tang等[14]发现Tβ4可能通过提高IQ基序三磷酸鸟苷酶激活蛋白1(IQ motif containing GTPase activating protein 1,IQGAPI)/整合素连接激酶(integrin-link kinase,ILK)复合物的水平激活Ras相关性C3肉毒毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)基因,从而促进结肠癌细胞的迁移。
Tβ4与Tβ10有85%同源性。本研究结果显示,Tβ10对4T1细胞的影响与Tβ4相似,Tβ10也能促进4T1细胞的迁移,而对增殖及侵袭无明显影响。据报道,Tβ10在乳腺癌、食管癌、黑色素瘤和结肠癌等癌组织中高表达,而在相应的正常或良性组织中则未见表达,其表达水平与乳腺癌、胰腺癌、甲状腺癌的转移能力和恶化程度呈正相关[15]。但也有学者发现,Tβ10过表达能抑制胆管癌细胞的迁移,而Tβ10沉默则能促进胆管癌细胞的迁移,其抑制作用与低表达的Tβ10激活Ras,上调细胞外信号调节激酶1/2(extracellular regulated kinase 1/2,ERK1/2)水平有关[16]。Tβ10在不同肿瘤细胞中的作用具有差异性,Tβ10肽链中部与Tβ4具有一致的保守序列,也能与肌动蛋白结合形成复合物来调节肌动蛋白纤维的组装,进而影响细胞骨架的重排,影响肿瘤细胞的运动[17]。细胞运动能力的增强是促进肿瘤细胞迁移的重要因素之一,肿瘤细胞转移潜能的增高伴有肌动蛋白多聚体的丢失和微丝结构的解聚,而Tβ10过表达与细胞骨架变化高度相关[18]。
小鼠乳腺癌模型的结果表明,TMSB4X和TMSB10组小鼠乳腺癌较早出现肺转移,且肺表面结节数较多。Kobayashi等[19]发现,Tβ4过表达的纤维肉瘤小鼠较Tβ4沉默的纤维肉瘤小鼠更易发生肿瘤远处转移Cha等[9]发现,Tβ4过表达较Tβ4沉默的B16-F10细胞所形成的肿瘤更易发生淋巴结转移。兰海燕[20]发现,Tβ10在正常乳腺组织及癌旁组织中不表达,而在乳腺癌癌细胞质中呈弥漫表达,与本研究结果一致。
本研究检测了几种与细胞迁移有关的基因的表达水平。结果显示,Tβ4和Tβ10均能够上调4T1细胞MMP2,MMP9和Sdf1mRNA的水平,显著上调Stat3mRNA的水平,对c-mycmRNA的水平无显著影响。MMP2和MMP9是细胞外基质重塑和肿瘤转移过程中的明胶酶,其上调与多种肿瘤的转移密切相关。MMP2与MMP9均能够促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的生成,其水平与胃癌淋巴结转移呈正相关[21]。MMP2和MMP9也可与星形细胞上调基因1(astro⁃cyte elevated gene-1,AEG-1)相互作用从而促进甲状腺癌的淋巴结转移[22]。Sdf1能与宫颈癌Hela细胞表达的蛋白聚糖4(syndecan-4)形成复合物,增加Hela细胞MMP9的水平[23],起到促进肿瘤转移的作用。有学者发现,Sdf1在非小细胞肺癌细胞中过表达,敲除Sdf1可以抑制肺A549细胞的生长和转移[24]。Stat3可通过抑制肿瘤细胞产生的促炎症反应细胞因子从而促进肿瘤的迁移[25]。据报道,Stat3能够促进黑色素瘤的转移,Stat3沉默可抑制黑色素瘤细胞的迁移[26]。以上结果说明,Tβ4与Tβ10促进乳腺癌细胞迁移并促进小鼠乳腺癌肺转移的作用,可能与其上调MMP,MMP9,Stat3和Sdf1水平有关。
肿瘤转移是多个信号通路参与的多阶段的复杂过程,肿瘤细胞经过黏附、降解、运动迁移和血管生成等生物学过程最终发生远处转移。有学者检测了大肠癌患者肿瘤组织及正常黏膜组织中Tβ4和VEGF基因的表达,发现二者的表达水平呈明显正相关,且在肿瘤组织中二者表达水平较高,说明Tβ4促进肿瘤的转移还可能与促进肿瘤血管的生成有关[27]。与Tβ4相似,Tβ10的过表达能够影响VEGF的生成进而影响肿瘤细胞的侵袭及转移[18]。体外实验发现,Tβ10通过干扰Ras抑制其下游信号通路,减少VEGF的生成,进而抑制血管生成。
本研究未能进一步研究Tβ4和Tβ10研究4T1细胞VEGF的影响及其及其与乳腺癌转移的关系,也未考察沉默Tβ4和Tβ10后乳腺癌转移的变化。上述内容值得进一步研究。总之,Tβ4和Tβ10过表达与小鼠乳腺癌转移及4T1细胞迁移有关,有望成为对抗乳腺癌转移的新治疗靶点,对开发抗乳腺癌药物的新型治疗策略具有重要意义。
