激活腺苷酸活化蛋白激酶 α在苯扎贝特抑制氧化低密度脂蛋白诱导血管内皮细胞炎症中的作用
2018-11-20叶伟祥黄志坚李秀研
李 骞,张 强,叶伟祥,黄志坚,李秀研
(福建医科大学附属泉州第一医院老年病科,福建泉州 362000)
心血管疾病已成为死亡的最常见原因[1]。在中国,每年有300万人死于心血管疾病,占死亡总人数>40%[2]。心血管疾病的高发病率以及高死亡率造成严重的家庭和社会问题。动脉粥样硬化(athero⁃scleros,AS)是常见的心血管疾病。研究证实,血管内皮功能障碍是AS以及多种心血管疾病发生发展的重要环节[3]。研究表明,氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导血管内皮细胞产生的炎症是导致AS发生的重要环节[4],提示通过抑制ox-LDL诱导的内皮细胞炎症可能是防治AS及其他心血管疾病的重要途径。
腺苷酸活化蛋白激酶(adenosine monophos⁃phate activated protein kinase,AMPK)不仅是细胞能量代谢的重要调节酶,而且在细胞炎症病理反应中也具有重要的调节作用[5]。AMPK激活后可显著抑制NF-κB的激活,降低炎症因子表达以及降低炎症细胞的迁移与粘连,是一种对细胞炎症反应起关键调节作用的靶点[6]。AMPK是由一个催化亚基(α)和2个调节亚基(β和γ)组成的三聚体酶复合物,其中AMPKα的作用最为关键。研究表明,目前临床广泛使用的抗AS治疗的药物,如二甲双胍能通过激活AMPK发挥保护心血管的作用[7],还可显著抑制脂多糖诱导的巨噬细胞肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的表达[8],此外,敲除AMPK可诱导血管内皮功能障碍和炎症[9]。因此,AMPKα可能是血管内皮炎症导致的心血管疾病特别是AS疾病的一个潜在的关键治疗靶点。
苯扎贝特(bezafibrate,BZF)是一种过氧化体增殖物激活型受体α(peroxisome proliferatorsactivated receptor-α,PPAR-α)的激活物,具有改善细胞线粒体功能和能量代谢的作用[10]。临床研究发现,BZF可以用于抗AS的治疗[11]。动物实验也表明,BZF能明显改善高脂饮食导致的小鼠的AS症状[12]。与此同时,也有研究表明,BZF通过激活PPAR-α蛋白在内皮细胞中发挥抗炎作用[13]。然而,目前未见关于细胞炎症反应关键调节靶点AMPKα在BZF抗ox-LDL诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)炎症反应中作用的研究报道。本研究采用ox-LDL诱导HUVEC炎症模型,探索AMPKα在BZF抑制ox-LDL诱导HUVEC炎症中的作用,进一步明确BZF防治内皮细胞炎症的作用机制。
1 材料与方法
1.1 细胞、试剂和主要仪器
EBM-2内皮细胞基础培养基套装(货号:CC-3162)购自瑞士Lonza公司;BZF(货号:213579,纯度>98%)购自百灵威科技;AMPKα抑制剂Compound C(CC)(货号:HY-13418A,纯度>98%)购自美国MCE公司;氧化低密度脂蛋白(货号:YB-002,2 g·L-1)购自广州奕源生物科技有限公司;总RNA提取试剂盒(货号:9767)、逆转录试剂盒(货号:RR047A)和荧光定量PCR(qPCR)试剂盒(货号:638319)购自日本TAkARa生物技术有限公司;TNF-α、白细胞介素6(interleukin-6,IL-6)、细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)的引物由美国Invitrogen公司合成;BCA蛋白定量试剂盒(货号:A53225)和ECL显影剂(货号:32106)购自美国Thermofisher公司;兔抗p-AMPKα(Thr-172,货号:50081)、AMPKα(货号:5832)、p-P65(Ser-536,货号:4886)和P65(货号:8242)多克隆抗体购自CST公司;兔抗GAPDH单克隆抗体(货号:ab181603)购自美国Abcam公司;小鼠抗TNF-α单克隆抗体(货号:BF0170)、兔抗IL-6(货号:DF6087)、ICAM-1(货号:AF6088)和VCAM-1(货号:DF6082)多克隆抗体购自美国Affinity公司。
1.2 HUVEC来源、培养和分组处理
原代HUVEC购自加拿大Cell Applications公司(货号:S200K-05n),用Lonza公司的EBM-2内皮细胞基础培养基套装,在37℃,5%CO2的细胞培养箱中培养,取第3~4代进行实验。药效实验分组为细胞对照组、ox-LDL 50 mg·L-1组、BZF 25,50 和100 μmol·L-1组。药物实验分组:细胞对照组,BZF 25,50 和 100 μmol·L-1组。验证实验分组:细胞对照组、ox-LDL 组、BZF 100 μmol·L-1组和 BZF 100 μmol·L-1+CC 5 μmol·L-1组。以上分组药物均为同时加入并作用24 h。
1.3 荧光定量PCR检测 TNF- α,IL-6,ICAM-1和VCAM-1 mRNA的表达水平
采用MiniBEST Universal RNA Extraction试剂盒提取细胞总RNA。采用PrimeScript™RT Master Mix进行逆转录反应,操作按试剂盒说明书进行。采用Integrated DNA Technologies公司的在线工具设计引物,退火温度(Tm)值均为60℃,引物序列见表1。采用SYBR®Fast qPCR Mix进行qPCR,反应在Roch480型实时qPCR系统中进行,每组实验重复3次。以GAPDH作为内参,反应结束后通过分析Ct值,采用 2-ΔΔCt法计算mRNA的相对表达水平。

Tab.1 Sequence of primers
1.4 Western蛋白印迹法检测TNF- α,IL-6,ICAM-1,VCAM-1,p-P65,P65,p-AMPK 和 AMPK α 表达水平
分组处理细胞24 h后,PBS洗1次,加入适量的RIPA裂解液裂解,提取总蛋白用BCA蛋白定量试剂盒定量,样品加入缓冲液,100℃,5 min变性,总蛋白上样量为20 μg,用10%的SDS-PAGE电泳分离,半干电转法将蛋白质转移至PVDF膜,5%脱脂奶粉于37℃封闭1 h后,分别用相应的一抗(TNF-α,1∶1000;IL-6,1∶1000;ICAM-1,1∶1000;VCAM-1,1∶1000;p-P65,1∶1000;P65,1∶1000;p-AMPKα,1∶1000;AMPKα,1∶1000;GAPDH,1∶10000)在4℃过夜,TBST洗膜3次后用二抗(1∶5000稀释)在室温孵育1 h,TBST洗膜3次后用ECL化学发光法检测蛋白质条带,用GAPDH蛋白条带作为内参,以目的条带和内参条带的积分吸光值比值表示蛋白的相对表达水平。
1.5 分子对接技术预测AMPK和BZF的相互关系
从PDB蛋白质数据库下载AMPK与AMPK激动剂A769662的蛋白三维结构(PDB ID:4QFR)用于当前的对接研究。从ZINC数据库中获取配体BZF的三维结构(ZINC ID:3956919)的结构。利用Autodock tools工具去除AMPK三维结构中的溶剂水分子和配体,根据已知的AMPK激动剂A769662结构特性找到AMPKα激动剂与AMPKα的结合部位。将BZF与AMPK进行柔性对接,采用结合力评估结合能力的大小。在每一个对接后,移动小分子的位置,使之最匹配,采用Pymol 1.3软件进行3D作图。
1.6 统计学分析
实验结果数据以表示,采用SPSS16.0软件进行统计分析。One-way ANOVA用于多重比较,方差齐性采用LSD进行两两比较,方差不齐性采用DunnettsT3进行两两比较,P<0.05认为差异具有统计学意义。
2 结果
2.1 BZF对ox-LDL诱导HUVEC炎症因子mRNA和蛋白表达水平的影响
与细胞对照组相比,ox-LDL显著增加HUVEC细胞中TNF-α,IL-6,ICAM-1和VCAM-1的表达(P<0.01)(图1A-D)。与ox-LDL组相比,BZF 25,50和100 μmol·L-1显著抑制ox-LDL诱导的TNF-α,IL-6,ICAM-1和VCAM-1 mRNA水平升高,其量效关系呈负相关(r=-0.978,P<0.05;r=-0.944,P<0.05;r=-0.929,P<0.05;r=-0.926,P<0.05)。
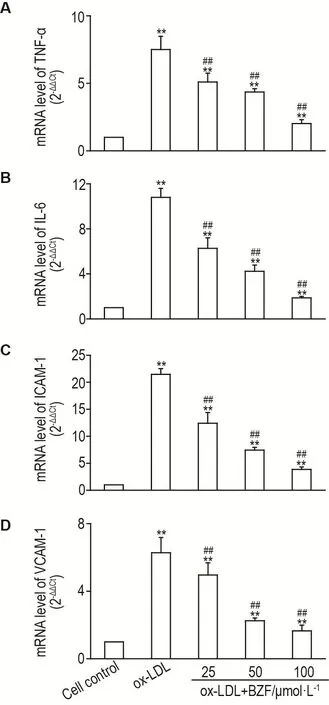
Fig.1 Bezafibrate(BFZ)inhibited mRNA expression of tumor necrosis factor- α(TNF- α)(A),IL-6(B),intercel⁃lular adhesion molecule-1(ICAM-1)(C)and vascular cell adhesion molecule-1(VCAM-1)(D)in oxidized low-density lipoprotein(ox-LDL)-induced human umbilical vein endothelial cells(HUVECs)by quantitative PCR(qPCR).HUVECs were incubated with ox-LDL 50 mg·L-1with or without BZF(25-100 μmol·L-1)for 24 h.,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with ox-LDL group.
与细胞对照组比较,ox-LDL显著升高HUVEC细胞中TNF-α,IL-6,ICAM-1,VCAM-1和p-P65蛋白的表达(P<0.01)(图2)。与 ox-LDL组相比,BZF 25,50和100 μmol·L-1显著抑制ox-LDL诱导的TNF-α表达升高(P<0.01),其量效关系呈负相关(r=-0.885,P<0.05);各浓度组的BZF显著抑制IL-6,其量效关系呈负相关(r=-0.997,P<0.05);各浓度组的BZF显著抑制ICAM-1,其量效关系呈负相关(r=-0.985,P<0.05);各浓度组的BZF显著抑制VCAM-1,其量效关系呈负相关(r=-0.875,P<0.05);各浓度组的BZF显著抑制p-P65,其量效关系呈负相关(r=-0.997,P<0.05)。
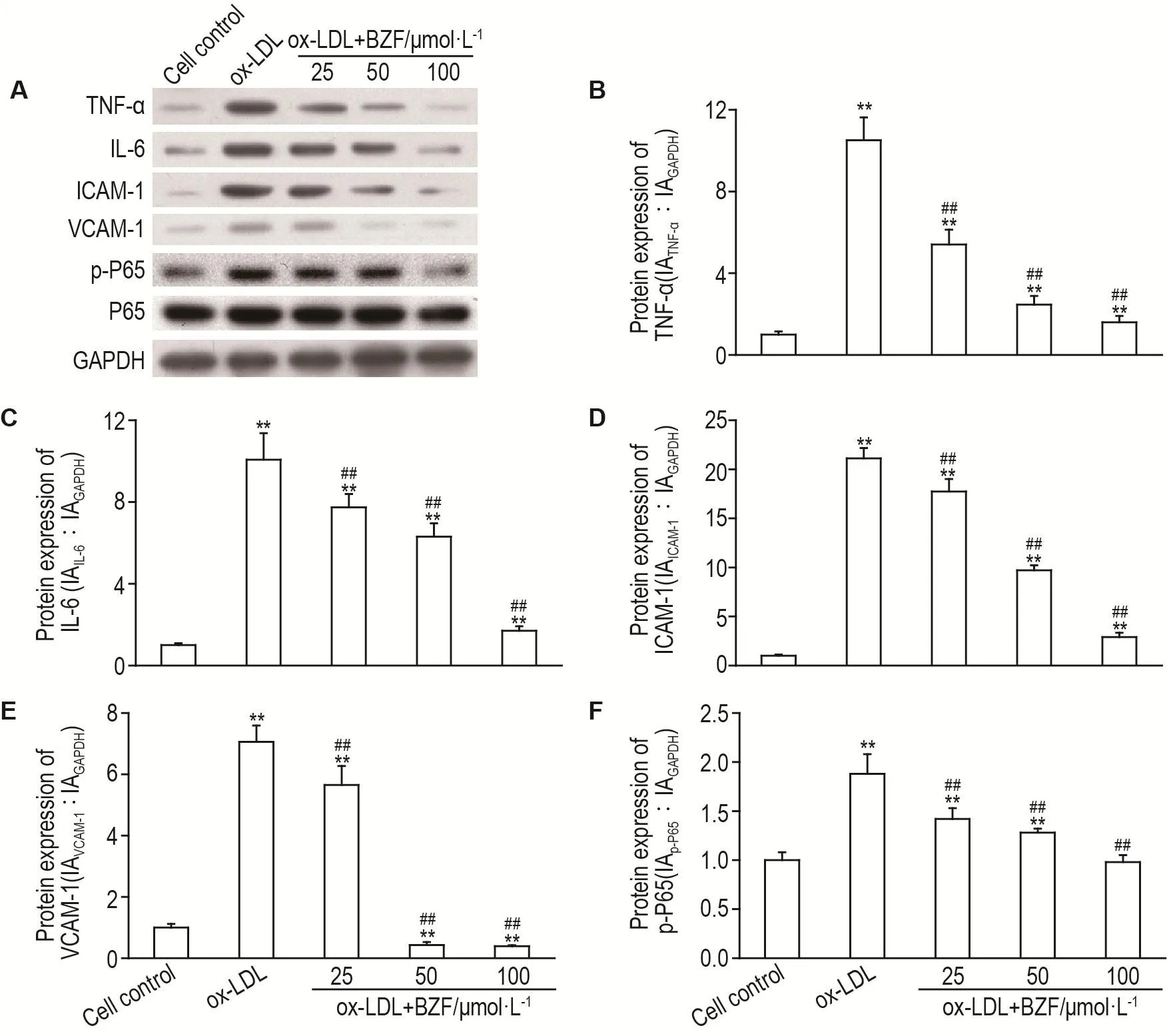
Fig.2 Effect of BFZ on protein expression levels of TNF- α(A,B),IL-6(A,C),ICAM-1(A,D),VCAM-1(A,E)and p-P65(A,F)in ox-LDL-induced HUVECs by Western blotting.See Fig.1 for the cell treatment.B-F were the semiquantitative results of A,respectively.,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with ox-LDL group.
2.2 BFZ与AMPK相互作用的分子对接
分子对接模拟显示AMPK与BZF的结合力为-8.66 kcal·mol-1。AMPK与BFZ结合构象表面模拟模型,BZF位于AMPK结合口袋之中,BZF与AMPK的氨基酸残基LYS-51形成氢键连接,氢键的长度为2.3 Å,与氨基酸残基ILE-46,ARG-83,ASN-48,LYS-31,LEU-18,GLY-19,VAL-11,THR-106,ASP108和VAL-113通过范德华力连接(图3)。
2.3 BZF对AMPK α磷酸化水平的影响
与细胞对照组相比较,BZF25,50和100μmol·L-1能显著升高HUVEC中p-AMPKα的含量(均P<0.01),其量效关系呈正相关(r=0.994,P<0.05)(图4)。
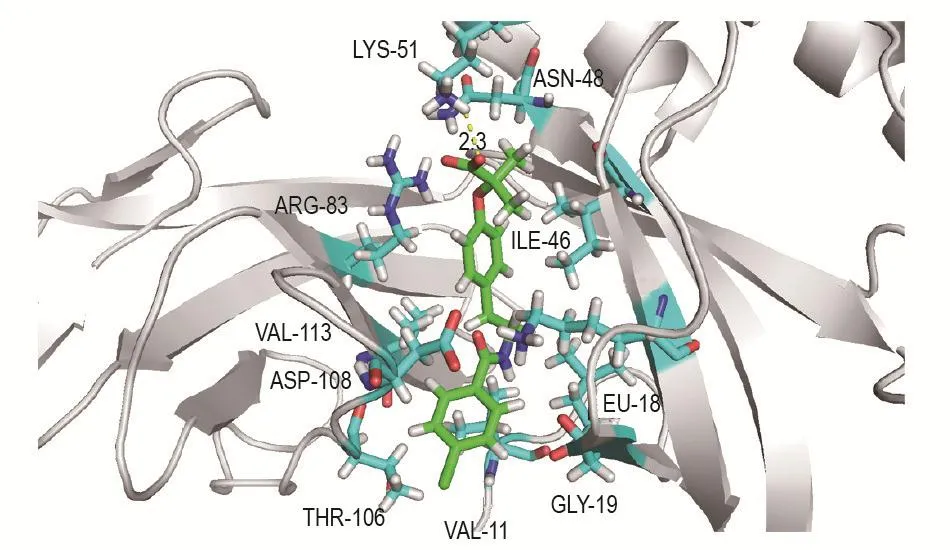
Fig.3 3D conformation of AMPK α-BFZ complex.ILE:isoleucine;ARG:arginine;ASN:asparagine;LYS:lysine;LEU:leucine;GLY:glycine;VAL:valine;THR:threonine;ASP:aspartic acid.
2.4 抑制AMPK α对BZF抗炎作用的影响
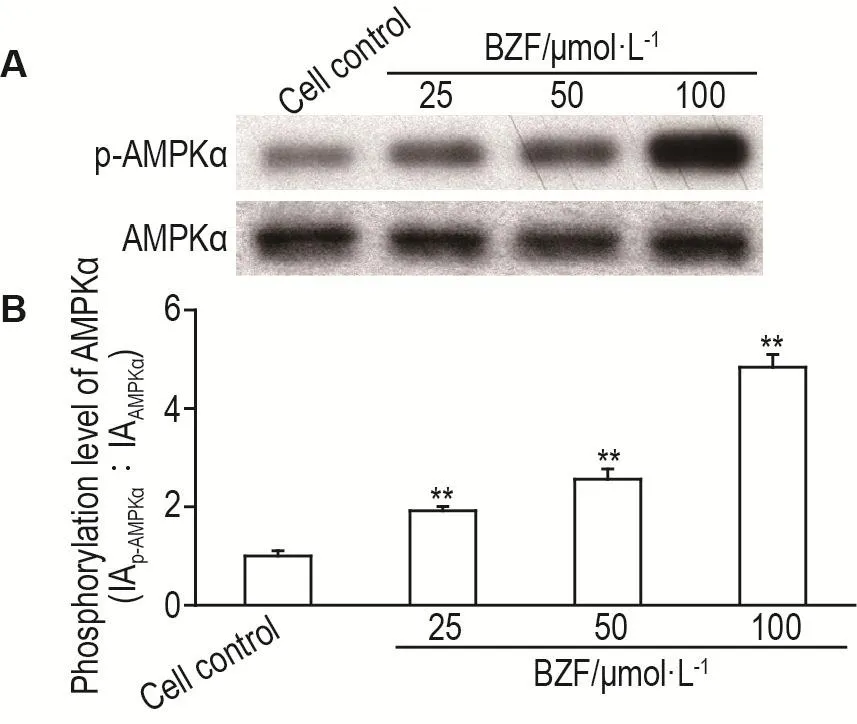
Fig.4 Effect of BZF on phosphorylation level of AMPK α by Western blotting.HUVECs were treated for 24 h.B was the semi-quantitative result of A.,n=3.**P<0.01,compared with cell control group.
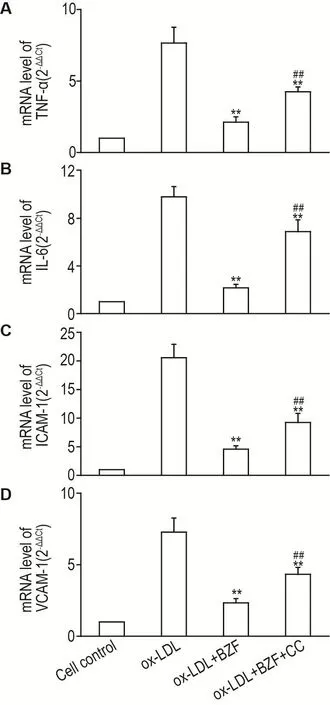
Fig.5 Inhibition of AMPK α partly abolished inhibitory effect of BZF on mRNA expression levels of TNF- α(A),IL-6(B),ICAM-1(C)and VCAM-1(D)in ox-LDL-induced HUVECs by qPCR.HUVECs were separately treated with ox-LDL (50 mg·L-1),ox-LDL (50 mg·L-1)+BZF (100 μmol·L-1)and ox-LDL (50 mg·L-1)+BZF (100 μmol·L-1)+CC (5 μmol·L-1)for 24 h.,n=3.**P<0.01,compared with ox-LDL group;##P<0.01,compared with ox-LDL+BZF group.
BZF100 μmol·L-1显著抑制 ox-LDL 诱导的TNF-α,IL-6,ICAM-1和VCAM-1的mRNA表达水平升高(P<0.01)(图5)。AMPK抑制剂CC与BZF共孵育HUVEC后,BZF对TNF-α的抑制率由72.3%降低至44.4%(P<0.01),对IL-6的抑制率由78.0%降低至29.8%(P<0.01),对ICAM-1的抑制率由77.8%降低至55.0%(P<0.01),对VCAM-1的抑制率由68.1%降低至40.6%(P<0.01)。
3 讨论
本研究发现,BZF具有抑制ox-LDL诱导的炎症因子TNF-α,IL-6,ICAM-1和VCAM-1表达的作用,提示BZF可能通过抑制ox-LDL诱导的内皮炎症起到防治AS的作用。NF-κB是调控细胞炎症的关键转录因子,其P65亚基的磷酸化是NF-κB激活的标志[15]。Western蛋白印迹实验结果显示,BZF能显著抑制ox-LDL诱导的P65磷酸化水平的升高,提示BZF的抗炎作用与抑制NF-κB激活有关。
既往研究证实,AMPK具有抗炎作用,其激活后通过直接降低NF-κB活性进一步抑制炎症因子表达[16]。本研究采用分子对接技术预测AMPK与BZF是否能发生空间结合,发现AMPK与BZF的结合力是-8.66 kcal·mol-1,提示AMPK可能与BZF发生空间结合。因此,进一步采用Western蛋白印迹法检测BZF对AMPKα磷酸化的影响。结果显示,BZF能显著升高AMPKα Thy-172位点的磷酸化水平。Thy-172位点的磷酸化是AMPK激活的标志。本研究表明,BZF可能是潜在的AMPK激动剂。目前研发出的AMPK小分子激动剂类药物,由于生物利用度低、非特异性作用等原因未能进入临床,如A-769662等[17]。因此,从上市药物中探索具有AMPK激动剂作用并用于防治AS及相关心血管疾病的有效药物,具有重要的临床意义。BZF是已上市药物,有较好的成药性,本研究结果为临床运用BZF激活AMPK提供了实验证据。
上述结果表明,BZF具有激活内皮细胞AMPK的作用。既往研究表明,BZF是核受体超家族成员PPAR受体的激动剂,PPAR被激活后可抑制多种炎症因子的表达[18]。为进一步探索激活AMPK在BZF抗炎中的作用,本研究采用AMPKα抑制剂CC特异性抑制AMPKα活性后,观察BZF的抗炎作用。当AMPKα活性被抑制后,BZF的对炎症因子及黏附分子表达的抑制作用显著降低。由此提示,AMPKα的激活在增强BZF抑制ox-LDL诱导HUVEC炎症反应中具有重要作用。
综上所述,BZF能抑制ox-LDL诱导的HUVEC炎症反应,BZF可能是一个潜在的AMPKα激动剂,其抗炎作用与AMPKα激活密切相关,提示激活AMPKα可能是BZF类药物防治AS以及其他心血管疾病的新靶点。
