柴胡皂苷b2通过抑制线粒体凋亡通路减轻过氧化氢诱导的L-02细胞损伤
2018-11-20高子涵王红伟吕行直何云霞王建刚李瑞芳
高子涵,王红伟,吕行直,何云霞,刘 玲,王建刚,李瑞芳
(河南科技大学1.医学院药学系,2.护理学院,河南洛阳 471023)
目前,我国肝病的患病率居高不下,诊断和治疗药物的疗效也不尽如意。急性肝损伤是多类严重性肝病发生发展的初始环节和共同历程。柴胡(Radix Bupleuri)在传统中医记载中常用于和解表里、疏肝解郁等。目前已应用于临床的柴胡制剂包括柴苓护肝颗粒、护肝片和护肝胶囊等[1],其有效成分柴胡皂苷(saikosaponin,SS)具有解热抗炎、免疫调节和保肝护肾等作用,且对肝的保护作用最佳[2-3]。SS的结构包括环氧醚型(如SS-a,-c和-d等)和异环双烯型(如SS-b1和-b2等),是五环三萜类齐墩果烷型衍生物[4]。其中SS-a,SS-c和SS-d有明显的护肝和抗肿瘤等药理作用[5-7],SS-d对实验性大鼠肝硬化有较强的抑制作用,还可调节免疫系统功能,抑制肿瘤的发生发展[5,8-9]。SS-b2是SS的主要药理活性成分之一,在柴胡中含量较低,在肝损伤防治方面的研究报道较少。本研究采用过氧化氢(H2O2)诱导L-02细胞损伤模型探讨SS-b2对肝细胞损伤的保护作用及其与线粒体凋亡相关的分子机制。
1 材料与方法
1.1 细胞、药品、试剂和仪器
正常人肝细胞L-02(中国科学院上海生命科学研究院细胞资源中心,本研究室保存传代)。SS-b2(纯度>99%,成都曼思特生物科技有限公司,17032104);RPMI 1640培养基、胎牛血清和胰蛋白酶(美国Gibco公司);H2O2、四甲基偶氮唑盐(MTT)、Hoechst33258、罗丹明123、BCA蛋白定量试剂盒、RIPA裂解液和ECL显色剂试剂盒(Sigma公司);AnnexinⅤ-FITC细胞凋亡检测试剂盒(美国BD公司);小鼠抗人Bcl-2、Bax、Cyt-c、β肌动蛋白、胱天蛋白酶9和胱天蛋白酶3单抗(美国Santa Cruz公司);辣根过氧化物酶标记的羊抗鼠IgG(武汉三鹰生物技术有限公司)。
细胞培养箱(美国Thermo Electron公司);SW-CJ-2J洁净工作台(苏州安泰空气技术有限公司);荧光显微镜及照相系统(日本Nikon公司);Bio-TekELX800酶标仪(美国Bio-Tek公司);BD accuri C6流式细胞仪(美国BD公司);DYY-11B型三恒电泳仪和DYCP-31DN型电泳仪(北京六一仪器厂);Clinx ChemiScope2850荧光及化学发光成像系统(美国伯乐公司)。
1.2 细胞培养
复苏的L-02细胞常规培养于含10%胎牛血清和1%双抗的RPMI 1640培养基中,于37℃,5%CO2细胞培养箱静置培养。2~3 d胰酶消化传代1次,全程在超净台中无菌操作。
1.3 MTT法检测细胞存活率
取对数生长期的L-02细胞,胰酶消化并计数,稀释后每孔5×103细胞接种于96孔培养板,倒置显微镜下观察,待细胞密度为70%~80%,分为正常对照组、模型组和SS-b2组,每组4复孔,实验重复3次。正常对照组和模型组给予等量培养液,SS-b2组分别加入SS-b2 12.5,25,50和100 mg·L-1(终浓度)预处理24 h后,除正常对照组外,其余各组再加入H2O2100 μmol·L-1继续孵育12 h,而后每孔加入20 μL MTT(5 g·L-1),4 h后弃培养上清液,再加入200 μL DMSO,避光振荡10 min,用酶标仪于波长490 nm处检测吸光度(A490nm)值。细胞存活率(%)=药物组A490nm/正常对照组A490nm×100%。
1.4 罗丹明123染色法检测L-02细胞线粒体膜电位变化
接种L-02细胞于6孔板,细胞分组与药物处理同1.3。吸出含药培养基,用PBS洗细胞3次,加入终浓度为100 μg·L-1罗丹明123染色液浸润细胞,37℃染色30 min,加细胞固定液1 mL,37℃固定1 h,最后滴加抗荧光衰减封片剂,于荧光显微镜下观察细胞绿色荧光强度(激发波长488 nm,发射波长530 nm),ImageJ荧光图像分析系统进行半定量分析。实验重复3次。
1.5 Hoechst33258染色观察L-02细胞凋亡
接种L-02细胞于6孔板,细胞分组与药物处理同1.3。弃含药培养液,每孔加细胞固定液(4%多聚 甲 醛)400 μL,室 温 固 定 10 min,PBS 洗3次,再加1 mL Triton X-100 5 g·L-1,室温5 min后PBS洗3次,最后加入Hoechst33258染色液(5 mg·L-1)1 mL,于37℃孵育5~10 min后吸去Hoechst33258染色液,PBS洗3次,每次5 min;用荧光显微镜(激发波长350 nm,发射波长360 nm)观察核固缩、核碎裂和高亮蓝色荧光等凋亡形态学特征,计数视野内凋亡细胞。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。实验重复3次。
1.6 流式细胞仪检测L-02细胞凋亡率
接种L-02细胞于6孔板,细胞分组与药物处理同1.3。吸出培养液,用PBS洗细胞2次,加入胰酶消化,用培养液终止消化并离心收集细胞,按照BD公司AnnexinⅤ-FITC细胞凋亡检测试剂盒操作步骤进行。用1×结合缓冲液〔HEPES/NaOH 0.1 mol·L-1(pH 7.4),NaCl 1.4 mol·L-1,CaCl225 mmol·L-1〕重悬细胞,使细胞密度为1×109L-1。取100 μL细胞悬液置5 mL培养管中,依次加入AnnexinⅤ-FITC(20 mg·L-1)和PI(50 mg·L-1)各5 μL,混匀。室温避光反应20 min,立即使用流式细胞仪检测细胞凋亡率。
1.7 Western蛋白印迹法检测细胞线粒体凋亡通路相关蛋白表达
接种L-02细胞于6孔板,细胞分组与药物处理同1.3。收集细胞并加入RIPA裂解液,提取各组细胞总蛋白,定量,经SDS-PAGE电泳后,将蛋白转至PVDF膜,5%脱脂奶粉37℃封闭1 h,分别加入抗β肌动蛋白、Bcl-2、Bax、Cyt-c、胱天蛋白酶9和3抗体(一抗)(均1∶1000),37℃孵育1 h;TBST洗3次后,加入二抗(1∶6000)于37℃孵育1 h,ECL发光显色,采用Gel-Pro analyzer4.0凝胶定量分析软件,对蛋白条带积分吸光度值进行半定量分析。以目的蛋白条带与内参蛋白条带积分吸光度的比值表示目的蛋白相对表达水平。
1.8 统计学分析
实验结果数据均以表示,用SPSS17.0分析软件进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用Tukey′s检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SS-b2对H2O2损伤的L-02细胞存活率的影响
H2O2100 μmol·L-1处理12 h后,模型组细胞存活率下降至(45.4±1.3)%(P<0.01);与模型组比较,SS-b2预处理24 h显著抑制H2O2所致的L-02细胞损伤,SS-b2 12.5,25,50和100 mg·L-1组细胞存活率分别上升至(51.6±1.4)%,(56.5±2.4)%,(64.4±1.5)%和(74.6±3.7)%(P<0.05,P<0.01),并呈浓度依赖性(r=0.9804,P<0.05)(表1)。
2.2 SS-b2对H2O2诱导的L-02细胞线粒体损伤的影响
罗丹明123在正常细胞中能依赖线粒体跨膜电位进入线粒体基质,胞浆荧光强度减弱或消失。细胞凋亡时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm)的崩溃,罗丹明123被释放出线粒体,从而胞浆发出强黄绿色荧光。与正常对照组相比,模型组细胞绿色荧光强度显著增强(P<0.01);SS-b2 12.5,25和50 mg·L-1组绿色荧光强度较模型组绿色荧光强度显著降低(P<0.01),提示SS-b2能减轻H2O2诱导的L-02细胞线粒体损伤(图1)。

Tab.1 Effect of saikosaponin-b2(SS-b2)on cell viability of L-02 cells treated with hydrogen peroxide(H2O2)
2.3 SS-b2对H2O2诱导的L-02细胞凋亡的影响
Hoechst33258染色结果(图2)显示,正常对照组细胞形态均一,细胞核呈圆形或椭圆形;模型组细胞核固缩,呈高亮蓝色荧光,细胞凋亡率明显升高(P<0.01);与模型组相比,SS-b2 12.5,25和50 mg·L-1组细胞核固缩现象明显减轻,细胞凋亡率降低(P<0.05,P<0.01),且呈浓度依赖关系(r=0.8193,P<0.05)。
流式细胞检测结果(图3)显示,模型组细胞凋亡率较正常对照组明显升高〔(68.4±6.3)%vs(3.5±1.6)%〕(P<0.01);与模型组比较,SS-b2 12.5,25和50 mg·L-1组细胞凋亡率分别降为(64.8±5.4)%,(47.9±3.4)%和(44.3±3.5)%,其中SS-b2 25和50 mg·L-1组差异有统计学意义(P<0.01),提示SS-b2对H2O2诱导的L-02细胞凋亡有一定的抑制作用。
2.4 SS-b2对L-02细胞线粒体凋亡通路相关蛋白的影响
与正常对照组比较,模型组细胞Bax(P<0.01),Cyt-c(P<0.01),胱天蛋白酶9(P<0.05)和3(P<0.05)蛋白表达显著升高,而Bcl-2蛋白表达显著降低(P<0.01);与模型组相比,SS-b2 12.5,25和50 mg·L-1组Bax,胱天蛋白酶9和3蛋白表达显著降低(P<0.01),SS-b2 25和50 mg·L-1组Cyt-c蛋白表达显著降低(P<0.01),而SS-b2 12.5,25和50 mg·L-1组Bcl-2蛋白表达显著升高(P<0.01),使Bcl-2/Bax的比值升高,且呈浓度依赖性(r=0.9417,P<0.01)(图5)。
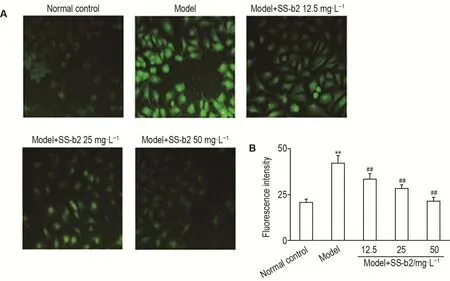
Fig.1 Effect of SS-b2 on mitochondrial injury of L-02 cells treated with H2O2by Rhodamine123 staining(×200).See Tab.1 for the cell treatment.B was the semi-quantitative result of A.,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with model group.

Fig.2 Effect of SS-b2 on apoptosis of L-02 cells treated with H2O2by Hoechst33258 staining(×200).See Tab.1 for the cell treatment.B was the semi-quantitative result of A.n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.

Fig.3 Effect of SS-b2 on apoptosis rate of L-02 cells treated with H2O2by flow cytometry.See Tab.1 for the cell treat⁃ment.B was the semi-quantitative result of A.,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with model group.

Fig.4 Effect of SS-b2 on expressions of apoptosis related proteins in L-02 cells treated with H2O2by Western blotting.See Tab.1 for the cell treatment.B-F were the semiquantitative results of A.G was ratio of Bcl-2 to Bax.,n=6.*P<0.05,**P<0.01,compared with normal control group;##P<0.01,compared with model group.
3 讨论
本研究以L-02细胞为研究对象,观察了SS-b2对H2O2诱导的体外肝细胞损伤的保护作用。结果发现,与H2O2损伤组相比,SS-b2可明显提高受损L-02细胞的存活率,减少H2O2引起的核固缩和核碎裂等凋亡形态改变,减少细胞凋亡。罗丹明123染色结果也表明,SS-b2能明显改善氧化应激引起的L02细胞线粒体损伤。
细胞代谢过程中产生一系列的活性氧(reac⁃tive oxygen species,ROS),包括氧自由基、H2O2及下游氧化产物等。研究发现,大量ROS可通过氧化应激反应诱导细胞功能紊乱甚至死亡[10]。H2O2可作为信使参与细胞内氧化还原途径,导致细胞凋亡[11]。H2O2具有膜渗透性,更易穿透细胞膜造成细胞损伤,引起线粒体膜电位下降。H2O2可活化线粒体通透转变通道,使线粒体膜通透性增加、孔道开放,线粒体内容物(如Cyt-c)进入细胞质,通过Apaf-1与胱天蛋白酶9形成凋亡小体,最终激活胱天蛋白酶3,诱导细胞凋亡[12]。本研究结果表明,H2O2处理后促凋亡蛋白Bax表达上调,而抗凋亡蛋白Bcl-2表达下调,Bcl-2/Bax比值降低,胱天蛋白酶3激活;SS-b2可升高Bcl-2/Bax比值,使线粒体凋亡通路相关蛋白Cyt-c、胱天蛋白酶9和胱天蛋白酶3的蛋白表达水平显著降低。
综上所述,SS-b2可明显减轻氧化应激导致的L-02细胞损伤,其机制可能与保护线粒体结构、减少线粒体凋亡及减轻细胞损伤有关。
