钙、锌离子存在下万古霉素与牛血清白蛋白的作用机制研究
2018-11-19任列香马建春霍宇平
任列香, 马建春, 霍宇平, 杨 斌
(吕梁学院化学化工系,山西 离石 033000)
万古霉素(vancomycin,以下简称VAC)属于一种强劲药效的糖肽类大分子抗生素物质,主要用于葡萄球菌(包括耐青霉素和耐新青霉素株)、难辨梭状芽孢杆菌等所致的系统感染和肠道感染性疾病的治疗,如,心内膜炎、伪膜性肠炎、败血症等。
蛋白质是人类生命的物质基础,约占人体总质量的18%,是一种具有生理功能的生物有机大分子,是构成细胞的基本有机体,是人体细胞和组织的重要组成部分,同时也是药物发挥药效的靶分子和重要载体物质[1-4]。血清白蛋白(serum albumin)是一种脊椎动物血液血浆中最丰富、最容易纯化的蛋白质,主要是在肝脏中合成,它在维持血液渗透压、体内代谢物质的运输和营养方面起着极其重要的作用,同时还能影响动脉血管的通透性。牛血清白蛋白(BSA),相对分子质量为66 000,其中,氮的含量约为16%,脂的含量约为0.2%,糖的含量约为0.08%。其组成成分主要包括581个氨基酸残基基团,其结构中还包含有特殊的二硫键基团和自由巯基基团,这种自由巯基基团极易与某些小分子物质结合。牛血清白蛋白可以作为一种稳定剂、限制酶或修饰酶的保护溶液和反应液。一些酶在添加了牛血清白蛋白后可显著提高其反应活性,所以也常将其作为负载型载体用于一些复合材料的制备和合成。牛血清白蛋白较容易得到,因此常被用作各种生化研究中人血红蛋白的替代物质。牛血清白蛋白同时也是药物发挥药效的靶分子和承载性物质,它可以在药物进入到生物有机体后直接参与药物在机体内的有效代谢和吸收。迄今为止,药物与机体内各种蛋白质的结合机制尚没有明确的解释。因此,在模拟生理条件下,经常在体外进行药物蛋白结合的测定。在研究药物与蛋白质相互作用时,牛血清白蛋白已经成为现阶段最热门的研究课题[5-10]。
当血清白蛋白与小的生物分子结合后,其性质会发生改变。分析彼此结合的两者性质的变化,能够判断其结构信息。与各种内源性或外源性物质的相互作用,对于了解这些小生物分子在体内和代谢途径中发挥作用具有重要意义,它为小生物分子的药理学和毒理学的研究提供了一定的基础。
鉴于此,本文通过荧光光谱法,考察研究了万古霉素与牛血清白蛋白在Ca2+和Zn2+存在下的相互作用机制,结果表明,其相互作用机制为静态猝灭机制,并通过计算得到在Ca2+、Zn2+存在下二者的结合常数,结果显示,Ca2+、Zn2+两种金属离子的存在对于万古霉素与牛血清白蛋白的相互作用基本无影响。
1 试剂及仪器
牛血清蛋白(BSA),浓度为1.1×10-5mol·L-1,sigma公司;万古霉素(VCM),浓度为1×10-3mol·L-1,合肥博美生物科技有限公司,用时稀释为5×10-4mol·L-1;氯化钙溶液,浓度为1.0×10-3mol·L-1;Tris-HCl缓冲溶液,pH=7.4。
本实验过程中所用水均为二次蒸馏水。
pHS-3C酸度计,上海佑科仪器仪表有限公司;F-380型荧光分光光度计,天津港东。
2 实验方法
主要采用荧光光谱法:设置激发波长为280 nm,发射波长为290 nm~450 nm,狭缝宽度为2.5 nm,在F-380型荧光分光光度计上记录290 nm~450 nm范围内的发射光谱。
准确移取1.5 mL 1.0×10-5mol·L-1的BSA于1 cm×1 cm四通比色皿中,测量其荧光发射光谱,在此基础上逐渐加入5.0×10-4mol·L-1的VCM溶液,继续测量BSA的荧光发射光谱。
准确移取1.5 mL 1.0×10-5mol·L-1的BSA和15 μL 1.0×10-3mol·L-1的CaCl2溶液,反应30 min后按照上述方法依次加入VCM溶液继续实验。
准确移取1.5 mL 1.0×10-5mol·L-1的BSA和15 μL 1.0×10-3mol·L-1的ZnCl2溶液,同上述方法进行实验。
3 结果与讨论
3.1 VCM及其在Ca2+、Zn2+存在下与BSA猝灭机制的确定
荧光猝灭是指溶液中猝灭体分子和荧光物质分子之间的相互作用导致荧光物质的激发态寿命缩短或荧光量子产率和荧光强度降低的一种相互作用机制。图1~图3分别为VCM与BSA相互作用的荧光发射猝灭图以及分别在Ca2+和Zn2+存在下VCM与BSA的相互作用荧光发射猝灭图。对比图1~图3可知,随着VCM浓度的增加,BSA的内源荧光强度有规律的降低,表明VCM与BSA之间发生了猝灭作用,并且,随着VCM浓度的增大,作用增强。从图2~图3中还可以看到,金属离子Ca2+、Zn2+的存在基本不影响VCM与BSA的作用,同时,BSA的最大发射峰值对应的波长基本不变,表明VCM对BSA的构象基本无影响。
根据Stern-Volmer方程[11-12]:F0/F=1+Kqτ0[Q]=1+KSV[Q],分别得到VCM与BSA以及在Ca2+和Zn2+存在下VCM与BSA作用的Stern-Volmer图,见第17页图4~图6。由图4可知,VCM与BSA作用的猝灭常数是KSV=2.4×104L·mol-1,因为生物分子的荧光寿命为10-8s,所以,VCM对BSA的动态猝灭速率常数Kq=2.4×1012L·mol-1·s-1。同理,由图5得到钙离子存在下VCM与BSA作用的猝灭速率常数为Kq=2.05×1012L·mol-1·s-1,由图6可得锌离子存在下VCM与BSA作用的猝灭速率常数为Kq=2.32×1012L·mol-1·s-1。而猝灭剂和各种生物分子的最大猝灭常数是2.0×1010L·mol-1·s-1,而这3个猝灭常数均远大于2.0×1010L·mol-1·s-1。因此,VCM在有、无金属离子的存在下,与BSA的作用均属于静态猝灭机制。

图1 万古霉素与BSA的荧光光谱猝灭图
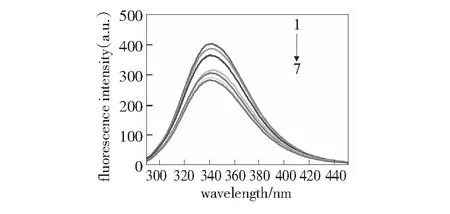
图2 钙离子存在下万古霉素与BSA的荧光光谱的猝灭图
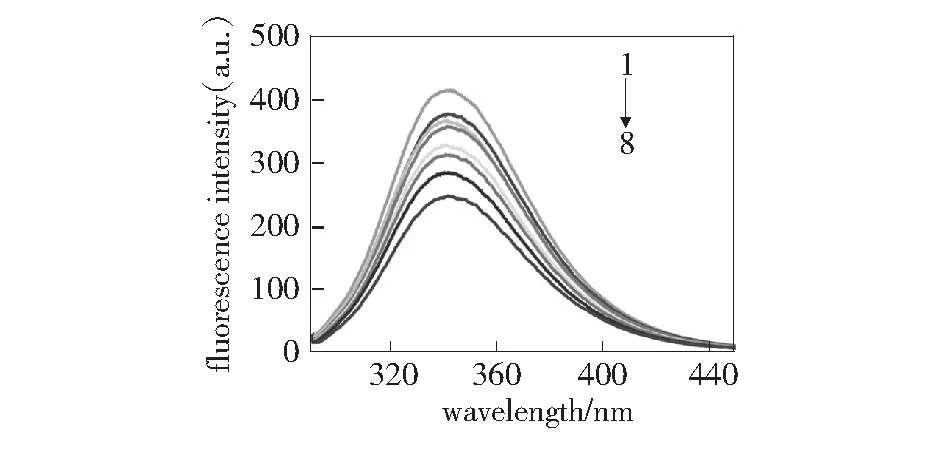
图3 锌离子存在下万古霉素与BSA的荧光光谱的猝灭图
3.2 VCM及其在Ca2+、Zn2+存在下与BSA结合位点数和结合常数的确定
研究大分子蛋白质与小分子药物结合时,测定其结合位点和结合常数非常重要,可以利用这些信息了解蛋白质与药物的最佳结合方式。当大分子蛋白质与小分子药物结合时,其结合位点数n与结合常数KA可以由式(1)求出[13]。
lg[(F0-F)/F]=lgKA+nlg[Q]
(1)
按照公式lg[(F0-F)/F]—lg[Q]作双对数曲线,拟合后可得第17页表1。由表1可知,金属离子Ca2+和Zn2+的存在,基本对VCM与BSA的结合作用无影响。表明金属离子Ca2+和Zn2+的存在不影响人体对药物VCM的吸收。

图4 万古霉素与BSA荧光猝灭的Stern-Volmer图

图5 钙离子存在下万古霉素与BSA
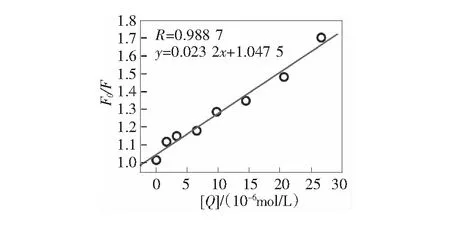
图6 锌离子存在下万古霉素与BSA
4 结论
综上所述,万古霉素VCM与牛血清白蛋白BSA以及在金属离子Ca2+和Zn2+存在下,VCM与BSA作用的荧光均猝灭,且猝灭过程属于静态猝灭。实验过程中VCM与BSA以络合比0.6∶1.0结合,结合常数为3.61×105L·mol-1。此外,还可得到金属离子Ca2+和Zn2+的存在基本对VCM与BSA的结合能力无影响,即不影响人体对药物VCM的吸收能力。
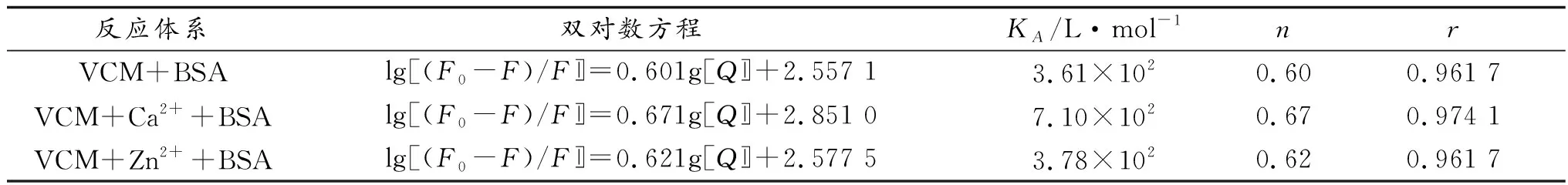
表1 VCM与BSA以及VCM+Mn++BSA的结合常数、结合位点、线性相关系数
