RhoA/Rho激酶信号通路在肺动脉高压中作用及尼索地平对其影响
2018-11-19杜梅素岳春景杜景霞邢台医学高等专科学校基础医学部河北邢台054000
杜梅素 岳春景 杜景霞 (邢台医学高等专科学校基础医学部,河北 邢台 054000)
肺动脉高压(PH)是一种以肺血管阻力持续升高及内膜重构、增生为主要表现的一组疾病总称,是心血管领域常见的临床综合征,具有较高的发病率及死亡率〔1〕,主要位于血管中膜的肺动脉平滑肌细胞(PASMCs)易受到异常因素的刺激而转化成合成型,并且从血管中膜转移至内膜进行异常增殖〔2〕。5-羟色胺(HT)主要分布在血小板致密体内,可以通过结合PASMCs上受体激活相应的信号转导机制来影响PASMCs增殖及凋亡,从而引起肺血管收缩〔3〕。Rho激酶(ROCK)能够对细胞增殖及周期变化进行调节,ROCK信号通路介导的各细胞功能在PH发生发展中起重要作用。该信号通路的激活主要与胞质内Ca2+浓度、钙调蛋白有关〔4〕,在目前应用广泛的抗 PH药物中,钙拮抗剂属于较为常用的药物之一,尼索地平(Nis)为二氢吡啶类钙拮抗剂,因此推测Nis是ROCK通路激活的重要抑制物质。本文观察ROCK信号通路在5-HT诱导的PASMCs增殖中变化及Nis对此变化的影响。
1 材料与方法
1.1 实验动物 健康雄性Wistar大鼠20只,体重200 g,由河北医科大学实验动物中心提供。
1.2 实验试剂 5-HT(Sigma公司,美国),DEMF/F12培养基、胎牛血清(Gibco公司,美国),胰蛋白酶(Amersco公司,美国),MTT(Serva公司,德国),磷酸化肌球蛋白磷酸酶靶亚基(MYPT)1、p-MYPT1抗体(Upstate公司,美国),二喹啉甲酸(BCA)蛋白定量试剂盒(PIERCE 公司,美国),RhoA、ROCK、β-action(捷瑞生物工程公司,中国)
1.3 PASMCs培养及鉴定〔5〕乌拉坦(20%,5 ml/kg)麻醉大鼠后将其断颈处死后迅速开胸处理,取出其肺组织后即刻在无菌条件下(超净工作台内)轻柔分离其肺动脉主干及肺动脉,解剖显微镜下用棉签将肺动脉周围组织剪去后剥除纤维外膜及内膜,用角膜剪将分离出的肺动脉中膜反复剪碎剪成约0.5 mm×1.0 mm的小块,将其平铺于培养瓶瓶底,待其均匀分布后进行原代培养,用含有20%胎牛血清的 DMFM-F12培养液在适宜环境下(37℃,5%CO2、21%O2、湿度 95%的培养箱内)静置培养约24 h。当原代培养的细胞形成细胞晕后将上悬液及组织碎块去除,在沉淀的细胞内加入胰蛋白酶消化法将原代培养细胞进行消化分离后传代培养。在同一视野内利用倒置显微镜观察分析相应的细胞形态,SP法进行α-actin免疫组化染色对培养的细胞进行鉴定,并且选取第3~6代生长状态良好的PASMCs进行后续实验。
1.4 MTT法检测PASMCs增殖 将已配制的细胞悬液浓度调节为每升2×107个细胞,96孔板中每孔接种200 μl并培养24 h,细胞周期同步化处理后将其随机分为对照组(1%胎牛血清培养基处理)、5-HT组(1%胎牛血清培养基中加入1 μmol/L的5-HT)及实验组(1、2、3、4 组)即 Nis 1×10-5mol/L、1×10-6mol/L、1×10-7mol/L、1×10-8mol/L 组,以上各组均设置 6 个平行孔。各实验组进行预处理,即先加入不同浓度的Nis,20 min 后加入 5-HT(1 μmol/L),等待 1 d 从而使PASMCs能够单层铺满孔底。完成后,每孔均加入MTT 液(5 g/L)20 μl,37℃孵育 4 h 后结束整个培养过程。吸出培养液,通过添加200 μl二甲基亚砜,并在室温环境下震荡10 min,从而能够溶解所有结晶,其中,假设波长为490 nm时测定吸光度值。
1.5 RT-PCR测定RhoA及ROCK mRNA的表达 将同步化处理后的细胞随机分组,分组方法同1.4,20 min后加入 5-HT(1 μmol/L)处理 30 min。完成后进行消化分离各组细胞,从NCBI基因数据库中下载大鼠 RhoA、ROCK及 β-actin基因 cDNA的序列,其RhoA、ROCK及β-actin的上下游PCR扩增引物采用Primer Premier5软件进行处理,同参考文献〔2〕。对已进行消化分离的各组细胞进行总RNA的分离提取,对1 μg量的总RNA进行逆转录,逆转录后取1 μg逆转录产物cDNA进行免疫荧光测定。其中,扩增条件为:95℃预变性4 min,94℃变性及53℃退火各40 s,72℃延伸90 s及10 min,共35个循环,重复3次。在进行目的基因的测定过程中测定产物的灰度值,并且各组扩增产物mRNA的表达量根据目标产物与β-actin的变化倍数确定。
1.6 Western印迹检测蛋白定量及MYPT1磷酸化水平 将同步化处理后的细胞随机分为5-HT(1 μmol/L)处理 0、5、15、30、60、120 和 180 min 组,以确定5-HT作用最敏感的时间点。将同步化处理后的细胞随机分组,分组方法同1.4,20 min后加入5-HT(1 μmol/L)处理15 min。处理结束后小心将培养液弃去,并且将100 μmol细胞裂解液RIPA加至各个培养皿中,1 μl的蛋白酶抑制剂,经超声处理2 min后置于冰上裂解60 min,通过在4℃下进行1 200 r/min离心20 min,将各组细胞的浆蛋白提取后运用BCA法(依据BCA试剂盒说明书)进行蛋白定量,运用裂解液将蛋白浓度规划至同一水平后,依次加入反应引物进行电泳、转膜和封闭,根据已测定的蛋白加样量将60 μg等量蛋白电泳凝胶分离,结束后将胶板取出并分离,后再经电转(300 mA,70 min)至4℃的聚偏二氟乙烯(PVDF)膜2 h,完成转膜后将 PVDF膜漂洗1 min,含5%脱脂奶粉的等渗缓冲盐溶液TBST在密闭的室温环境下静置1 h后注入一抗,并在环境温度4℃下静置一夜,在第二天通过洗膜液磷酸盐缓冲液(PBS)清洗10 min,重复3次,加入二抗后置于摇床上,在室温下静置1 h后,再次进行重复洗膜,每次10 min,重复3次,结束后扫描PVDF膜成像。运用相关软件(ChemiDoc XRS成像系统)对其蛋白进行测定,其结果以所检测蛋白灰度值与β-actin灰度值的比值来表示。MYPT1磷酸化水平通过 p-MYPT1与MYPT1的比值表示。
1.7 统计学方法 利用SPSS17.0软件进行t检验。
2 结果
2.1 Nis对5-HT诱导的大鼠PASMCs增殖的作用大鼠PASMCs形状呈长梭形,平行束状排列,呈波谷状生长。1 μmol/L的5-HT能促进PASMCs增殖,而不同浓度的Nis均能够抑制该种增殖,并且其抑制作用与Nis浓度相关,呈现出一定的浓度依赖性。
2.2 Nis对大鼠 PASMCs在5-HT作用下 RhoA及ROCK mRNA表达的影响 不同浓度Nis预处理均能降低5-HT诱导的PASMCs内RhoA及ROCK mRNA升高,并且这种浓度差异和降低程度有一定关系,差异有统计学意义(P<0.05)。1×10-8mol/L的 Nis对ROCK mRNA表达仍有一定的降低作用,且差异有统计学意义(P<0.05),见表1。
表1 各组RhoA及ROCK mRNA表达(,n=6)

表1 各组RhoA及ROCK mRNA表达(,n=6)
与对照组相比:1)P<0.05,与5-HT组相比:2)P<0.05;表2同
组别 RhoA/β-actin ROCK/β-actin对照组 1.316±0.046 2.502±0.043 5-HT 组 4.261±0.0271) 5.363±0.7201)实验1组 1.532±0.1122) 2.693±0.0362)实验2组 1.693±0.0962) 2.742±0.0672)实验3组 2.874±0.1062) 3.003±0.1072)实验4组 3.102±0.1362) 4.078±0.0572)
2.3 Nis对大鼠PASMCs在5-HT作用下MYPT1磷酸化水平的影响 5-HT作用下大鼠PASMCs中胞质染色均呈阳性表现,且作用15 min时,胞质染色阳性表现最强。Nis作用后,与5-HT作用15 min组相比PASMCs中胞质染色深度下降,呈弱阳性。PASMCs中p-MYPT1在5-HT组呈现出明显的增殖特征(P<0.05)。不同浓度Nis的预处理不同程度地降低了5-HT诱导的PASMCs内p-MYPT1表达,且差异有统计学意义(P<0.05),见表 2。
表2 各组MYPT1及磷酸化水平(,n=6)
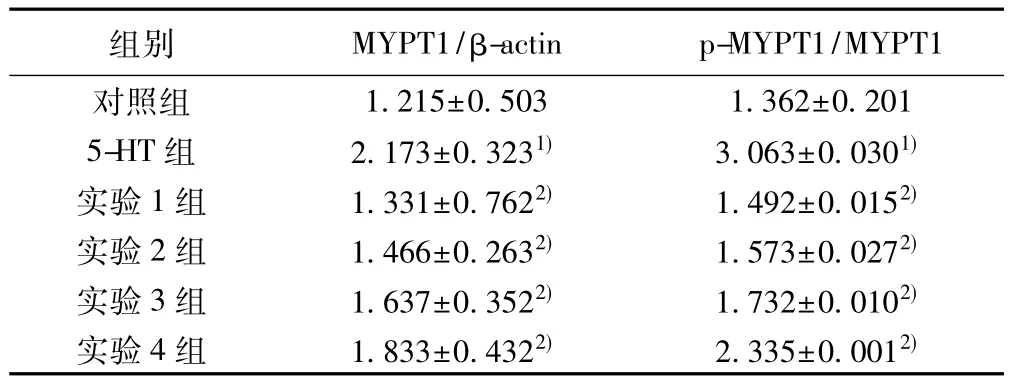
表2 各组MYPT1及磷酸化水平(,n=6)
组别 MYPT1/β-actin p-MYPT1/MYPT1对照组 1.215±0.503 1.362±0.201 5-HT 组 2.173±0.3231) 3.063±0.0301)实验1组 1.331±0.7622) 1.492±0.0152)实验2组 1.466±0.2632) 1.573±0.0272)实验3组 1.637±0.3522) 1.732±0.0102)实验4组 1.833±0.4322) 2.335±0.0012)
3 讨论
PH是在各种因素作用下以血管平滑肌细胞增殖、肥大从而引起血管重塑及肺血管阻力进行性升高为主要病理改变的一种原发或继发性疾病〔6〕。平滑肌细胞增殖等改变能够引起血管内径及管壁厚度随之发生与病理环境相适应的改变〔7〕,若这种改建超出机体生理性的承受范围,则会存在一定的危险性。因此,在一定程度上对PASMCs增殖改变进行抑制可以对肺血管重构起到改善的作用。
5-HT是生物体内的一种生物胺,能够通过相应受体诱发细胞内信号转导机制〔8〕,在它的介入下,酪氨酸激酶的活性得到提升,导致酪氨酸形成磷酸类化合物,最终加快了细胞有丝分裂的速度,从而调节PASMCs增殖与凋亡。在平滑肌细胞和肺血管内膜中有一种可以运载5-HT的膜蛋白,即5-HT转运体(5-HTT)。5-HT通过5-HTT主动转运使其进入细胞内,与相应受体结合后,使细胞内环境中Ca2+浓度明显升高,使其细胞增殖的相关信号被开启,这可能是其诱导形成PH的主要机制之一。本研究表明5-HT对PASMCs增殖有明显促进作用,也证实了以上观点。
RhoA主要通过与下游的效应分子Rho激酶相结合而发挥重要的作用〔9〕,对于广泛存在于体内各个组织细胞的RhoA/Rho激酶来说,由于其具有调节细胞增殖的功能,因此该信号通路被过度激活时能够诱发PASMCs发生有丝分裂或协同有丝分裂,平滑肌细胞增殖,从而导致肺血管的重构,同时肺血管阻力呈进行性增加。以往研究表明,RhoA蛋白活性增强的过程中,细胞内的钙调蛋白及Ca2+的浓度发挥了重要的作用,而 Ca2+充分扮演了第二信使的作用,能诱发PASMCs的兴奋-收缩耦联机制及兴奋-转录机制来调节肺血管的收缩及增加细胞因子的表达来促进肺血管重塑〔10,11〕。本实验中,5-HT 对于大鼠 PASMCs 内ROCK和RohA mRNA的表达具有增强作用,但Nis对这一现象有明显的抑制作用,并且该抑制作用与Nis自身浓度呈现出一定的相关性,与以往研究相符〔2〕。在RhoA的下游,ROCK不仅能够发挥靶效应,而且由于其活性得到激发,还能促使其下游的MYPT1产生磷酸性化合物,使其失去活性,并最终使得细胞的增殖、衰败、迁移及黏附等生物学行为和功能受到破坏〔12〕。因而,大鼠PASMCs内MYPT1磷酸化与ROCK活化程度有较大相关性。随着作用时间的增加,大鼠PASMCs内MYPT1磷酸化水平逐渐增加,这充分表明了在5-HT诱导PASMCs异常增殖的过程中,RhoA/Rho激酶信号通路发挥了重要作用,并且不同浓度的Nis均明显能够降低MYPT1的磷酸化程度,对ROCK活化起到了抑制作用,且在最低浓度的作用下其磷酸化水平仍有所下降,进一步证明了 Nis能够抑制RhoA/ROCK(RhoA/Rho激酶)信号通路的作用。
综上,5-HT作用下PH大鼠PASMCs存在增殖及RhoA/Rho激酶信号通路的异常表现,Nis能够抑制该细胞的异常增殖并调节信号通路的表达,防止肺血管重构。
