基因突变与中国原发性骨髓纤维化临床特征及预后
2018-11-19张正玲孙园园艾丽梅锦州医科大学附属第一医院血液内科辽宁锦州121001
张正玲 魏 巍 潘 静 孙园园 艾丽梅 (锦州医科大学附属第一医院血液内科,辽宁 锦州 121001)
ph阴性骨髓增殖性肿瘤(MPN)的典型代表包括真性红细胞增多症(PV)、原发性血小板增多症(ET)和原发性骨髓纤维化(PMF)〔1〕。许多研究结果表明,疾病进展和急性髓系白血病(AML)转化仍然是PMF患者预后不良的重要原因及治疗的重点和难点〔2~5〕。JAK2V617F和MPL515L是PMF患者最常见的常规分子改变事件,目前已被作为诊断和治疗的依据纳入新的PMF诊断标准〔6~8〕。最新研究发现 CALR突变常见于发生在JAK2突变或MPL突变阴性的PMF患者中〔9~12〕。研究表明,90%以上的 PV 患者,50%~70%的ET或PMF患者可检测到携带JAK2基因突变〔1,13~16〕;4%的ET 和8%PMF 患者携带有MPL515 基因突变〔17〕;15%~32%ET和25%~35%的PMF患者可见有 CALR-exon9插入或缺失突变〔18,19〕。但目前研究还没能完全解释携带何种基因突变的PMF患者更容易在治疗过程中出现疾病进展并最终导致不良预后〔16〕。国际上既往研究关于JAK2/CALR/MPL基因突变对PV、ET和PMF的临床特征、生存时间情况和继发 AML 影响的研究资料较多〔2,3,20〕,但有关 JAK2/CALR/MPL基因突变在中国PMF患者的特征及疾病进展预后中作用的报道较少。本研究在Bai等〔21~23〕研究前期工作的基础上,分析中国PMF患者JAK2/CALR/MPL基因突变与PMF临床特征和预后的相关性。
1 对象与方法
1.1 病例选择 回顾性分析1983年8月至2014年11月就诊于中国医学科学院血液病医院,年龄>18岁的PMF患者175例,男79例,女96例,中位年龄55(18~83)岁。PMF和AML的诊断标准均严格依据2008年世界卫生组织(WHO)标准〔13〕。所有患者通过门诊随访、电话随访或随访信件的方式进行信息确认。本研究获得锦州医科大学及中国医学科学院血液病医院伦理委员会批准,所有患者签署知情同意书。
1.2 等位基因特异性PCR检测JAK2V617F 应用巢式等位基因特异性PCR检测JAK2V617F突变情况。引物如下:P2:5'-CCTCAGAACGTTGATGGCA-3',P2r:5'-ATTGCTTTCCTTTTTCACAAGA-3',Pnf: 5'-AGCATTTGGTTTTAAATTATGGAGTATATG-3',Pmr:5'-GTTTTACTTACTCTCGTCTCCACAAAA-3'。PCR 产物用2.5%琼脂糖凝胶电泳后于紫外灯下分析,产物为453 bp、279 bp和 229 bp 3种类型。279 bp为JAK2V617F突变型产物,229 bp为野生型产物。当DNA样本含量较低时,先用引物 P1:5'-GATCTCCATATTCCAGGCTTACACA-3'和P1r:5'-TATTGTTTGGGCATTGTAACCTTCT-3'预扩增获得521 bp大小的产物,再取1 μl预扩增产物用上述巢式PCR进行二次扩增〔24〕。
1.3 Sanger测序 采用Sanger进行突变基因的序列测序检测JAK2外显子12,CALR外显子9,MPL外显子10编码序列突变。PCR扩增体系为 50 μl,含200 ng模板DNA、上下游引物各200 nmol,剩余体积用Platinum PCR Super Mix(Invitrogen)补足。PCR扩增条件为CALR:95℃ 5 min;94℃ 30 s,67℃ 30s(每循环降低 1℃),72℃ 30 s,10 个循环;94℃ 30 s,57℃ 30 s,72℃ 30 s,29个循环;72℃ 10 min;10℃保存。MPL和JAK2:95℃ 10 min;95℃ 30 s,55℃30 s,72℃ 30 s,40个循环;72℃ 10 min;JAK2V617F:95℃ 5 min;95℃30 s,54℃ 25 s,72℃ 30 s,35 个循环;72℃ 10 min,PCR产物由北京天一辉远公司进行纯化测序,测序结果应用DNASIS MAX软件进行分析,所有突变样品用正常基因序列进行证实。
1.4 分组 根据临床诊断和基因突变类型将PMF患者分为 CALR突变的 PMF(CALR组)18例;JAK2V617F突变的PMF(JAK2V167组)88例;CALR/JAK2/MPL基因突变全阴(三阴组)的PMF 64例共3组(MPL突变仅5例,未统计)。
1.5 统计学分析 PMF患者总生存(OS)时间定义为诊断PMF至死亡或末次随访的时间。应用SPSS17.0软件进行分析;非正态分布数据应用中位数(范围)描述。定性变量用Fisher确切概率法;连续变量用独立样本t检验,影响PMF生存的危险因素,应用多因素Cox回归分析。
2 结果
2.1 PMF的总体临床特征 175例PMF患者中,中位随访时间5(1~25)年,预计生存时间15.2年,共34例死亡,死亡率为19.4%。175例患者年龄>60岁49例(28.0%),平均白细胞计数(WBC)为(13.13±12.76)×109/L,平均血红蛋白(Hb)为(107.98±27.30)g/L,平均血小板计数为(473.87±320.31)×109/L。继发AML的发生率为13.7%(34/175),染色体异常发生率为7.4%(13/175),Hb<100 g/L 69例(39.4%),WBC>11×109/L 25 例(14.3%),血小板>1 000×109/L 24 例(13.7%),外周幼稚细胞>1%106例(43.4%)。
12例单用羟基脲治疗,18例应用干扰素加羟基脲治疗,16例单用干扰素治疗,127例应用烷化剂、沙利度胺、雄激素等的治疗,2例应用中药(具体不详)治疗。24例(13.7%)PMF患者转化为AML。
2.2 JAK2V617F突变、CALR突变或基因突变三阴与PMF患者临床特征相关性 与JAK2V617F组比较,CALR组血小板稍高,Hb含量较低,WBC较低,但差异无统计学意义(P>0.05);三阴组表现为较低的Hb含量和较低的WBC(均P<0.001);对比三阴组,CALR组有较高的血小板数,较高的Hb含量及较高的WBC(P<0.05)。各组异常染色体核型发生率、白血病转化率差异无统计学意义(P>0.05)。三阴组死亡率明显高于JAK2V617F组和 CALR组(P<0.05),JAK2V617F组与CALR组差异无统计学意义(P=0.804),见表 1。
2.3 基因突变状态与PMF患者的生存情况 基因突变三阴的PMF患者生存最差。CALR组生存时间最长,为14.778年,JAK2V617F组次之,为14.757年,三阴组最短,为10.829年(图1)。相对JAK2V617F组、CALR组,三阴组生存时间较差(P=0.011,0.049);JAK2V617F组较CALR组生存差,但差异无统计学意义(P=0.734)。
Cox多因素分析显示,年龄>60岁(OR=0.270,95%CI:0.135~0.539,P<0.01);Hb<100 g/L(OR=0.986,95%CI:0.973~0.999,P=0.042);WBC>11×109/L(OR=2.377,95%CI:1.110~5.091,P=0.026);外周血幼稚细胞>1%(OR=0.844,95%CI:0.570~1.250,P=0.048)和基因突变三阴(OR=3.314;95%CI:1.657~6.626,P=0.001)是影响 PMF生存的不良危险因素。
表1 JAK2V617F突变、CALR突变、基因突变三阴与PMF的相关性()
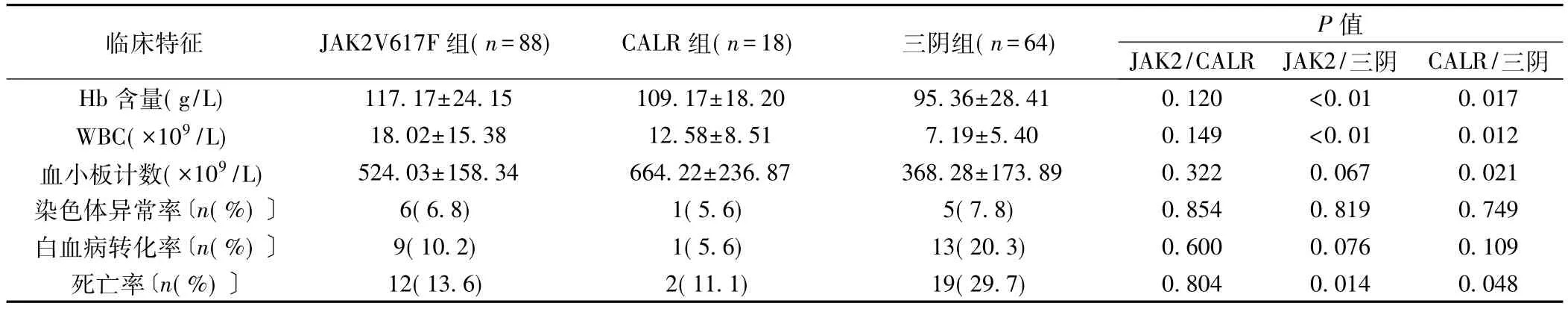
表1 JAK2V617F突变、CALR突变、基因突变三阴与PMF的相关性()
临床特征 JAK2V617F组(n=88) CALR组(n=18) 三阴组(n=64) P值JAK2/CALR JAK2/三阴 CALR/三阴Hb含量(g/L) 117.17±24.15 109.17±18.20 95.36±28.41 0.120 <0.01 0.017 WBC(×109/L) 18.02±15.38 12.58±8.51 7.19±5.40 0.149 <0.01 0.012血小板计数(×109/L) 524.03±158.34 664.22±236.87 368.28±173.89 0.322 0.067 0.021染色体异常率〔n(%)〕 6(6.8) 1(5.6) 5(7.8) 0.854 0.819 0.749白血病转化率〔n(%)〕 9(10.2) 1(5.6) 13(20.3) 0.600 0.076 0.109死亡率〔n(%)〕 12(13.6) 2(11.1) 19(29.7) 0.804 0.014 0.048
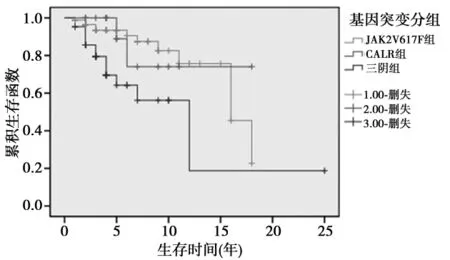
图1 不同基因突变类型PMF患者的生存曲线
3 讨论
Tefferi等〔25〕研究表明,CALR基因突变的PMF患者表现为较高的血小板数,较低的Hb计数和较好的生存时间〔18,19,26,27〕。基因突变三阴的 PMF 患者则具有较差的生存和较高的白血病转化率〔9,25,28〕。
本研究中不同基因突变的患者间生存情况与Tefferi等〔9,25,28〕的研究结果类似,即在中国 PMF 患者中,基因突变全阴的PMF患者预后最差,故基因突变三阴的PMF患者中可能存在其他基类型的基因突变,应加强基因突变全阴的PMF患者的干预和治疗强度。
本研究中,MPL突变在PMF患者中发生较低〔16〕,无法分析其与预后的相关性,故未纳入统计。原因可能有以下两点:一是所选取的病例数较少,存在一定偏差;二是MPL突变率较低可能是中国PMF患者的另一特征,下一步将扩大病例数进一步研究分析MPL突变对PMF患者临床及实验室特征的影响。
总之,将JAK2/CALR/MPL基因突变结合WHO标准的进行PMF诊断会更加精细,且基因突变检测对判断PMF预后及明确其发病的分子机制至关重要。下一步将进行JAK2V617F突变负荷检测,进一步明确不同突变负荷对PMF患者临床特征、疾病转化与预后的影响。
