老年脑恶性胶质瘤患者血清TGF-β和GFAP的表达及与临床预后的关系
2018-11-19张极星张淑荣黄丽娟王占强高凤全齐齐哈尔医学院附属第三医院神经外科黑龙江齐齐哈尔6000
张极星 张淑荣 赵 亮 黄丽娟 王占强 高凤全 (齐齐哈尔医学院附属第三医院神经外科,黑龙江 齐齐哈尔 6000)
脑胶质瘤约占颅脑肿瘤的60%,在颅脑各部位均可能发生。近年来老年患者的发病率逐年增加,且老年患者身体各项功能下降明显,化疗耐受力较差,常出现意识障碍、高热、肺部感染等并发症,预后较差〔1〕。根据世界卫生组织(WHO)分级将脑胶质瘤分为Ⅰ~Ⅳ级,其中Ⅲ~Ⅳ级为脑恶性胶质瘤〔2〕。手术是临床治疗脑恶性胶质瘤的关键,手术后同步进行放化疗具有较好的临床疗效,能有效改善患者的预后〔3〕。治疗后应及时随访患者的情况,观察是否存在复发的风险,进而及早进行干预延长患者的生命〔4〕。然而,术后病理组织取材较麻烦,因此寻找血清学标志物来监测患者的预后具有重要意义。血清胶质纤维酸性蛋白(GFAP)是一种星形胶质细胞的标志蛋白,当中枢神经系统损伤时会表达升高,脑胶质瘤患者GFAP也会明显升高,且具有较高的特异性〔5〕。转化生长因子(TGF)-β与多种肿瘤发生和发展存在较大关系,与脑恶性胶质瘤的发生、发展也存在一定关系〔6,7〕。本研究旨在分析脑恶性胶质瘤患者血清TGF-β和GFAP的表达及其与临床预后的关系。
1 资料与方法
1.1 一般资料 2011年1月至2014年1月选取齐齐哈尔医学院第三附属医院进行治疗的老年脑胶质瘤患者70例作为研究组。纳入标准:①年龄≥60岁;②均经病理确诊为脑胶质瘤;③分级为Ⅲ~Ⅳ级;④患者及家属均知情同意。排除标准:①不能耐受手术者;②术后未接受放化疗者;③存在其他部位恶性肿瘤者。研究组男37例,女33例,年龄60~78岁,平均(67.3±3.5)岁,随访3年,根据患者生存期分为预后良好组25例(生存期≥3年)和预后不良组45例(生存期<3年)。另选取健康体检者60例为对照组,其中男32例,女28例,年龄61~78岁,平均(66.9±3.2)岁。各组一般资料比较差异均无统计学意义(均P>0.05)。本研究经医学伦理委员会批准。
1.2 方法 所有患者行手术治疗,手术后2~4 w开始进行放化疗治疗,放化疗前行CT检查定位,根据手术残留肿瘤及术前水肿情况进行放疗治疗,给予电子直线加速器6MVX进行曲线60 Gy/30 F 95%剂量照射,2 Gy/次,每天1次,每周照射5 d,连续治疗6 w;放疗2 w后进行序贯化疗,口服替莫唑胺(江苏天士力帝益药业有限公司,国药准字H20040637,规格:50 mg)150~200 mg/m2,每天 1次,每周治疗5 d,4 w 为 1个疗程,共化疗6个疗程。
1.3 疗效评价标准 近期疗效采用WHO制定的实体瘤疗效评价标准进行判定,完全缓解(CR):病灶消失且无新的病灶出现,维持时间超过4 w;部分缓解(PR):病灶缩小50%以上且无新的病灶出现,维持时间超过4 w;稳定(SD):病灶缩小不足50%或增大不足25%,且无新的病灶出现;进展(PD):病灶增大超过25%或有新的病灶出现。
1.4 观察指标 术前、术后1 w、放化疗后清晨抽取两组空腹静脉血3 ml,3 000 r/min离心10 min,分离血清后放置在-20℃环境中待用。血清TGF-β、GFAP水平采用双抗体夹心法检测,应用上海生物技术有限公司提供的试剂,严格根据试剂说明进行操作。比较各组TGF-β、GFAP水平。放化疗结束后1个月分析不同疗效等级患者血清TGF-β、GFAP的差异。
1.5 统计学方法 应用SPSS17.0软件进行t检验、单因素方差分析。
2 结果
2.1 两组TGF-β、GFAP水平比较 研究组术前TGF-β、GFAP水平均明显高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 研究组不同时期TGF-β、GFAP水平比较 术后1 w TGF-β、GFAP水平显著低于术前,放化疗后显著低于术后1 w(P<0.05),见表1。
2.3 不同预后患者TGF-β、GFAP水平比较 预后良好组TGF-β、GFAP水平显著低于预后不良组,差异有统计学意义(P<0.05),见表2。
2.4 不同疗效等级患者血清TGF-β、GFAP水平比较研究组CR 30例,PR 15例,SD 14例,PD 11例。不同疗效等级患者血清TGF-β、GFAP水平整体比较差异有统计学意义(P<0.05);CR、PR、SD、PD患者血清TGF-β、GFAP水平呈增高趋势,两两比较差异均有统计学意义(P<0.05),见表3。
表1 两组TGF-β、GFAP水平比较(ng/L,)
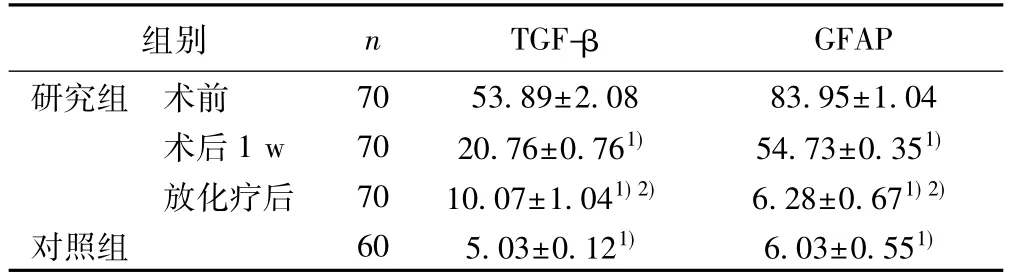
表1 两组TGF-β、GFAP水平比较(ng/L,)
与研究组术前比较:1)P<0.05;与术后1 w比较:2)P<0.05
组别 n TGF-β GFAP研究组 术前 70 53.89±2.08 83.95±1.04术后 1 w 70 20.76±0.761) 54.73±0.351)放化疗后 70 10.07±1.041)2) 6.28±0.671)2)对照组 60 5.03±0.121) 6.03±0.551)
表2 不同预后患者TGF-β、GFAP水平比较(ng/L,)
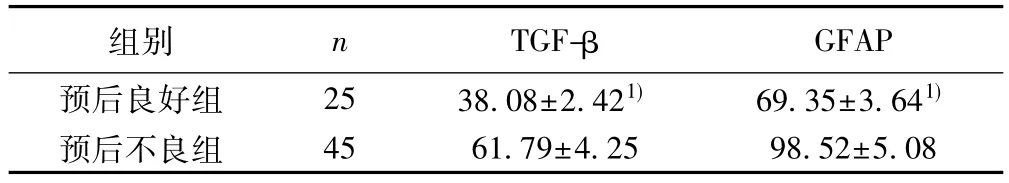
表2 不同预后患者TGF-β、GFAP水平比较(ng/L,)
与预后不良组比较:1)P<0.05
组别 n TGF-β GFAP预后良好组 25 38.08±2.421) 69.35±3.641)预后不良组 45 61.79±4.25 98.52±5.08
表3 不同疗效等级患者血清TGF-β、GFAP比较(ng/L,)
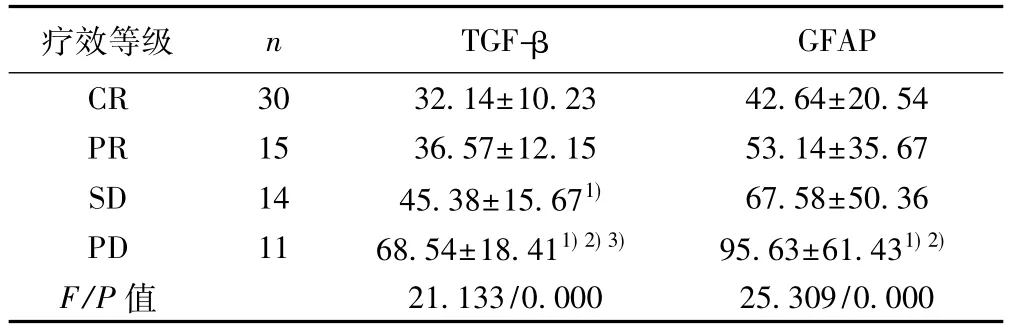
表3 不同疗效等级患者血清TGF-β、GFAP比较(ng/L,)
与CR比较:1)P<0.05;与 PR比较:2)P<0.05;与 SD比较:3)P<0.05
疗效等级 n TGF-β GFAP CR 30 32.14±10.23 42.64±20.54 PR 15 36.57±12.15 53.14±35.67 SD 14 45.38±15.671) 67.58±50.36 PD 11 68.54±18.411)2)3) 95.63±61.431)2)F/P值 21.133/0.000 25.309/0.000
3 讨论
脑恶性胶质瘤的生长生物学特征呈侵袭性,和正常的脑部组织较难区分,也无明显的差别,尤其是某些位置比较重要的肿瘤〔8〕。手术是临床上治疗脑恶性胶质瘤的重要方法,但是对于重要部位肿瘤较难完全切除,手术治疗效果较差,尤其对于老年患者。因此,手术后多给予放化疗综合治疗,以巩固术后治疗效果。且放化疗后需要密切监测患者的情况,降低肿瘤转移和复发的可能性,但是脑恶性胶质瘤术后病理取材较复杂,需要寻求重要的血清学指标来评价治疗效果,并观察患者的预后〔9〕。GFAP是星形胶质细胞的重要成分之一,主要由天冬氨酸和谷氨酸组成,于1971年首次从星形胶质细胞中分离,并逐渐被人们认知了解,作为星形胶质细胞的特异性标志物〔10,11〕。
近年来研究显示〔12〕,脑组织缺血损伤时GFAP水平升高,与脑组织缺血损伤后星形胶质细胞出现破坏有关。星形胶质细胞破坏后GFAP会被大量释放,导致脑积液中GFAP水平升高,通过血脑屏障进入血液,导致血清中GFAP水平升高〔13〕。脑恶性胶质瘤患者星型胶质细胞水平明显升高,GFAP水平也会明显升高,因此GFAP对脑恶性胶质细胞瘤具有诊断作用。TGF-β与血管生成具有较大关系,肿瘤形成和发展过程中会出现新生血管生成,肿瘤转移也会存在血管生成。检测TGF-β水平或可观察肿瘤发生和发展情况。本研究说明脑恶性胶质瘤患者血清中会出现TGF-β、GFAP水平升高,分析其原因为:脑恶性胶质瘤患者会出现星形胶质细胞大量增殖,而GFAP是星形胶质细胞的标志性物质,因此也会随之明显升高,脑恶性胶质瘤在发生和发展过程中会出现血管增殖,而TGF-β与血管增殖有关,因此脑恶性胶质瘤患者会出现TGF-β水平升高〔14,15〕。同时,本研究说明脑恶性胶质瘤患者治疗后会出现TGF-β、GFAP水平降低。在行手术或放化疗治疗后,肿瘤细胞会明显减少,且治疗效果越好,肿瘤缩小程度越大甚至可完全消失,因此GFAP作为星形胶质细胞标志性物质也会减少,肿瘤细胞减少血管也会随着减少,TGF-β水平也随之降低,且TGF-β、GFAP减少的程度与治疗效果有关。本研究还说明TGF-β、GFAP水平与脑恶性胶质瘤患者的预后有关,分析其原因为:脑恶性胶质瘤患者恶性程度较高,生长和转移速度也较快,患者预后也较差,生长和转移速度快患者 TGF-β、GFAP水平也会升高〔16〕,因此预后不良者TGF-β、GFAP水平明显高于预后良好者。另外本研究说明TGF-β、GFAP的表达与患者的近期疗效有关,进一步证明TGF-β、GFAP参与了脑恶性胶质瘤的发生、发展,但其具体机制仍需进一步研究明确。
