蓝藻的生消过程对镉污染沉积物的生物有效性
2018-11-19陈镜伊唐婉莹尹洪斌朱瑾灿
陈镜伊, 唐婉莹, 尹洪斌, 朱瑾灿
(1.南京理工大学化工学院,江苏南京 210094; 2.中国科学院南京地理与湖泊研究所/湖泊与环境国家重点实验室,江苏南京 210008)
随着人口的增长以及工业、农业的高速发展,人类日常生活污水和企业生产过程中产生的废水排放量逐年增加,其中往往含有大量重金属,若不经处理,这些重金属便会被悬浮颗粒物所吸附,最后流入湖泊,蓄积于沉积物中,因此沉积物又可以被称为重金属的蓄积地,对重金属的积累和释放起着举足轻重的作用[1-3]。由于沉积物重金属具有易富集、降解难、毒性大等特点,因此过量的重金属会对湖泊水质以及底栖生物的正常生命活动产生危害[4-5]。值得注意的是,沉积物中的重金属并非一直处于稳定状态,而是会随着周围的环境变化而发生相应的变化。例如,当水体处于好氧状态时,表层沉积物中重金属的可交换态会转化为铁锰氧化物结合态[6];当水体处于厌氧状态时,随着沉积物中高价铁、锰的还原,与之结合的重金属会释放到上覆水中,进而影响水质[7]。另有研究表明,沉积物再悬浮过程也会对沉积物重金属的形态转化以及沉积物-水界面重金属释放产生较大的影响。例如,还原态沉积物由于再悬浮而与氧气得到充分接触,使得沉积物中重金属的可氧化态含量降低,同时,再悬浮过程会加快溶解性重金属由沉积物向上覆水的释放速率,导致水体中重金属浓度快速增加[8]。
湖泊水体富营养化最直接的反映就是蓝藻暴发,蓝藻在暴发以及死亡期间会大量消耗水体中的氧气,造成局部厌氧,并可能导致沉积物形成厌氧环境,进而对沉积物重金属的生物地球化学过程产生影响。如孔明等认为,与铁锰氧化物结合的Pb会因蓝藻暴发之后造成水体严重缺氧而重新释放出来[9]。汤雨霖等研究表明,蓝藻在生长过程中会降低沉积物对Hg的固定效果,明显提高了水体中Hg的含量[10]。但是,目前大部分研究只关注到了蓝藻聚集、暴发以及死亡分解的单一过程对湖泊中重金属的影响,而没有考虑到蓝藻从生长到死亡的全部过程。实际上,湖泊中的蓝藻是经历了一个早期萌发、聚集腐烂以及后期复氧的过程,这个过程不仅会引起沉积物-水界面的溶解氧发生变化,还能够改变pH值、氧化还原电位等条件,从而对沉积物-水界面重金属的地球化学特征产生显著影响[11-12]。
长荡湖是位于江苏省常州市的浅水湖泊,平均水深约 1.2 m,面积89 km2,绝大部分处于金坛区[13],有关研究表明,长荡湖潜在生态风险严重,其中沉积物受镉的污染程度最大[14],除此之外,砷污染也比较严重,铬污染较轻微[15]。本研究以镉污染沉积物为研究对象,探究了蓝藻从生长、死亡至复氧过程对沉积物重金属(Cd)的生物有效性的影响,为蓝藻和重金属污染研究提供理论基础。
1 材料与方法
1.1 样品采集与处理
根据前期研究[16],采用大口径柱状采样器在长荡湖镉污染区域(31.640425°N,119.54084°E)采集沉积物芯样,然后往若干高50 cm、内径8 cm的洁净有机玻璃柱中推入高度为5 cm的沉积物,并在圆柱两端加塞密封。收集澄清湖水,用聚乙烯桶装载后与柱样一并小心带回实验室。
将采回的圆柱分为3组,每组4根,用以模拟蓝藻生长期、死亡期、复氧期3个阶段。用虹吸法沿着柱壁缓慢注入湖水,高度15 cm,随后将柱子放入配有循环泵的塑料槽中,在35 ℃条件下静置3 d备用。每组有蓝藻和无蓝藻均设置2个平行,即每组的前2根圆柱加入300 mL澄清湖水,后2根圆柱加入300 mL湖水和蓝藻混合物。
1.2 蓝藻模拟试验设计
蓝藻生长期:自加入湖水与蓝藻混合物之日起,每隔48 h取1次上覆水。试验进行的第3天在模拟生长期的沉积物中小心插入DGT板,48 h之后取出。随后将底泥按照0~1、1~3、3~5 cm分割成3层,并置于冷冻干燥机(FD-1A-50型)内进行干燥。最后将干燥完毕的各层底泥用玛瑙研钵研磨,过200目筛后于干燥器中保存备用。
蓝藻死亡期:模拟生长期试验结束之后,将剩余的8根柱子加塞密封并避免阳光照射,继续每隔48 h取1次上覆水。在模拟死亡期的第3天将DGT板小心插入沉积物中,48 h 之后取出。底泥的处理方法同上。
蓝藻复氧期:模拟死亡期试验结束之后,对剩余4根柱子进行曝气处理,以增加柱内氧气含量,按上述间隔时间抽取上覆水。曝气后第3天插入DGT板,48 h之后取出。底泥的处理方法同上。
1.3 底泥及上覆水理化性质测定
1.3.1 上覆水中叶绿素a和重金属含量测定 本试验采用热乙醇法[17]对叶绿素a含量进行测定,具体方法如下:上覆水经Whatman GF/C(玻璃纤维滤纸)滤膜过滤(0.45 μm),将所得滤液于-20 ℃条件下冷冻,24 h后向滤液中加入5 mL 90%乙醇溶液(经80 ℃预热),随后在水浴锅(HH-6型)中萃取3 min,萃取温度维持在80 ℃。在冰浴条件下用超声波细胞粉碎仪(KS-1200型)将水样进行细胞粉碎,接着在 4 ℃、黑暗条件下静置6 h。用高速离心机(TDL80-2B型)把静置后的水样在4 000 r/min下离心10 min,取得的上清液用紫外分光光度计(UV-2550型)在665 nm和750 nm处比色,以90%乙醇为参比,测定吸光度,然后加入1滴1 mol/L的盐酸,按上述方法再次测定吸光度,计算叶绿素a的含量。
用0.45 μm滤膜过滤适量上覆水,然后将所得滤液用ICP-MS(Thermo Fisher,ICAP-QC型)测定其中重金属含量。
1.3.2 底泥中重金属形态及通量测定 本试验采用BCR法[18]来测定B1态(弱酸溶解态)、B2态(可还原态)、B3态(可氧化态)3种重金属形态。由于第4种形态(残渣态)十分稳定,对生物有效性影响很小,因此本试验中不分析此态。
试验中所使用的DGT板购于英国DGT研究有限公司。取出DGT板后在泥水界面做好标记,之后用去离子水将其表面泥渍冲洗干净。取出DGT板中的吸附膜,按一定方向把吸附膜切成条状,宽度为4 mm,然后将小条吸附膜按顺序放入离心管,加入1 mL、1 mol/L的硝酸之后在180 r/min下震荡24 h获得提取液,测定并计算其中的重金属含量。
DGT通量可以反映相应深度底泥中重金属的浓度,按菲克(Fick’s)第一扩散定律进行通量计算:
(1)
CDGT是与DGT板对应处间隙水或上覆水中的重金属离子浓度;D是扩散系数(cm2/s),不同温度下的扩散系数可以参考文献[19];Δg是扩散层厚度(cm)。
CDGT可由下式计算:
(2)
式中:M为吸附膜固定的金属总量。
(3)
因此,
(4)
式中:A为DGT凝胶层面积(cm2);t为DGT插入沉积物的时间(h);Ce为硝酸提取液中测得的金属浓度(μg/L);V硝酸和Vgel分别是硝酸提取液和吸附凝胶的体积(mL);fe是硝酸对金属的提取系数,一般取0.8。
1.3.3 底泥中酸挥发性硫化物(AVS)及同步可提出金属(SEM)测定 在500 mL广口瓶中称取3 g干燥过筛后的底泥,然后向瓶中小心放入含有5 mL 3%碱性乙酸锌的试管,盖上具三通阀橡胶塞,往瓶中通入1~2 min高纯氮气后,注入 2 mL 1 mol/L的抗坏血酸溶液和 15 mL 6 mol/L的盐酸溶液,关闭阀门。4 h后取出试管,测定(亚甲基蓝比色法)并计算AVS[20]。在8 000 r/min下对瓶内底泥离心8 min,测定上清液中的重金属含量,从而得出SEM的值,并计算SEM-AVS。
2 结果与分析
2.1 上覆水中叶绿素a含量的变化分析
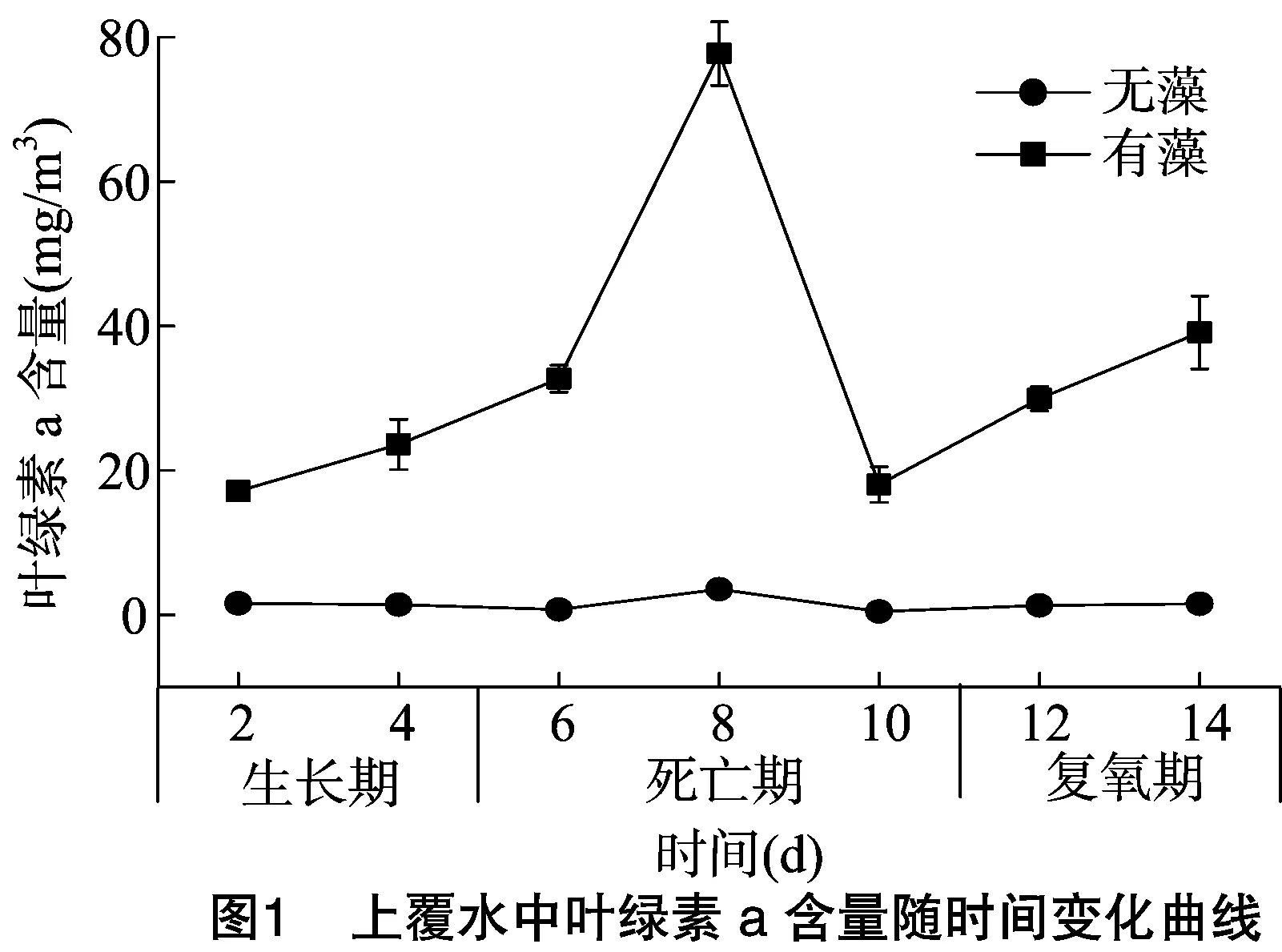
通过测定叶绿素a含量可以判断蓝藻的多少,测定结果见图1。从图中可以看出,在无蓝藻的柱子中取出的上覆水依然含有叶绿素a,其值随着时间变化不明显。这是因为试验中添加的为湖水,其中必定含有些许浮游植物,但是所测得的叶绿素a含量可以忽略不计。在添加蓝藻的情况下,叶绿素a含量在蓝藻生长期不断增加;在蓝藻死亡期,先快速增加,到达峰值以后骤然减小;在蓝藻复氧期再次上升。这是因为在生长期蓝藻的数量逐步增加,使得叶绿素a含量增加;在死亡期一开始,蓝藻的数量急剧生长,达到暴发阶段,由于此时蓝藻处于黑暗密闭环境,无法进行光合作用,使得柱内缺氧,以至于后期蓝藻快速死亡;复氧期的时候由于柱内氧气充沛,残存的蓝藻继续生长使叶绿素a含量增加。
2.2 上覆水中Cd含量的变化分析
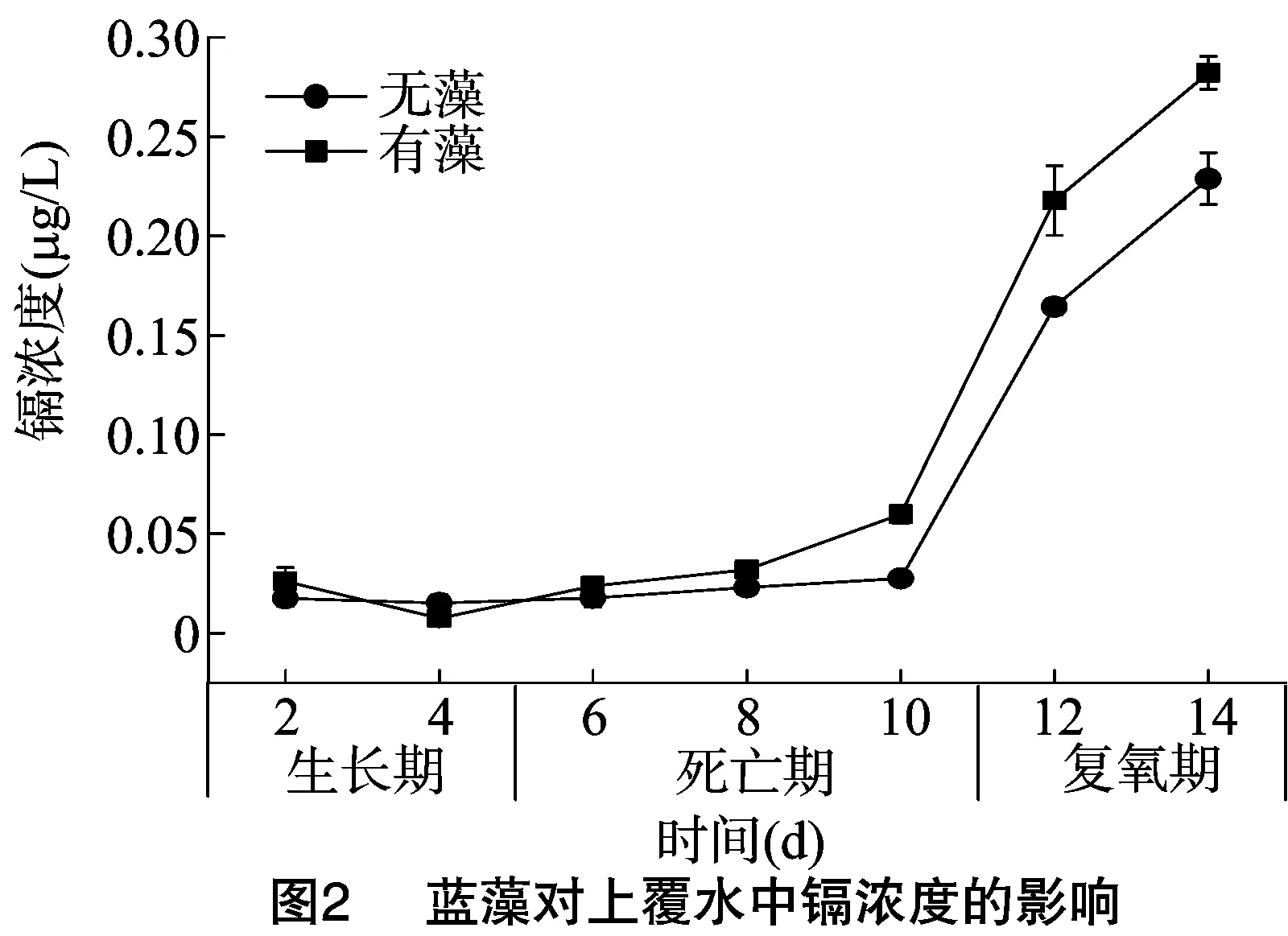
上覆水中Cd浓度的变化见图2。在蓝藻生长期,加藻组上覆水中Cd浓度呈降低趋势,说明蓝藻在生长过程中可以吸附上覆水中的Cd,这与Ni等的研究结果[12]一致;在蓝藻死亡期和复氧期,上覆水中的Cd浓度随时间延长而增加,加藻组中Cd浓度高于无藻组,但是整体而言,蓝藻的生消过程对上覆水中Cd浓度的影响不显著(P=0.685)。
高价铁锰氧化物若被还原,与之结合的重金属便释放出来[21],在蓝藻死亡期,柱内处于缺氧条件,铁锰氧化物结合态的重金属含量随铁锰化合物的还原而降低,使得上覆水中重金属含量升高;硫化物结合态中的重金属会随着硫化物的氧化而溶解到水中[22],在复氧期,氧气的含量增加导致硫化物被氧化,与之结合的重金属释放到上覆水中,因此会出现上覆水Cd浓度随试验进程而升高的情况。
2.3 沉积物中Cd的变化特征
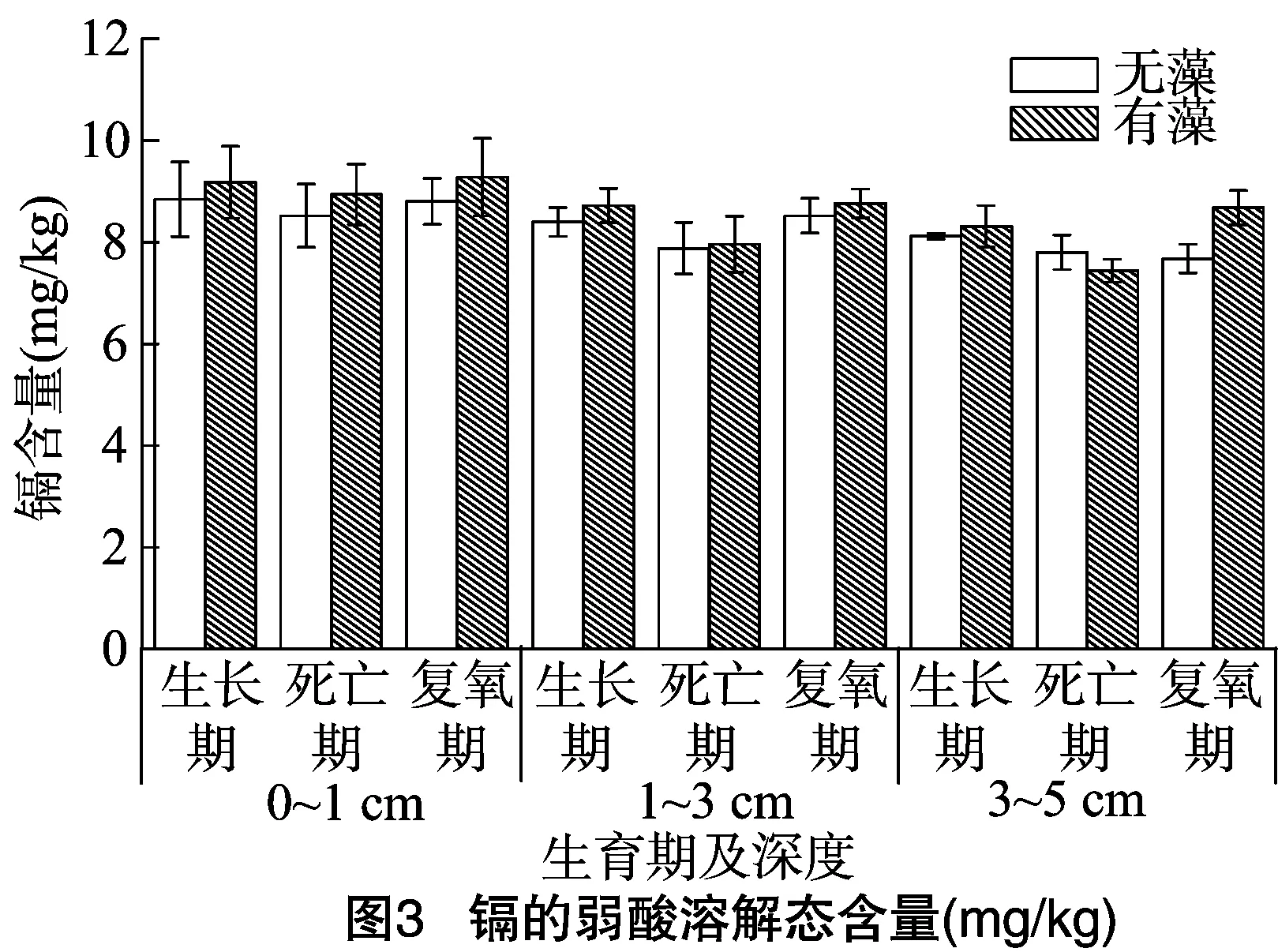
在生长期、死亡期、复氧期分析不同深度沉积物中Cd的赋存形态,以探究蓝藻的生消过程对沉积物中Cd形态的影响。Cd的弱酸溶解态测定结果见图3。不同深度沉积物中Cd的弱酸溶解态无明显规律性,蓝藻在生长期和复氧期会略微增加弱酸溶解态中Cd的含量,但是影响效果不显著(P=0.284)。这可能是因为金属的弱酸溶解态与pH值密切相关,在酸性条件下易分解,而在太湖沉积物中pH呈弱碱性[7],并不利于弱酸溶解态中重金属的释放。蓝藻的光合作用可以将CO2转变为O2,从而增强碱性,提高重金属的弱酸溶解态含量,而呼吸作用则相反,会降低碱性[11],导致重金属的弱酸溶解态含量减少。综上所述,蓝藻的存在没有对Cd的弱酸溶解态产生明显的影响。
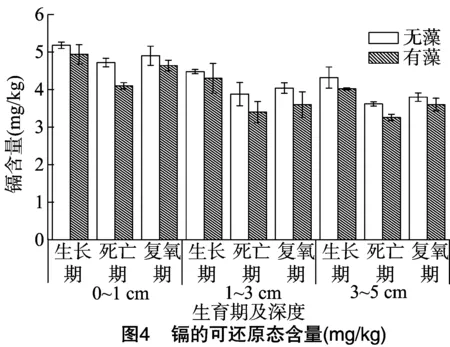
Cd的可还原态测定结果见图4。在各个时期,随着深度的增加,Cd的可还原态含量减小,可能是因为随着沉积物深度越深,含氧量越少,铁锰氧化物被还原程度越大。不仅如此,在蓝藻的生长期、死亡期、复氧期3个过程中,这2个处理重金属的可还原态含量均呈现先降低后升高的趋势,且蓝藻的生消过程会降低Cd的可还原态含量,因为当含氧量和ORP(氧化还原电位)降低时[23],重金属的可还原态含量会减少。蓝藻的暴发会使pH值升高[24],导致ORP降低,且蓝藻大量死亡以后柱内处于缺氧状态,使得加藻组中Cd的可还原态含量低于无藻组。整体上蓝藻对Cd的可还原态降低效果不显著(P=0.196),可能与蓝藻的数量有关。
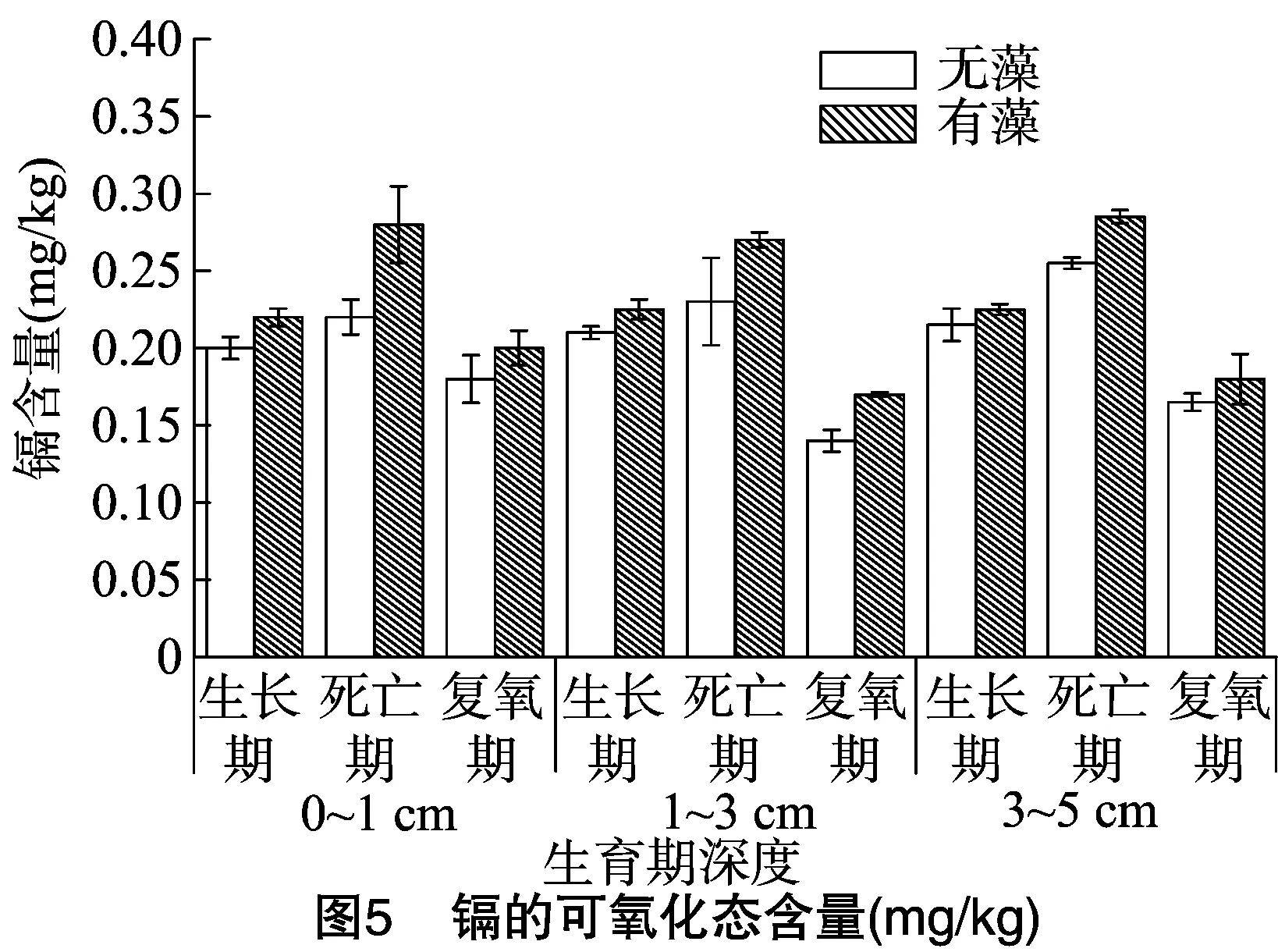
Cd的可氧化态测定结果见图5。3个时期相同深度下Cd的可氧化态含量大小为死亡期>生长期>复氧期,可能是因为柱内氧气含量表现为死亡期<生长期<复氧期,在好氧情况下与硫化物结合的Cd随着硫化物被氧化而释放出来,可氧化态含量减少,在蓝藻死亡期可氧化态含量最高还有一个原因就是藻体的死亡使柱内有机质含量增加,从而增加了金属的有机物结合态[25]。在蓝藻的生消过程中,整体上无藻组中Cd的可氧化态含量比加藻组中小,可能是由于蓝藻新陈代谢过程中产生的有机质使得加藻组中的有机质含量相对较高,但是2组的差异并不显著(P=0.164)。
2.4 沉积物镉的供应能力分析
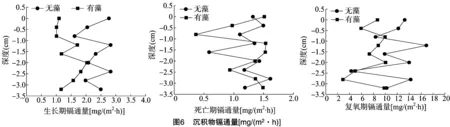
不同深度沉积物向孔隙水供应重金属的能力可以通过DTG通量反映出来。不同时期测得的Cd的通量如图6所示。由图6可知,在生长期蓝藻对沉积物中Cd通量的影响显而易见,说明蓝藻的生长会降低沉积物向孔隙水供应Cd的能力。通过之前的重金属形态分析,这可能是因为在生长期加藻组中Cd的可还原态和无藻组中的差异不大,而弱酸溶解态、可氧化态高于无藻组,所以降低了孔隙水中的重金属含量。由蓝藻死亡期测得的Cd通量可知,在加藻组中Cd的通量先低于无藻组,随着沉积物深度的增加又高于无藻组,最后接近,但整体差异不显著(P=0.896)。这可能是由蓝藻在死亡期对不同深度沉积物中Cd的赋存形态产生了不同的影响所导致的。由蓝藻复氧期测得的Cd通量可知,加藻组中Cd的通量要显著小于无藻组(P=0.021)。这可能是因为蓝藻在复氧期对Cd的弱酸溶解态和可氧化态含量的增加程度高于对Cd的可还原态含量的减少程度,整体上降低了沉积物向孔隙水供应Cd的能力。
2.5 沉积物中毒性判断
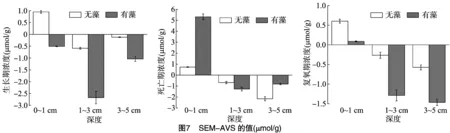
AVS可以和二价重金属反应形成不溶性低毒化合物,因此可以从SEM-AVS的值来判断沉积物中重金属的生物毒性大小,其值越大,说明毒性越大。通过对不同深度沉积物中AVS和SEM进行测定,计算出SEM-AVS的值,以探究蓝藻在生长期、死亡期、复氧期中的溶解性重金属生物毒性的大小,测定结果见图7。蓝藻的生消过程可以明显影响重金属的生物毒性。不管是无藻组还是加藻组,沉积物表层0~1 cm 的生物毒性最大,随着深度的加深毒性减小。在生长期和复氧期,加藻组的SEM-AVS值远小于无藻组,说明蓝藻在这2个时期内可以明显降低重金属的生物毒性。在蓝藻死亡期,表层0~1 cm处加藻组SEM-AVS值比无藻组大很多,明显增加了表层沉积物重金属的毒害作用,可能是因为蓝藻的大量死亡导致表层重金属含量剧增。
3 结论
蓝藻的生消过程能够影响上覆水及底泥中重金属的生物有效性,具体表现为:(1)蓝藻在生长期会降低上覆水中Cd的含量,在死亡期和复氧期会导致上覆水中Cd浓度的增加。(2)蓝藻在生长期、死亡期、复氧期会改变沉积物中的有机质含量、含氧量及pH值等因素,从而影响到Cd的赋存形态。蓝藻在生长期间会增加沉积物中Cd的弱酸溶解态及可氧化态含量,降低其可还原态含量;在死亡期会降低Cd的可还原态含量,增加其可氧化态含量;蓝藻在复氧期对沉积物中Cd的赋存形态的影响与生长期一致。(3)在生长期和复氧期,蓝藻可以明显降低沉积物中Cd的通量,加强沉积物对Cd的固定效果,抑制沉积物向孔隙水供应Cd的能力。(4)通过对SEM与AVS差值的分析可以发现,沉积物表层0~1 cm处的生物毒性最大。在不同时期,蓝藻对生物毒性的影响不同。在蓝藻生长期和复氧期,加藻组的生物毒性要明显小于无藻组,然而在蓝藻死亡期则截然相反,大量死亡的蓝藻使得沉积物重金属的毒害作用大幅增加。
