钠-葡萄糖共转运蛋白2抑制剂的代谢调控及心肾保护作用
2018-11-17刘志红审校
安 玉 刘志红 审校
钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter 2,SGLT-2)抑制剂是一类新型的口服降糖药,可通过抑制近端肾小管葡萄糖的重吸收,促进尿糖排泄发挥降糖作用。近年来研究表明[1],除降低血糖外,该药在控制血压、减轻体重,改善心脏和肾脏预后方面亦有独到作用。本文就该类药物对代谢的调控及其心肾保护作用作一。
作用机制
肾脏对葡萄糖代谢的影响肾脏可以谷氨酰胺为原料,通过糖异生参与葡萄糖的合成。体内约有20%内源性葡萄糖在肾皮质产生。血液中的葡萄糖可自由通过肾小球滤过膜,并在近端肾小管重吸收。在糖耐量正常的个体,设肾小球滤过率为180 L/d,平均血浆葡萄糖浓度为5.6 mmol/L(100 mg/dl),则每天由肾小球滤过的葡萄糖含量约为180 g/d(125 mg/min),远低于肾小管葡萄糖最大重吸收能力(TmG,约375 mg/min),因而尿液中检测不出葡萄糖。糖尿病患者的肾糖阈和TmG水平均升高,肾脏重吸收葡萄糖的能力增加,促进了高血糖的发展[1]。
SGLT-2抑制剂与葡萄糖代谢经肾小球滤过的葡萄糖,约80%~90%经位于近端肾小管S1段的SGLT-2重吸收,另有10%~20%经位于S2/S3段的SGLT-1重吸收。SGLT-2是一种高亲和力、低负载的葡萄糖载体,可以1∶ 1主动转运钠离子和葡萄糖,调控葡萄糖的重吸收[2]。研究表明,糖尿病患者SGLT-2 mRNA及其蛋白质产物合成增加,SGLT-2转运葡萄糖的内在活性也增加,重吸收葡萄糖的能力增加,与此同时,钠的重吸收增加,推动了高血压的发生发展[3]。SGLT-2抑制剂可降低TmG和肾糖阈,抑制肾小管葡萄糖重吸收,促进尿糖排泄,发挥降血糖作用[4]。
理论上,糖耐量正常的成人由SGLT-2介导的葡萄糖重吸收为160 g/d,但实际SGLT-2抑制剂仅能增加70~80 g/d葡萄糖从尿液排泄。因为位于S2/S3段的SGLT-1实际最大转运葡萄糖的能力80~100 g/d。在SGLT-2抑制剂的作用下,SGLT-1可重吸收30%~40%经由肾小球滤过的葡萄糖,因而SGLT-2抑制剂的低血糖反应并不常见[5]。
SGLT-2抑制剂与管球反馈管球反馈是指球旁器致密斑可通过感受流经的小管液中钠离子的浓度,调节入球小动脉的收缩,影响肾血流量和肾小球滤过率。SGLT-2可通过调节小管液中钠离子的浓度,参与管球反馈,调节肾内血流动力学。
如图1所示,正常情况下,由肾小球滤过的葡萄糖可经SGLT-1与SGLT-2完全重吸收,尿液中无葡萄糖。对糖尿病患者,血糖水平升高,SGLT-2的转运能力增加,葡萄糖和钠离子在近端肾小管的重吸收增加,流经致密斑的钠离子含量减少,导致局部释放肾素-血管紧张素,引起出球小动脉收缩和继发性的入球小动脉扩张,肾小球血流灌注增加,导致肾小球内高压力、高滤过,此时管球反馈受损,尿液中可检测到葡萄糖。在使用SGLT-2抑制剂的情况下,葡萄糖和钠离子在近端肾小管的重吸收减少,流经致密斑的钠离子含量增加,可引起入球小动脉收缩,修复管球反馈,减少肾小球内高压力,使肾小球滤过率恢复正常,此时尿糖排泄明显增加[1]。
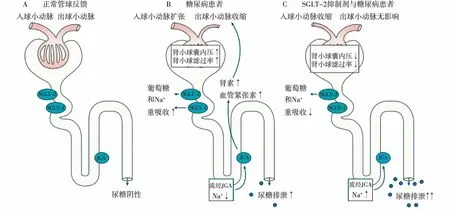
图1 SGLT-2抑制剂对糖尿病患者管球反馈的调节作用[1]SGLT-2:钠-葡萄糖共转运蛋白2;JGA:球旁器;A:正常个体;B:糖尿病患者管球反馈受损;C:SGLT-2抑制剂修复糖尿病患者管球反馈
对血压和代谢的调控
改善血糖与代谢指标由于SGLT-2抑制剂独特的降糖机制,其降糖作用不依赖胰岛β细胞功能,且不受胰岛素抵抗影响,无论是对新诊断,还是病程10年以上、长期血糖控制不佳(胰岛素抵抗明显/胰岛分泌减少)的患者同样有效。对2型糖尿病(T2DM)患者,SGLT-2抑制剂可使糖化血红蛋白(HbA1c)下降0.7%~1.0%(单药或联合其他降糖药均可)。对T1DM患者,也可使HbA1c下降约0.5%~0.8%(适应征尚未获批)[1]。在血糖明显升高时,SGLT-2抑制剂的降糖效果更显著,因而可作为胰岛素强化治疗的备选方案。与二肽基肽酶-4(DPP-4)抑制剂相比,对HbA1c<8%的T2DM患者,达格列净对HbA1c 的降幅不如西格列汀(-0.45%vs-0.69%),但对平均HbA1c 为10%的T2DM患者,达格列净对HbA1c 的降幅则优于西格列汀(-1.87%vs-1.32%)[1,6]。
能量代谢方面,SGLT-2抑制剂增加尿液排泄葡萄糖70~80 g/d,相当于热量300 kcal。理论上,血糖下降会促进肝糖原输出,但实际上此类药物在降低血糖的同时,却促进了肝糖原的合成,这可能与肝脏-门静脉系统或肾脏-中枢神经系统调节有关[7]。此时,为满足机体能量需求,脂肪氧化和酮体生成增加,而碳水化合物利用减少。据报道,SGLT-2抑制剂可减少皮下和内脏脂肪含量,使血浆三酰甘油水平下降5%,同时低密度脂蛋白升高3%~5%,高密度脂蛋白升高5%~8%,但二者比值不变[1]。此外SGLT-2抑制剂可促进尿酸排泄,临床试验结果表明,恩格列净和达格列净均可使血尿酸下降40~50 μmol/L[8-9]。
降低血压和体重SGLT-2抑制剂在抑制葡萄糖重吸收的同时,促进近端肾小管尿钠排泄,这种渗透性利尿作用可使血浆容量下降约7%,用药1~2周后可使收缩压下降5~6 mmHg,舒张压下降1~2 mmHg。用药6~12 m后,肾素-血管紧张素系统活性下降 、动脉硬化改善、尿酸水平下降、蛋白尿减少等因素可能在持久降压中起到促进作用。血容量下降、排泄多余糖分、脂肪动员等带来体重下降。连续使用SGLT-2抑制剂3~6个月可使体重平均下降约2 kg[10]。
增加胰岛素敏感度研究表明,达格列净治疗2周可改善胰岛β细胞功能,使肌肉组织对葡萄糖的摄取和利用增加25%~30%[7,11]。由于胰岛β细胞和肌肉组织上未发现SGLT-2的表达,目前认为这种作用主要与此类药物降低血糖后,减轻了高血糖对周围组织的糖毒性,从而改善胰岛β细胞功能和周围组织对胰岛素的敏感度有关。
心脏保护作用
研究表明,与安慰剂相比,恩格列净可使糖尿病患者发生主要心血管不良事件(包括心血管死亡率、非致死性心梗、非致死性卒中)的风险下降14%,并使心血管死亡率、充血性心力衰竭住院率及心梗的发生率分别下降38%、33%和13%[8]。坎格列净也可使主要心血管不良事件的发生风险下降14%,并使心力衰竭住院率下降27%[12]。
降糖作用并不能完全解释SGLT-2抑制剂的心脏保护机制。原因主要有以下几点:首先,高血糖仅仅是糖尿病大血管并发症的一个较弱的风险因素(后者主要与高血压、血脂异常、肥胖、胰岛素抵抗和血栓前状态有关);其次,降糖治疗对糖尿病患者大血管并发症的获益往往需经较长时间才能体现(通常需10年以上),而采用上述药物治疗的患者在用药3个月后即表现出显著的改善心血管死亡率和心力衰竭住院率的作用;此外,SGLT-2抑制剂降低HbA1c的幅度并不大,在另外三项非劣效临床试验中,DPP-4抑制剂也达到相同的降糖效果,但并未表现出心血管保护作用。目前认为此类药物的心血管保护作用除降糖、降压、排除体内多余水分、减轻体重和降低内脏脂肪含量、减少胰岛素抵抗外,还与降低交感神经系统活性、减少动脉硬化、减轻氧化应激和炎症反应等有关[1]。
肾脏保护作用
SGLT-2抑制剂对肾脏的保护,一方面通过改善血压、血糖、血脂、尿酸及体重等因素使肾脏间接获益,另一方面可直接影响肾脏局部的血流动力学与代谢情况,延缓肾脏病进展。
调节管球反馈,减轻肾脏高滤过如前所述,SGLT-2抑制剂可通过促进尿钠排泄,修复管球反馈,直接减轻肾小球局部的高灌注、高压力、高滤过,延缓肾小球硬化。动物试验和临床研究结果均表明,此类药物具有减少糖尿病患者蛋白尿和延缓肾小球滤过率进展的作用[1]。在用药之初,由于SGLT-2抑制剂对入球小动脉的收缩作用,会出现eGFR一过性轻度下降[4~6 ml/(min·1.73m2)],但这种下降是可逆的,多在用药1~3个月内恢复,长期治疗则表现出延缓肾功能减退的作用[13-14]。由于降低了肾小球内高压力,可使尿蛋白下降30%~50%,且降蛋白尿的作用独立于肾素-血管紧张素抑制剂的作用[15-17]。
值得注意的是,在糖尿病合并慢性肾脏病(CKD)的人群中,此类药物对血压和体重的影响与其降糖作用并不平行。前瞻性研究和Meta分析结果均显示,与CKD 1~2期患者相比,SLGT2抑制剂对CKD 3期糖尿病患者的降糖和控制体重作用减弱(尤以降糖幅度减低更明显),但降压作用则要优于前者(图2)[10]。这可能与CKD中期SGLT-2抑制剂促进尿糖排泄的作用减弱,但绝大多数CKD患者均属盐敏感性高血压,对尿钠排泄和利尿作用较为敏感有关。一项在2型糖尿病合并CKD患者安全性和有效性的3期临床试验(EMPA-REG RENAL试验)结果则显示,口服恩格列净25 mg/d治疗52周,对CKD 4期的患者已无降糖作用(HbA1c较基线升高0.11%),但却使收缩压和舒张压分别下降11.2 mmHg和4.3 mmHg[18]。该现象提示,SGLT-2抑制剂对肾内血流动力学具有持续影响,决定了其在非糖尿病的CKD人群可能有着独特的应用前景。
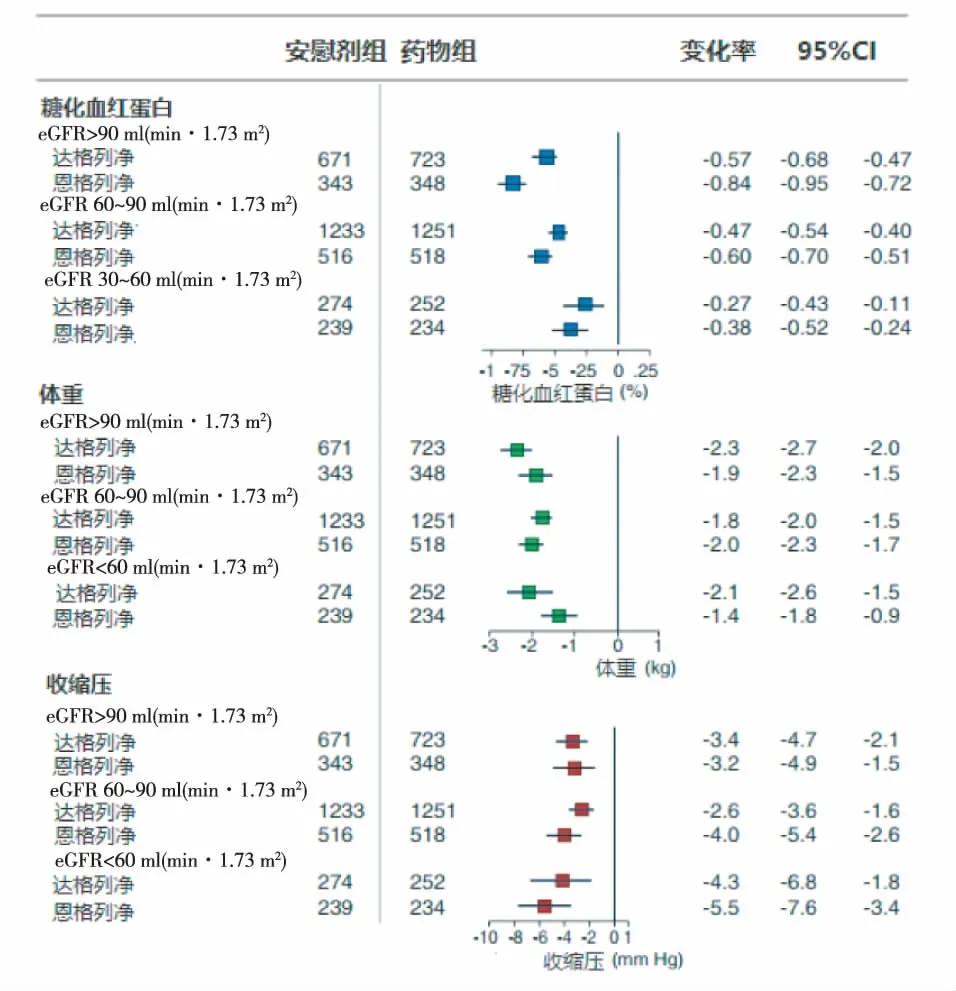
图2 SGLT-2抑制剂对不同CKD分期糖尿病患者血糖、体重及收缩压的影响[10]SGLT-2:钠-葡萄糖共转运蛋白2;CKD:慢性肾脏病;eGFR:估算的肾小球滤过率;*:达格列净组患者eGFR均≥45 ml/(min·1.73m2)
减轻肾小管糖毒性近曲小管肥大、增生、肾小管基膜增厚是糖尿病肾病早期的病理改变之一,而肾小管葡萄糖重吸收增加是其主要原因,可导致细胞因子表达增加、炎症反应和纤维化。SGLT-2抑制剂抑制葡萄糖在近端肾小管的重吸收,可减轻高血糖对肾小管的糖毒性,抑制炎症指标的表达和纤维化进程[19]。
心肾保护的循证医学证据
目前SGLT-2抑制剂心肾保护保护作用的循证医学证据主要来自两项大型的3期临床试验:恩格列净(EMPA-REG OUTCOME研究,7 020例,中位随访时间3.1年)[8,13]和坎格列净(CANVAS研究,10 142例,中位随访时间2.4年)[12]。研究纳入人群均为肾小球滤过率≥30 ml/(min·1.73m2)、发生心血管事件风险较高的T2DM患者,主要研究终点为心血管死亡率、非致死性心梗、非致死性卒中等主要心血管不良事件,次要研究终点则为糖尿病微血管病变。研究结果表明,恩格列净和坎格列净能降低患者发生主要心血管不良事件以及心力衰竭住院率的风险,并能延缓肾脏病的进展。其对肾脏终点事件的影响如图3所示[20]。
与安慰剂相比,恩格列净可使糖尿病患者肾脏病新发或恶化[定义为进展至大量白蛋白尿、肌酐倍增且肾小球滤过率 ≤45 ml/(min·1.73 m2)、开始肾脏替代治疗或肾性死亡]的风险下降39%,并使进展至大量白蛋白尿和开始肾脏替代治疗的风险分别下降38%和55%,但在基线尿白蛋白正常的人群新发微量白蛋白尿的概率上则与安慰机组无差异[13]。同样,坎格列净也可使白蛋白尿进展的风险下降27%,并使肾小球滤过率持续下降40%以上、肾脏替代治疗或肾脏死亡的风险下降40%[12]。但由于随访时间所限,上述两项研究实际发生肾脏替代治疗的例数均较少。
临床用药注意事项
尽管SGLT-2抑制剂表现出令人振奋的心脏和肾脏保护作用,但临床医生在用药过程中仍应注意药物相关的不良反应。首先,此类药物的主要副作用为泌尿系统和生殖系统的感染,既往有严重或反复发作泌尿系统及生殖系统感染的患者应慎用。其次,此类药物有诱发酮症酸中毒的风险,这可能与其抑制丙酮酸羧激酶(糖异生过程中的一种关键酶)的活性有关,因而既往有酮症酸中毒病史的患者应避免使用[21]。第三,此类药物有利尿和降压作用,血流动力学不稳定(如胃肠道丢失明显、摄入明显不足等)的患者应避免使用。第四,在CANVAS研究中,坎格列净组下肢截肢的发生率增加,但具体机制不明,且其他同类药物并未表现出相同结果。因而有下肢截肢高风险的患者可酌情选用其他SGLT-2抑制剂,而避免使用坎格列净。此外,现有的临床试验结果多来自CKD 3期及以上的患者,缺乏有关此类患者在CKD晚期患者安全性和有效性的数据[10,22]。
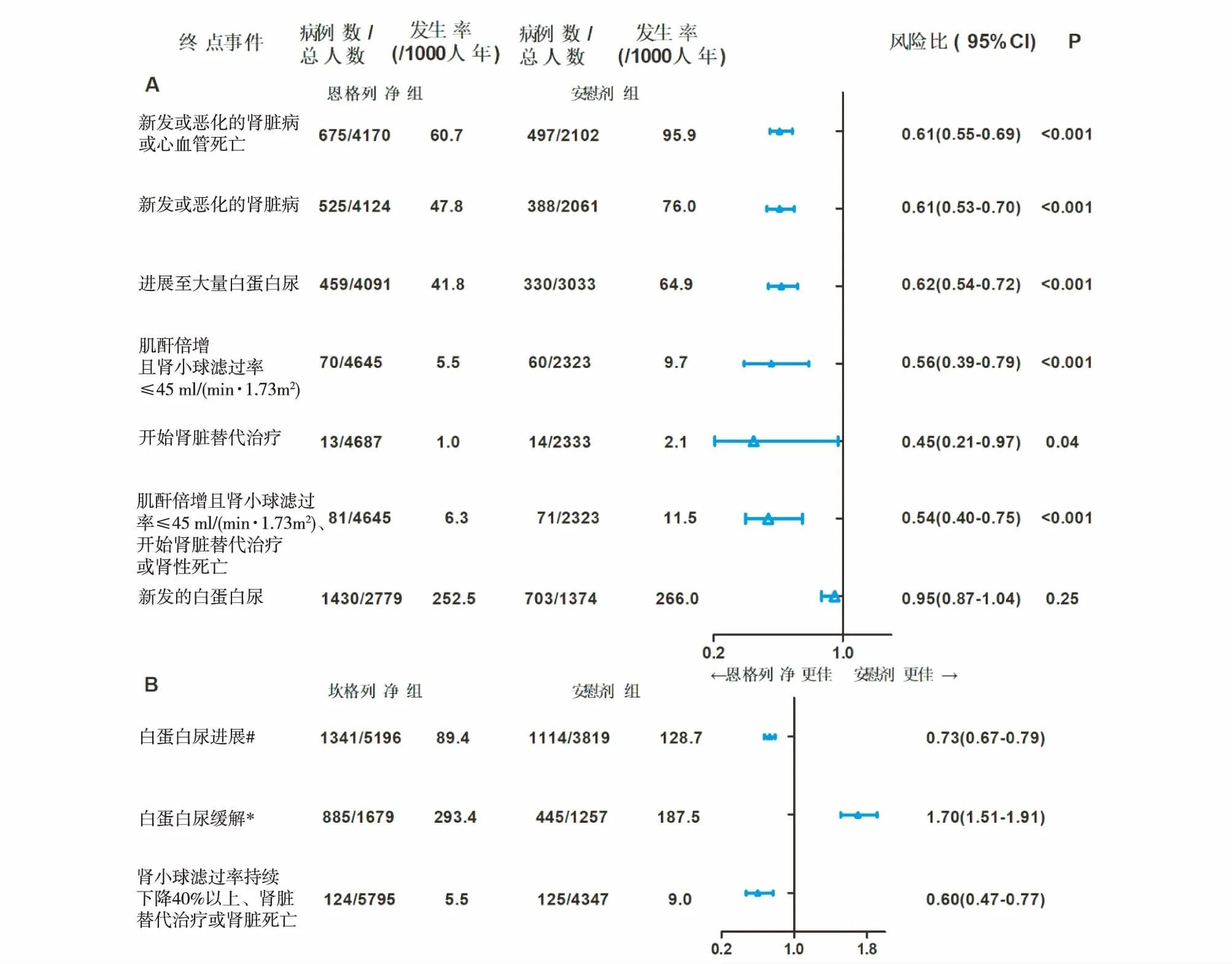
图3 SGLT-2抑制剂的肾脏保护作用[20]A:恩格列净对肾脏预后的影响(EMPA-REG OUTCOME研究);B:坎格列净对肾脏预后的影响(CANVAS研究);#:白蛋白尿进展定义为基线尿白蛋白正常的患者出现微量白蛋白尿或大量白蛋白尿,或基线为微量白蛋白尿的患者进展至大量白蛋白尿,且尿白蛋白/肌酐比较基线升高30%以上;*:白蛋白尿缓解定义为基线为微量白蛋白尿或大量白蛋白尿的患者尿白蛋白恢复正常,或基线为大量白蛋白尿的患者降为微量白蛋白尿,且尿白蛋白/肌酐比较基线减少30%以上
EMPA-REG OUTCOME研究和CANVAS研究均是以心血管预后作为主要研究终点,有关SGLT-2抑制剂在CKD伴或不伴糖尿病人群的肾脏保护作用仍需以肾脏预后为主要研究终点的大型临床试验进一步证实。目前坎格列净(CREDENCE研究)和达格列净(DAPA-CKD研究)均开展了以肾脏预后为主要终点的临床试验,预计分别于2019年和2021年结束,前者主要针对T2DM合并CKD人群,后者主要针对CKD伴或不伴糖尿病的人群[10]。而恩格列净相关的临床试验也在筹备之中。SGLT-2抑制剂能否通过调节管球反馈作用,延缓CKD的进展,从而在肾素-血管紧张素抑制剂之外,为CKD人群的治疗开拓新的时代,我们拭目以待。
小结:SGLT-2抑制剂通过抑制葡萄糖的重吸收,起到降糖、降压、减轻容量负荷、改善代谢和减少糖毒性的作用;并通过抑制钠离子的重吸收,调节管球反馈,减轻肾脏高压力、高灌注、高滤过。现有的临床试验结果显示此类药物可减少糖尿病患者发生心脏和肾脏终点事件的风险。但其肾脏保护作用仍需更多以肾脏终点事件为主要终点的大型临床试验进一步证实。
