骨桥蛋白及炎性因子在轻度认知障碍进展的预测价值研究
2018-11-17刘婷李丹张燕孟新玲
刘婷,李丹,张燕,孟新玲
本研究创新点:
骨桥蛋白(osteopontin,OPN)是一种炎性因子,在各种慢性炎症和自身免疫疾病中发挥重要作用。既往的体内和体外实验表明OPN表达增强很可能是应对加速的神经退行性变和病理性变化时的反应。但有关结果多局限在动物实验阶段,临床上确切的炎症致病机制尚未完全明确。轻度认知障碍(MCI)被认为是介于认知正常和痴呆之间的一种疾病。有关早期识别进展为AD的MCI患者的潜在生物标记物研究较少,通过寻找血清和脑脊液中对MCI和痴呆诊断、预警有帮助的蛋白标志物是全世界学者追求的目标。因此,本研究创新点在于从崭新的角度探索AD临床前期和疾病早期新的生物学标志,探索AD不同时期、不同认知功能状态下OPN及相关细胞因子的变化,为AD的筛查、预警和早期诊断提供客观依据,为AD治疗药物的选择提供一定的参考,并且为AD的治疗效果评价提供客观指标。
阿尔茨海默病(AD)是一种常见的中枢神经系统退行性疾病,其特征是慢性进行性认知功能衰退[1]。轻度认知障碍(MCI)被认为是介于老年人认知正常和痴呆之间的一种疾病。一部分患有MCI的个体可能进展为AD,并具有典型痴呆的生物学变化[2]。
迄今为止,AD中神经元和突触变性的潜在机制仍未十分清楚,但炎症过程和免疫失调参与其发病机制的理论已被广泛证实。神经病理学和神经放射学研究表明,AD脑中的炎性变化是相对早期的致病事件,早于神经的破坏过程[3-4]。但是目前用于早期识别进展为AD的MCI和不进展的MCI的生物标志物较少。因此,本研究拟通过对骨桥蛋白(OPN)及细胞炎性因子的研究寻找潜在的生物标志物,为评估OPN以及炎性因子在MCI患者进展为AD中的预测价值。
1 资料与方法
1.1 一般资料 前瞻性分析2015年6月—2017年6月新疆维吾尔自治区中医医院脑病一科收治的MCI患者以及年龄、性别相匹配的非炎症性神经病变(OND)患者,各60例。患者均由家属签署知情同意书并通过医院伦理委员会审查。
纳入标准:(1)结合临床表现及影像学检查明确诊断为MCI或OND;(2)年龄≥50岁;(3)既往无肿瘤及精神疾病等病史;(4)视听功能完好,可完成记忆量表检测,无认知功能障碍;(5)签署知情同意书。MCI的诊断标准是指:(1)主诉记忆障碍,而且有知情者证实;(2)总体认知功能正常,但有某一认知方面的变化;(3)日常生活能力正常,可能会影响社会活动、人际交往、工作能力、家庭生活;(4)未达到痴呆的诊断标准;(5)排除痴呆和其他可引起脑功能障碍的内科或精神心理症状[5]。OND是指由非炎症性因素引起的神经系统疾病,如神经性头痛等。
排除标准:(1)入院时患精神病或神经障碍,颅脑损伤导致的意识丧失,酒精或药物滥用;(2)伴随可能影响免疫水平疾病,如糖尿病、严重的肺炎、自身免疫性疾病、风湿性关节炎、急性或慢性炎症疾病等;(3)伴随重大躯体疾病并危及生命,如急性心肌梗死、严重慢性阻塞性肺疾病;(4)抽血化验期间使用皮质类固醇激素及非甾体类抗炎药物;(5)拒绝签署知情同意书。
1.2 方法
1.2.1 收集基线资料 患者入院后收集以下临床数据资料,包括性别、年龄、体质指数(BMI)、简易智能量表(MMSE)评分。MMSE是一种认知筛查工具,用于评估时间和空间定位、记忆力、注意力、计算、语言和视觉能力。由20个问题共30项组成,最高得分为30分。文化程度为文盲<17分、小学<20分、中学以上<24分为痴呆。入院患者常规行腰椎穿刺留取脑脊液标本,晨起空腹抽取肘静脉血5 ml,以3 000 r/min离心10 min,离心半径150 mm,采用酶联免疫吸附试验(ELISA)检测脑脊液和血清OPN水平(R&D公司,美国)、血清白介素(IL)-1β、IL-6、IL-17A、转化生长因子(TGF)-β1、肿瘤坏死因子(TNF)-α和IL-4水平(R&D公司,美国),作为患者的基线数值。
1.2.2 随访 所有患者主要通过门诊和住院随访1年,随访截止日期为2018-06-01,对失访病例按最后1次随访时间为准做删失处理。
1.2.3 分组方法 根据患者的诊断在随访结束时分为AD组、未进展组和OND组。当AD组诊断为AD时再次按照上述方法测量脑脊液和血清中OPN及各炎性细胞因子水平。对比分析各组随访前后的差异,以及MMSE评分、OPN以及各炎性细胞因子的相关性。
1.3 统计学方法 采用SPSS 23.0软件进行统计学分析,计量资料以(±s)表示,多组间比较采用方差分析,组间两两比较采用q检验;计数资料的分析采用χ2检验;采用Pearson相关进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料 随访1年后,MCI患者中有23例发展为AD,5例失访;OND患者中有9例失访。最终AD组23例,未进展组32例,OND组51例。
入院时,3组性别、年龄、BMI、MMSE评分、血清 OPN、IL-1β、IL-6、IL-17A、TNF-α、TGF-β1和IL-4水平比较,差异均无统计学意义(P>0.05);入院时3组脑脊液OPN水平比较,差异有统计学意义(P<0.05);其中AD组脑脊液OPN水平高于未进展组和OND组,差异有统计学意义(P<0.05)。
随 访 1年 时,3组 IL-1β、IL-6、IL-17A、TGF-β1、IL-4水平比较,差异均无统计学意义(P>0.05);随访1年时3组血清OPN、TNF-α水平比较,差异均有统计学意义(P<0.05);其中AD组血清OPN、TNF-α水平均高于未进展组和OND组,差异有统计学意义(P<0.05,见表1)。
2.2 相关性分析 相关性分析结果显示,所有入组患者在入院时脑脊液OPN水平与MMSE评分呈正相关(r=0.348,P<0.001,见图1)。血清 OPN水平与MMSE评分呈正相关(r=0.631,P<0.001,见图2)。血清TNF-α水平与MMSE评分呈负相关(r=-0.435,P<0.001,见图 3)。
2.3 随访1年后各项炎性因子变化结果 AD组患者入院时、诊断AD时、随访1年时IL-1β、IL-6、IL-17A、TNF-α、TGF-β1、IL-4水平比较,差异均无统计学意义(P>0.05);AD组患者入院时、诊断AD时、随访1年时MMSE评分、脑脊液OPN、血清OPN水平比较,差异均有统计学意义(P<0.001);其中诊断AD时、随访1年时MMSE评分低于入院时,脑脊液OPN、血清OPN水平高于入院时,差异均有统计学意义(P<0.05,见表2)。
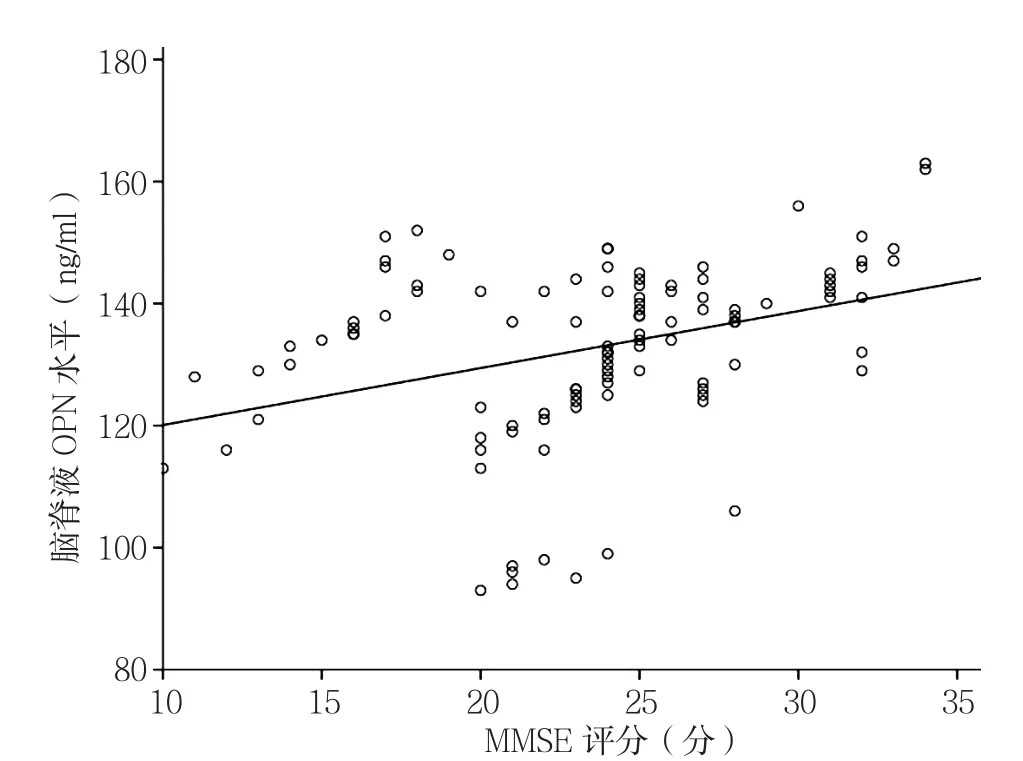
图1 脑脊液OPN水平与MMSE评分的相关性分析Figure 1 Correlation analysis of CSF OPN level and MMSE score
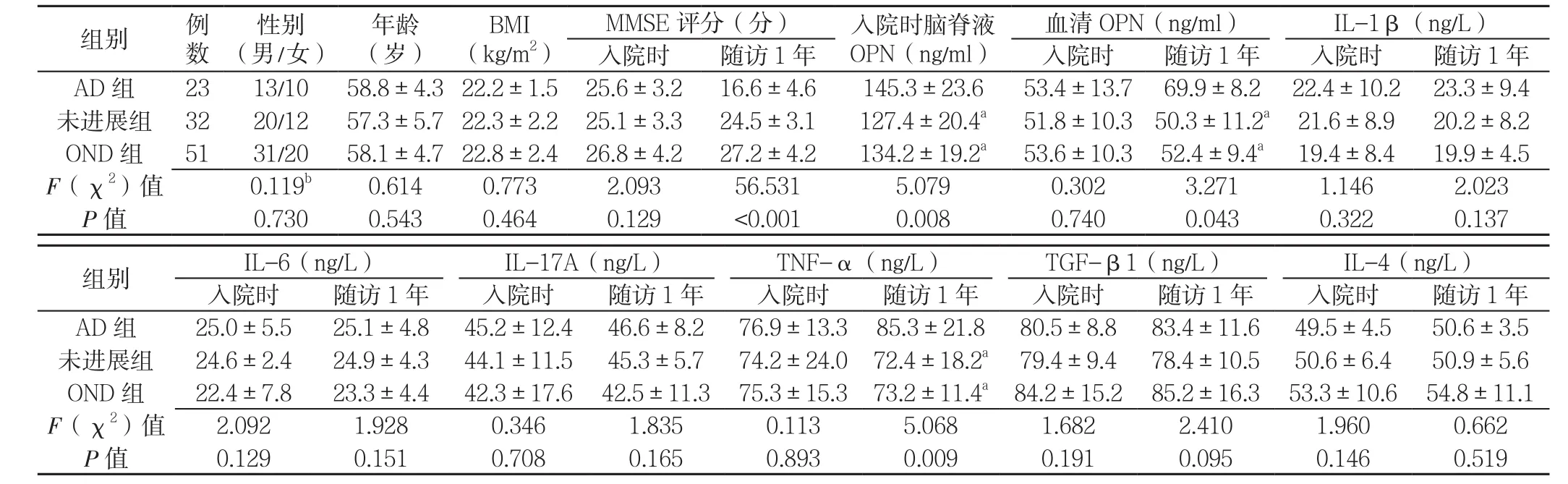
表1 两组临床资料比较Table 1 Comparison of general data between the two groups
3 讨论
MCI被认为是介于认知正常和痴呆之间的一种疾病。一部分患有MCI的个体会进展为AD,并具有典型痴呆的生物学变化[2]。研究表明MCI患者的脑脊液和血清中含有多种促炎物质,如细胞因子、急性期蛋白和补体蛋白,其在诱导认知衰退、记忆丧失和痴呆中起着重要作用[6-7]。其中OPN已经被证实可以通过多种机制在慢性炎症和自身免疫疾病的进展中发挥作用,包括参与产生Th1和Th17等炎症疾病的致病性T细胞[8-9],以及与其受体(如CD44等)相结合抑制自身反应性免疫细胞的凋亡和白细胞向炎症部位迁移和黏附而发挥抗炎作用[10]。但是目前用于早期识别进展为AD的MCI和不进展MCI的临床标志物很少。因此,本研究拟通过对OPN以及炎性细胞因子的研究寻找潜在的生物标志物。
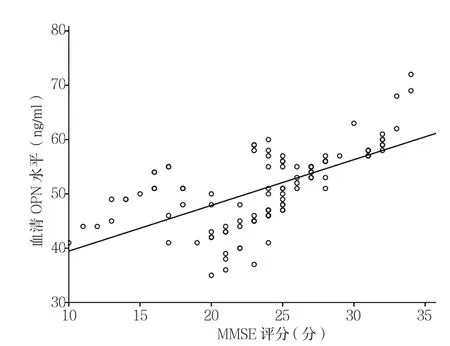
图2 血清OPN水平与MMSE评分的相关性分析Figure 2 Correlation analysis of serum OPN level and MMSE scores
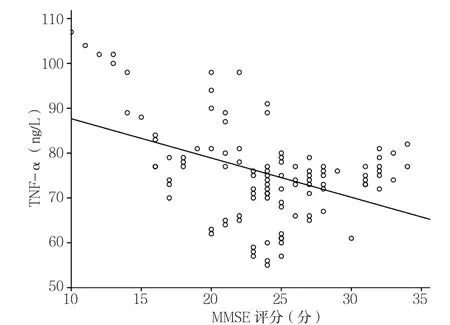
图3 血清TNF-α水平与MMSE评分的相关性分析Figure 3 Correlation between serum TNF-α level and MMSE scores
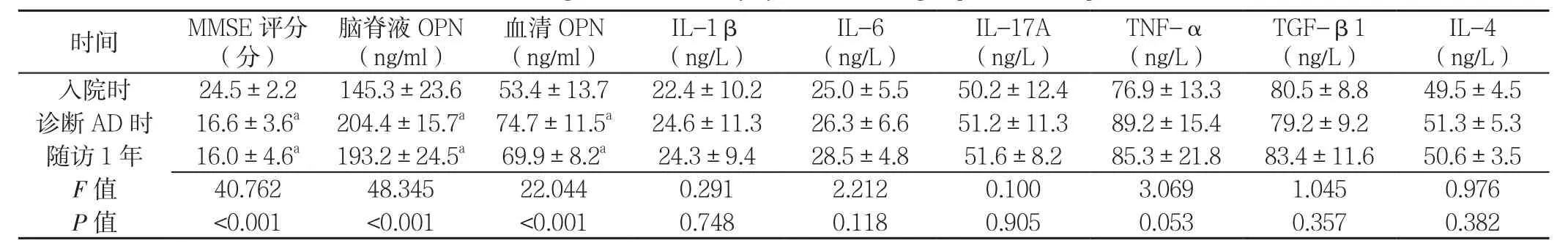
注:与入院时比较,aP<0.05
本研究横向研究显示,在入院时仅脑脊液OPN水平在AD组中显著升高,在未进展的MCI组与OND组无显著性差异。但当AD组随访1年后脑脊液OPN和血清OPN水平、TNF-α水平均高于入院基线值。分析认为由于刚诊断为AD时,炎性反应主要发生在脑的脆弱区域,如内嗅、颞顶叶和扣带回皮质,引起急性期蛋白和促炎递质的表达增加。而脑脊液内的炎性因子可以直接接触大脑,能准确反映中枢神经系统正在进行的炎症过程[11]。因此与血清OPN相比,脑脊液OPN水平在发生认知功能下降前已经发生变化。此外本研究还发现其他炎性因子在各组之间均无显著差异,与既往研究相似[12]。何璐等[12]进行的70种免疫及炎症相关蛋白研究也证实,除TNF-α外,AD组和健康对照组IL-1β、IL-4、IL-6、IL-17A等常见的炎性细胞因子相比无显著差异。但也有研究和荟萃分析显示,AD患者外周血中IL-6、IL-8、IL-10水平高于健康对照者[13-15]。可能是因为本研究中排除标准较为严苛,严格排除了AD以外其他可能影响免疫炎症水平的各种相关伴随疾病。因此认为MCI患者进展为AD时,并不是所有的促炎因子和抗炎因子均发生改变。相关性分析也证实,脑脊液OPN水平和血清OPN水平、TNF-α水平均与痴呆严重程度具有相关性。研究认为当发生感染、炎性疾病、局部缺血和创伤性损伤等中枢神经系统病理过程时,会刺激脑内小胶质细胞和星形胶质细胞释放大量的炎性因子[16],并且对AD患者死亡后的大脑分析发现TNF-α 可以定位在淀粉样斑块中[17]。COMI等[18]也证实在MMSE评分>23分的AD患者中脑脊液OPN含量高于MMSE评分≤23分,与认知功能下降有关。尽管OPN作为AD患者认知功能减退的关键促炎细胞因子的确切作用及其潜在机制尚不清楚,但既往研究发现与健康对照者和未进展的MCI患者相比,进展为AD的MCI患者的脑脊液中OPN的磷酸化C末端片段增加[19]。为确定AD症状前阶段的蛋白质变化,有学者利用高分辨率液相色谱质谱对家族性AD患者或有遗传危险者的脑脊液进行蛋白质组学分析,结果表明,家族性AD突变载体的脑脊液OPN较相关非载体升高,提示临床痴呆前脑脊液OPN发生变化[20]。在进展为AD的MCI患者的脑脊液中,不仅OPN的完整形式增加,而且OPN的裂解形式也增加[21]。
本研究纵向随访研究显示随访1年后,AD组MMSE评分无显著变化,脑脊液和血清OPN水平、TNF-α水平均较诊断为AD时无显著变化。这与JULIAN等[22]进行的一项为期2年的随访研究相似,研究显示AD患者随访期间未发现任何急性或慢性炎症状态,各项炎性因子亦无显著差异。分析认为可能是与OPN在神经退行性疾病的发展过程中的两种相反作用共同作用导致。一方面,OPN通过上调髓鞘形成和再髓鞘形成发挥神经保护剂的作用。另一方面,OPN通过引起神经元毒性和死亡而具有疾病加速作用。随着疾病进程和严重程度发挥不同的作用[23-24]。
结合既往研究和本研究结果均提示脑脊液OPN是一种潜在早期评估MCI进展的生物学标志物,在AD的病理生理机制中发挥重要作用。本研究缺陷在于,首先由于为单中心研究,在排除标准上限制了大量会影响免疫功能的伴随疾病,以及部分患者在随访期间资料不全,与其他研究相比1年后进展为AD的比率偏高,仍需进一步多中心前瞻性研究证实该结论。其次,本研究仅评估了少量炎性细胞因子的变化情况,由于检测指标和平台的差异,还需进一步大样本研究发现更多的预测标志物。最后,本研究随访1年后未能收集未进展MCI组脑脊液中OPN变化情况,因此仍需进一步研究证实该结论。
总之,脑脊液OPN水平是早期识别进展为AD的MCI患者的潜在生物标志物。并且血清及脑脊液OPN水平以及TNF-α水平与AD的严重程度具有相关性,但对于其他炎性因子与AD病情严重程度的关系仍有待于进一步研究。
作者贡献:刘婷、孟新玲进行文章的构思与设计、研究的实施与可行性分析;刘婷进行数据收集、结果的分析与解释、撰写论文、进行论文的修订;刘婷、张燕进行数据整理;李丹、张燕进行统计学处理;孟新玲负责文章的质量控制及审校、对文章整体负责,监督管理。
本文无利益冲突。
