富硒酵母和枯草芽孢杆菌对湖羊羔羊小肠黏膜形态和直肠菌群的影响
2018-11-16程连平舒迎霜贺濛初夏晓冬冯士彬王希春吴金节
程连平 舒迎霜 贺濛初 夏晓冬 李 玉 冯士彬 王希春 吴金节
(安徽农业大学动物科技学院,安徽地方畜禽遗传资源保护与生物育种省级实验室,合肥 230036)
近年来,我国养殖场抗生素的滥用导致细菌耐药性不断增加,造成养殖动物的抗病性降低、畜产品药物残留等问题,严重制约了养殖业的发展[1]。因此,在畜禽生产中开发绿色安全、高效、无残留的抗生素替代品已成为研究热点和必然趋势。微生态制剂具有生物拮抗作用,能抑制致病菌的侵入和定植,促进营养物质的消化、吸收及免疫力的提高[2],目前广泛应用于畜牧生产。
湖羊羔羊在断奶后,由于应激反应明显,导致食欲下降、免疫力低下、腹泻等,影响湖羊的生长发育。研究表明,饲粮中添加富硒酵母和枯草芽孢杆菌可以促进畜禽肠道的发育,并改善肠道菌群[3-4],但有关富硒酵母和枯草芽孢杆菌对湖羊羔羊的促生长作用及其机理未见报道。因此,本试验以45日龄的湖羊断奶羔羊为试验动物,通过在饲粮中添加富硒酵母和枯草芽孢杆菌,探讨其对小肠黏膜形态和肠道菌群的影响,为微生态制剂在反刍动物的进一步开发应用提供试验依据。
1 材料与方法
1.1 试验材料与动物
试验所用枯草芽孢杆菌制剂购自株洲智荟生物科技有限公司,有效活菌数为1×1010CFU/g;富硒酵母购自安琪酵母有限公司,硒含量为2 000 mg/kg。试验动物为45日龄湖羊断奶羔羊,由安徽省马鞍山市金农牧业有限公司提供。
1.2 试验设计
选取21只45日龄体况良好、平均体重为(9.65±0.38) kg的湖羊断奶羔羊,随机分为3组,即对照组、富硒酵母组和枯草芽孢杆菌组,每组7只羊。试验期28 d。参照《肉羊饲养标准》[5]配制基础饲粮(由安徽省马鞍山市金农牧业有限公司提供),对照组饲喂基础饲粮,试验组分别按照100 g/t的比例在精料中添加富硒酵母和枯草芽孢杆菌制剂。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1)每千克预混料含有 One kg of premix contained the following: VA 120 000 IU,VD360 000 IU,VE 1 900 mg,烟酸 niacin 360 mg,Zn 1.8 g,Cu 0.22 g,Mn 2.0 g,Ca 150 g,P 15 g,NaCl 75 g。2)代谢能、钙、磷为计算值,其他营养水平为实测值。ME, Ca and P were calculated values, while the other nutrient levels were measured values.
1.3 饲养管理
试验在安徽省马鞍山市金农牧业有限公司羊场进行,在预试时免疫注射三联四防疫苗,并注射伊维菌素溶液(0.2 mg/kg)进行驱虫处理。每天根据前1天料盆内剩余料重调整饲喂量,保证其自由采食和饮水。
1.4 样品采集
在试验的第28天,每组随机解剖3只羔羊。将小肠各段结合处用细线扎紧,以防污染样品,依次剪取十二指肠、空肠和回肠,并将小肠各段放入4%多聚甲醛固定液,用于苏木素-伊红(HE)染色检测肠道黏膜形态。
在无菌的条件下,将直肠内容物放于10 mL灭菌离心管中,冻存于-80 ℃冰箱保存。
1.5 小肠组织形态学测定
从十二指肠、空肠、回肠中间截取2 cm肠段,常规酒精脱水,石蜡切片后包埋,切片厚度5 μm,经HE染色后,树胶封片。在光学显微镜下观察,比较小肠绒毛的形态结构。每段小肠各取5张HE染色切片,每张切片选5个视野,数码拍照,应用Image pro-Plus 6.0图像处理软件在每张照片中测量5根最长的肠绒毛高度(以肠腺绒毛连接处到绒毛顶端为准)、最深的隐窝深度(以肠腺绒毛连接处到肠腺基部为准),并且计算绒毛高度与隐窝深度比值(V/C)。
1.6 肠道菌群的高通量测序
每组分别选取3份直肠内容物样品,称取0.2 g,采用DNA提取试剂盒提取DNA,样品浓度通过Qubit分光光度计检测。根据16S rDNA基因的V4区保守序列设计通用引物:上游引物是5′-GTGCCAGCMGCCGCGGTAA-3′,下游引物是5′-GGACTACHVGGGTWTCTATT-3′。PCR体系(50 μL)为:5 μL 10×Buffer A,1 μL 10 mmol/L dNTP,4 μL PCR Primer Cocktail,2 μL Primer F,0.2 μL KAPA Taq,25 μL PCR Master Mix,30 ng DNA和12.8 μL ddH2O。PCR程序为:98 ℃预变性3 min,98 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环,72 ℃保温7 min。PCR产物用1.5%琼脂糖凝胶电泳检测。MetaVxTM文库构建试剂盒测序文库。高通量测序文库的构建和基于Illumina MiSeq平台的测序由深圳华大基因科技有限公司完成。
16S rDNA测序分析采用QIIME进行质量控制。质控后的序列按照97%的相似性分别聚到1个操作分类单元(OTU)。将具有代表性的序列系统分类到门、纲、目、科、属、种的水平。丰富度和α多样性分析包括Sobs、Chao1、Ace、Shannon和Simpson指数和覆盖率。
1.7 数据统计分析
数据采用SPSS 17.0软件进行统计,多组之间的比较采用单因素方差分析和多重比较法,结果以平均值±标准差表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 富硒酵母和枯草芽孢杆菌对湖羊小肠黏膜形态的影响
由表2可知,与对照组相比,富硒酵母组和枯草芽孢杆菌组的十二指肠、空肠、回肠的绒毛高度显著提高(P<0.05),十二指肠和回肠的隐窝深度显著降低(P<0.05),空肠的隐窝深度极显著降低(P<0.01),十二指肠和空肠的V/C极显著提高(P<0.01),回肠的V/C显著提高(P<0.05)。
2.2 富硒酵母和枯草芽孢杆菌对湖羊羔羊直肠菌群的影响
2.2.1 测序数据质量分析结果
由表3可知,分析本试验中所采集的9个样品,共得到483 860条Tags,相关Tags共计达482 164条,所有样品的有效拼接比例均在99%以上,这说明本试验数据的可靠性较强。

表2 富硒酵母和枯草芽孢杆菌对湖羊小肠黏膜形态的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。表5至表9同。In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), and with different small letter superscripts mean significant difference (P<0.05), while with different capital letter superscripts mean significant difference (P<0.01). The same as Table 5 to Table 9.

表3 测序数据统计结果
2.2.2 样品OTU数量及α多样性分析
选取样品中最少的Tags条数,在97%相似度下将其聚类为用于物种分类的OTU,统计每个样品在每个OTU中的丰度信息,OTU的丰度初步说明了样品的物种丰富程度。通过表4得出,9个样品进行OTU聚类分析共产生4 065个OTU。对照组1 330个,富硒酵母组1 580个,枯草芽孢杆菌组1 155个,这说明各组间菌群丰度存在差异,富硒酵母组菌群丰富程度最高。
在97%的相似度下,得到了每个样品的OUT数量,利用Venn图可以展示多样品共有和各自特有OTU数量,直观展示样品间OTU的重叠情况。将样品数据混合后,3个组在种水平上细菌的群落组成如图1所示,3个样品一共含有不重复的细菌726种,其中富硒酵母组和枯草芽孢杆菌组共同拥有488种细菌,富硒酵母组和对照组共同拥有554种细菌,枯草芽孢杆菌组和对照组共同拥有482种细菌。
α多样性是对单个样品中物种多样性的分析,包括Sobs指数、Chao1指数、Ace指数,Shannon指数以及Simpson指数。前面4个指数越大,最后1个指数越小,说明样品中的物种越丰富。由表4可知,富硒酵母组和枯草芽孢杆菌组Simpson指数低于对照组,说明富硒酵母组和枯草芽孢杆菌组肠道菌群多样性高于对照组。此外,所有样品的覆盖率约等于1.00%,表明样品中未被检测到的可能性较低。
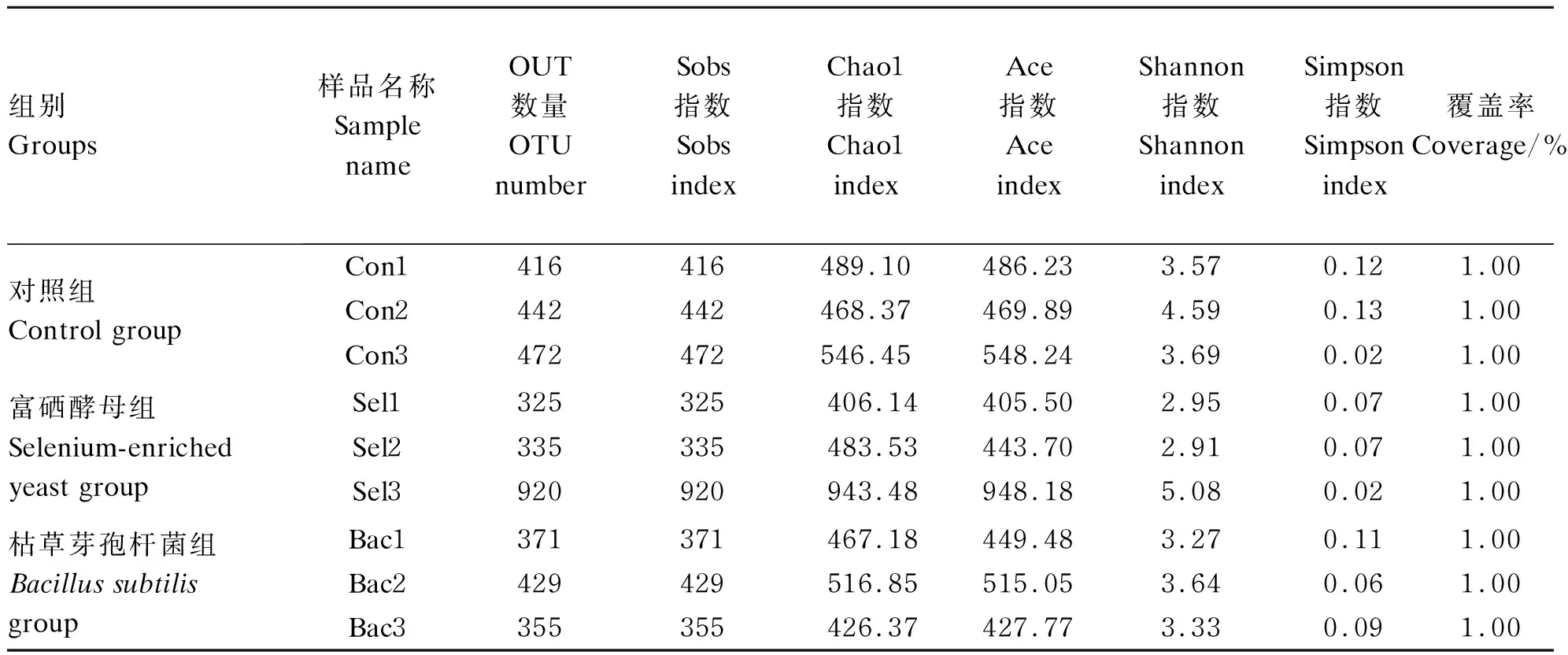
表4 样品α多样性分析及样品OTU统计

样品名称:Sel、Bac、Con。
2.2.3 物种累积曲线及OTU Rank曲线分析
物种累积曲线用于描述随着抽样量的加大物种增加的情况,被广泛用于抽样量充分性的判断以及物种丰富度的估计。微生物OTU Rank曲线能够展现样品中物种多样性。
由图2看出,随机抽到的序列数与观测到的OTU数量构建的物种累计曲线分析得出,样品曲线逐渐趋于平缓,说明有效测序数量已经能够较好地覆盖所有试验羔羊肠道菌种的多样性。对各样品的OTU丰度大小排序后,由图3看出所有样品中物种的OTU Rank曲线纵轴的形状逐渐平坦,由此看出,试验中样品的物种分布均匀,可用于多样性分析,可以为后续的样品分析提供基础。
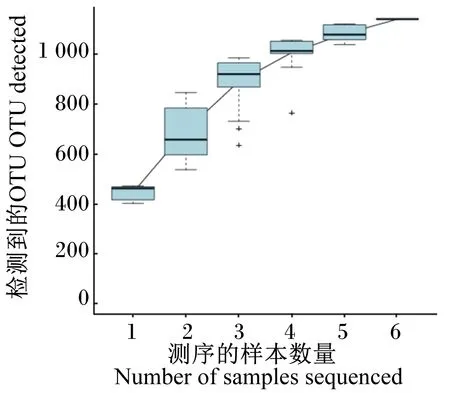
图2 物种累计曲线图

图3 OTU Rank曲线图
2.2.4 物种注释分析
通过与数据库进行比对,对OTU进行物种分
类,并分别在门、纲、目、科、属、种分类水平上对各个样品进行物种分析。
图4直观反映了不同门水平物种在每个样品中的相对丰度。由图4中得出,9个样品中分布最多的是厚壁菌门(Firmicutes),其次是放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、广古菌门(Euryarchaeota),说明这4种门水平的细菌是湖羊羔羊直肠的优势菌群。
由表5可知,与对照组相比发现,富硒酵母组和枯草芽孢杆菌组放线菌纲(Actinobacteria)相对丰度显著增加(P<0.05),梭菌纲(Clostridia)和δ-变形菌纲(Deltaproteobacteria)相对丰度显著降低(P<0.05),产芽胞菌纲(Erysipelotrichi)、甲烷杆菌纲(Methanobacteria)和ε-变形菌纲(Epsilonproteobacteria)相对丰度差异不显著(P>0.05),但有升高的趋势。
由表6可知,在每个样品中双歧杆菌目(Bifidobacteriales)、梭菌目(Clostridiales)、丹毒丝菌目(Erysipelotrichales)、甲烷杆菌目(Methanobacteriales)、拟杆菌目(Bacteroidales)和红椿杆菌目(Coriobacteriales)所占的比例较多。与对照组相比,富硒酵母组和枯草芽孢杆菌组双歧杆菌目、甲烷杆菌目和红椿杆菌目相对丰度显著提高(P<0.05),梭菌目相对丰度显著降低(P<0.05)。

图4 样品门分类水平中物种分布柱状图

表6 肠道微生物在目水平的物种相对丰度显著性分析
由表7可知,在每个样品中双歧杆菌科(Bifidobacteriaceae)、毛螺菌科(Lachnospiraceae)、甲烷杆菌科(Methanobacteriaceae)、瘤胃球菌科(Ruminococcaceae)和丹毒丝菌科(Erysipelotrichaceae)所占的比例较多。与对照组相比,富硒酵母组和枯草芽孢杆菌组的双歧杆菌科和丹毒丝菌科相对丰度显著提高(P<0.05),瘤胃球菌科相对丰度显著降低(P<0.05);富硒酵母组毛螺菌科和甲烷杆菌科相对丰度显著降低(P<0.05)。

表7 肠道微生物在科水平的物种丰度显著性分析
由表8可知,与对照组相比,富硒酵母组和枯草芽孢杆菌组双歧杆菌属(Bifidobacterium)、布雷德菌属(Bulleidia)、乳杆菌属(Lactobacillus)相对丰度显著增加(P<0.05),颤螺旋菌属(Oscillospira)、梭菌属(Clostridium)、粪球菌属(Coprococcus)、脱硫弧菌属(Desulfovibrio)相对丰度显著降低(P<0.05);富硒酵母组巨型球菌属(Megasphaera)相对丰度显著升高(P<0.05);枯草芽孢杆组丁酸弧菌属(Butyrivibrio)、甲烷短杆菌属(Methanobrevibacte)相对丰度显著升高(P<0.05)。

表8 肠道微生物在属水平的物种丰度显著性分析
由表9可知,与对照组相比,富硒酵母组和枯草芽孢杆菌组Sharpea_azabuensi相对丰度显著提高(P<0.05),Bacteroides_ovatus、Bacteroides_uniformis、Clostridium_hathewayi、Coprococcus_catus相对丰度显著降低(P<0.05);枯草芽孢杆菌组Lactobacillus_acidipiscis相对丰度显著提高(P<0.05)。
3 讨 论
3.1 富硒酵母和枯草芽孢杆菌对小肠黏膜形态的影响
小肠是动物进行营养物质消化和吸收的重要器官,小肠黏膜的发育程度不仅和动物机体的营养物质摄入息息相关,而且也参与肠道黏膜免疫反应[6]。小肠绒毛高度、隐窝深度及V/C是衡量小肠吸收功能的重要指标[7]。有研究证明,在育肥猪饲粮中添加酵母菌能够显著促进十二指肠的发育[8]。Yunusova等[9]研究表明,在母羊饲粮中添加富硒酵母,发现对分娩后产出羔羊的空肠肠道发育有显著的促进作用。齐博等[10]认为,枯草芽孢杆菌可显著提高肉仔鸡十二指肠绒毛高度和V/C。Mahmoud等[11]研究发现,在肉鸡饲粮中添加枯草芽孢杆菌可以显著增加空肠隐窝深度。祁凤华等[12]研究发现,在1日龄健康肉鸡饲粮中添加0.1%枯草芽孢杆菌,能显著提高十二指肠绒毛高度和V/C。周勃[13]的研究也表明,在肉鸡饲粮中添加枯草芽孢杆菌,能显著提高小肠各段绒毛高度、V/C、黏膜厚度及肌层厚度。从本试验结果看,在湖羊羔羊饲粮中添加富硒酵母和枯草芽孢杆菌显著提高了十二指肠、空肠、回肠的绒毛高显,显著降低了十二指肠和回肠的隐窝深度,极显著提高了十二指肠和空肠的V/C,说明富硒酵母和枯草芽孢杆菌对湖羊羔羊的小肠各段的发育有显著的促进作用。
3.2 富硒酵母和枯草芽孢杆菌对直肠菌群的影响
动物肠道中的菌群可以为宿主消化代谢营养物质,促进肠道的发育,同时抵御病原体,参与机体相关免疫功能的发挥[14]。Lv等[15]研究在仔猪饲粮中添加富硒酵母对高温环境下肠道微生态的影响,发现乳酸杆菌含量极显著提高。Li等[16]研究结果表明,酵母菌能增加大鼠肠道微生物数量和多样性,改善肠道免疫功能。刘红露等[17]研究酵母硒对肉鸡肠道菌群的影响,发现面包酵母硒不但可以增强机体抗氧化能力,而且能改善肠道菌群结构。Li等[18]研究发现在绍兴鸭饲粮中添加枯草芽孢杆菌后,盲肠菌群的数量显著增加,说明枯草芽孢杆菌能够显著改善绍兴鸭的肠道微生物区系。郑婷婷等[19]研究报道,从土壤中分离的枯草芽孢子杆菌显著提高肉鸡肠道消化球菌、双歧杆菌、乳酸菌以及总厌氧菌群的数量。Wu等[20]研究证实,在肉鸡饲粮中添加枯草芽孢杆菌后,肠道乳酸杆菌的数量显著提高,大肠杆菌数量显著减少,说明枯草芽孢杆菌可以促进肠道中有益菌群的增殖,降低有害菌群的数量。吴志新等[21]研究指出,枯草芽孢杆菌能够显著增加草鱼肠道中芽孢杆菌的比例和厌氧菌总数、双歧杆菌和乳酸菌的数量。任继平[22]研究指出,不同剂量的芽孢杆菌制剂都能显著提高盲肠或结肠中乳酸杆菌数量。从本试验结果看,富硒酵母组和枯草芽孢杆菌组中放线菌纲相对丰度显著增加,双歧杆菌目、甲烷杆菌目和红椿杆菌目相对丰度显著提高,双歧杆菌科和丹毒丝菌科相对丰度显著提高。有研究表明,双岐杆菌和乳杆菌能够酵解碳水化合物,促进肠道对营养物质的消化吸收,降低肠道内环境pH,抑制病原菌的生长入侵,从而保护肠黏膜屏障,提高宿主的免疫机能[23-24]。Kociolek等[25]研究证实,梭菌可产生外毒素,对人和动物都有较强的毒害作用。本试验中富硒酵母组和枯草芽孢杆菌组直肠中梭菌目相对丰度显著降低。因此,本试验结果说明富硒酵母和枯草芽孢杆菌能增加有益菌群的数量,抑制有害菌群的增殖,从而改善直肠肠道微生态,促进羔羊的消化功能,提高机体免疫力。
4 结 论
在饲粮中添加富硒酵母和枯草芽孢杆菌能够显著提高湖羊羔羊的小肠绒毛高度、V/C,促进小肠各段的发育。富硒酵母和枯草芽孢杆菌能够增加直肠有益菌群的丰度,抑制有害菌群的增殖,提高羔羊机体的免疫力。
