环境温度对肉羊有害气体排放、环境微生物和血清生化指标的影响
2018-11-16冯培功马君军杨华明班志彬闫晓刚
朱 伟 冯培功 马君军 张 然 郑 琛 杨华明 班志彬 梁 浩 闫晓刚*
(1.吉林省农业科学院畜牧科学分院,公主岭 136100;2.甘肃农业大学动物科学技术学院,兰州 730070)

1 材料与方法
1.1 试验设计与试验动物
1.2 试验饲粮
试验饲粮参考中国农业行业标准《肉羊饲养标准》(NY/T 816—2004)营养需要推荐量配制,其组成及营养水平见表1。
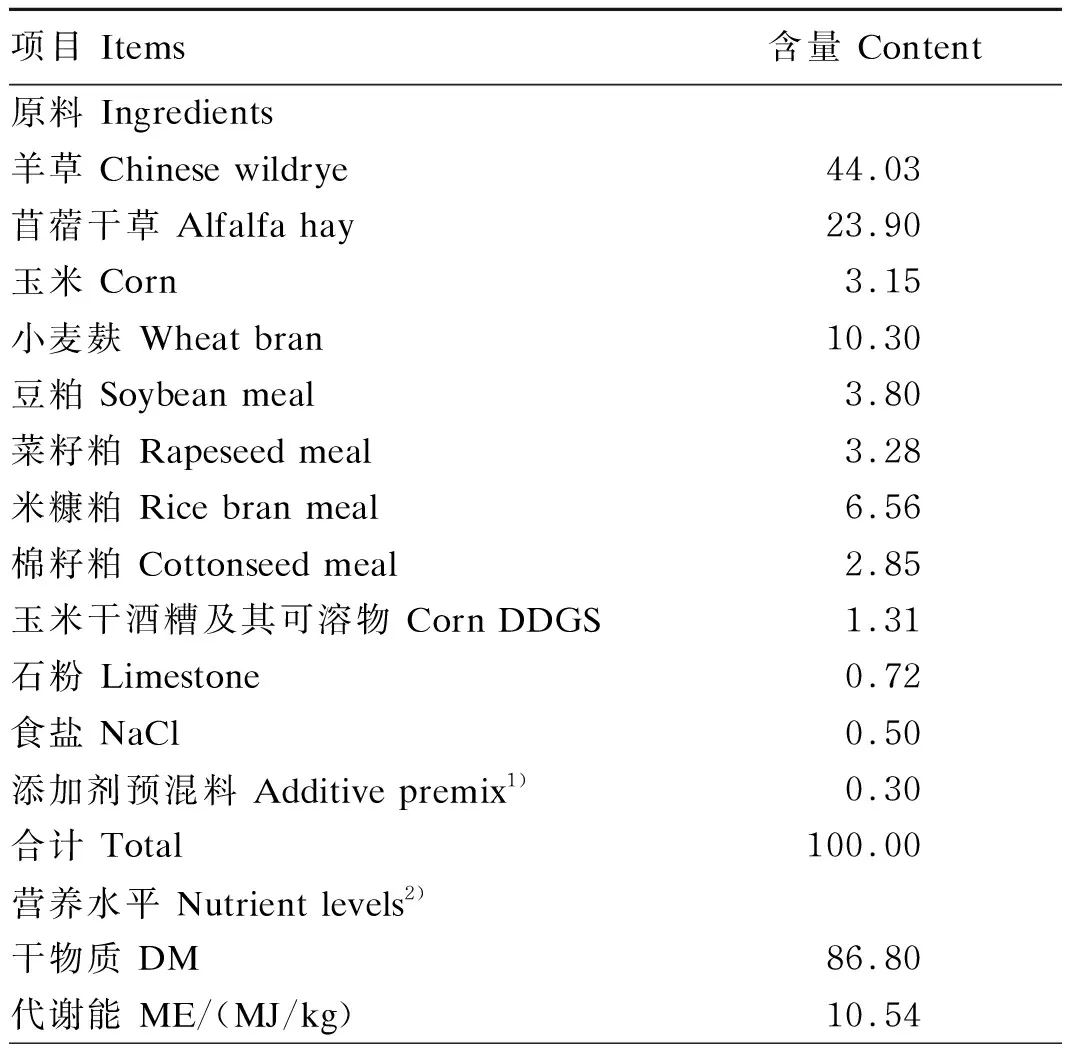
表1 试验饲粮组成及营养水平(干物质基础)

续表1项目 Items含量 Content粗蛋白质 CP11.78粗脂肪 EE2.80粗灰分 Ash8.12中性洗涤纤维 NDF53.69酸性洗涤纤维 ADF31.15钙 Ca0.81磷 P0.34
1)添加剂预混料为每千克饲粮提供 The additive premix provided the following per kg of the diet:Fe 38 mg,Zn 44 mg,Cu 15 mg,I 0.5 mg,Mn 50 mg,Se 0.3 mg,Co 0.05 mg,VA 354 IU,VD 94.4 IU,VE 1.06 mg。2)代谢能根据NRC(2001)计算,其他为测定值。ME was calculated according to NRC(2001), while the others were measured values.
1.3 饲养管理
预试前每只试验羊口服伊维菌素片进行驱虫处理,试验羊在代谢笼内单独饲养,每日饲喂2次(07:00、18:00),自由饮水。
1.4 指标测定与方法
1.4.1 饲粮营养成分测定
饲粮样品中干物质(DM)、粗蛋白质(CP)、有机物(OM)、粗灰分(Ash)、粗脂肪(EE)、钙(Ca)、磷(P)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量的测定分别按照GB/T 6435—2006、GB/T 6432—1994、GB/T 6438—2007、GB/T 6434—1994、GB/T 6433—2006、GB/T 6436—2002和GB/T 20806—2006的方法进行。
1.4.2 O2、CO2、CH4、NH3和H2S浓度测定
呼吸测热装置的气路结构流程如文献[5-6]所示,该装置由进排气装置、呼吸小室、高精度气体在线分析仪、数据采集控制仪和温湿度控制系统组成。1)进排气装置,进入和排出呼吸室的空气流量为0.01~2.00 L/min。2)呼吸小室,容积为3.20 m3,均由有机玻璃制成。小室内设有专用的喂料槽和饮水容器以及粪、尿收集设施。呼吸室均与该装置中的电路、气路系统相连。3)吉林省农业科学院畜牧科学分院自主研制的高精度气体在线分析仪,气体分析仪参数:O2量程0~1.2%,±0.2%,分辨率1.0 mg/m3;CO2量程0~1.5%,±0.2%,分辨率1.0 mg/m3;CH4量程0~0.2%,±0.02%,分辨率1.0 mg/m3。校正:为了在分析过程中保证分析仪的准确性,分别用不同浓度的标准气体校正O2、CO2和CH4的气体传感器,使之达到真正的准确性。4)数据采集控制仪,该系统由电脑控制,根据试验研究的不同需要,可分别提供单通道、双通道、三通道、四通道共4种采集分析模式。5)温湿度控制系统,呼吸小室内的可控温度为-5~50 ℃;可控湿度为40%~85%。呼吸代谢室可以按不同试验研究目的和要求进行控制。
O2、CO2和CH4气体:本试验正试期开始将单只试羊放入代谢笼中,然后推入呼吸代谢室内,通过探头依次测定每个代谢室内的O2、CO2和CH4的浓度,开始连续10 d气体测定。每个小室内系统采集气体1次需要3 min,采集后系统会根据室内外O2、CO2和CH4浓度,统计各时间点试羊产生的CH4、CO2浓度和消耗的O2浓度及呼吸熵,试验结果自动保存。
消耗的O2浓度(L/min)=[进呼吸室空气量(L/min)×户外空气O2浓度]-[排出呼吸室空气量(L/min)×呼吸室内O2浓度];产生的CO2浓度(L/min)=[排出呼吸室空气量(L/min)×室内CO2浓度]-[进呼吸室空气量(L/min)×室外CO2浓度];产生的CH4浓度(L/min)=[排出呼吸室空气量(L/min)×室内CH4浓度]-[进呼吸室空气量(L/min)×室外CH4浓度];呼吸熵(RQ)=产生的CO2浓度/消耗的O2浓度。
NH3和H2S气体:NH3浓度测定采用靛酚蓝比色法测定(GB/T 18204.25—2000),H2S浓度测定采用亚甲基蓝比色法测定(GB 11742—1989)。在正试期每天11:00、14:00和17:00各测定1次,每次测定前用大型气泡吸收管吸取10 mL NH3和H2S标准吸收液,打开呼吸代谢室抽气阀门,调节微型气泵以0.5和1.5 L/min流量分别抽取5和30 L的NH3和H2S,采样后的样品置于暗处,并在6 h内比色,并记录采样时的温度和大气压力。
1.4.3 微生物数量测定
正试期每天饲喂前(07:00、18:00)按照环境监测技术规范要求设计采样点,采用五点采样法,高度为距离呼吸代谢室地面1.5 m,把倒好的培养皿分别放置于固定位点15 min后取出,记录采样点和呼吸室编号,在37 ℃恒温培养箱中培养24 h,计算平板菌落数,按照奥氏公式[7]计算呼吸代谢室内大肠杆菌(麦康凯琼脂培养基)、金黄色葡萄球菌(甘露醇氯化钠琼脂)、沙门式菌(SS琼脂)、总菌(营养琼脂NA)数量。以上培养基均购自青岛海博生物技术有限公司。微生物数量计算公式如下:
式中:C为空气细菌数(CFU/m3);N为菌落数(CFU);A为平皿面积(cm2);T为采样时间(min)。
1.4.4 血清生化指标测定
在正试期第10天早晨采集试验羊颈静脉血液5 mL,制备血清,测定血清中肾上腺皮质酮(CORT)、免疫球蛋白(IgG)浓度和肌酸激酶(CK)和乳酸脱氢酶(LDH)活性。采用试剂盒测定,试剂盒购自上海酶联生物科技有限公司。
1.5 统计方法
试验数据经Excel 2016整理后,采用SPSS 19.0软件的one-way ANOVE进行方差分析,差异显著的采用Duncan氏法进行多重比较,并列出SEM和P值,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 环境温度对肉羊CO2和CH4排放的影响
由表2、表3可知,环境温度对呼吸代谢室内CO2浓度无显著影响(P>0.05),从08:00至16:00,呼吸代谢室内CO2浓度先升高后降低,最低浓度出现在08:00,其浓度为4 257.09 mg/m3、220.96 mg/(m3·W0.75),10:00时达到最大浓度10 275.89 mg/m3、538.66 mg/(m3·W0.75)。由表4、表5可知,除了08:00以外,其他时间在10~15 ℃呼吸代谢室内CH4浓度极显著高于20~25 ℃和30~35 ℃呼吸代谢室内CH4浓度(P<0.01)。在08:00至16:00,呼吸代谢室内CH4浓度整体先升高后降低,在11:00出现峰值250.62 mg/m3、13.04 mg/(m3·W0.75),最低浓度为119.19 mg/m3、6.03 mg/(m3·W0.75)。20~25 ℃温度条件下,在各时间点呼吸代谢室内CH4浓度均低于10~15 ℃和30~ 35 ℃呼吸代谢室内CH4浓度,最低为7.05 mg/m3、0.05 mg/(m3·W0.75)。
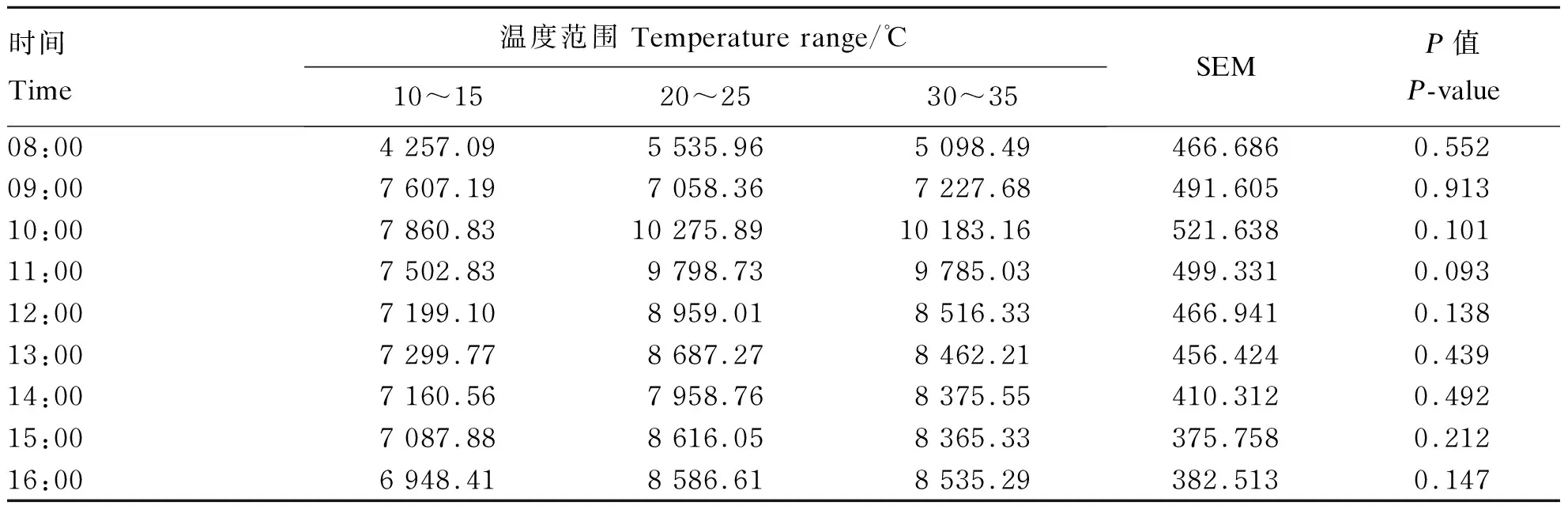
表2 环境温度对肉羊CO2排放的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。下表同。Values with no letter or the same letter superscripts within a row mean no significant difference (P>0.05), while with different capital letter superscripts mean significant difference (P<0.01), and with different small letter superscripts mean significant difference (P<0.05). The same as below.
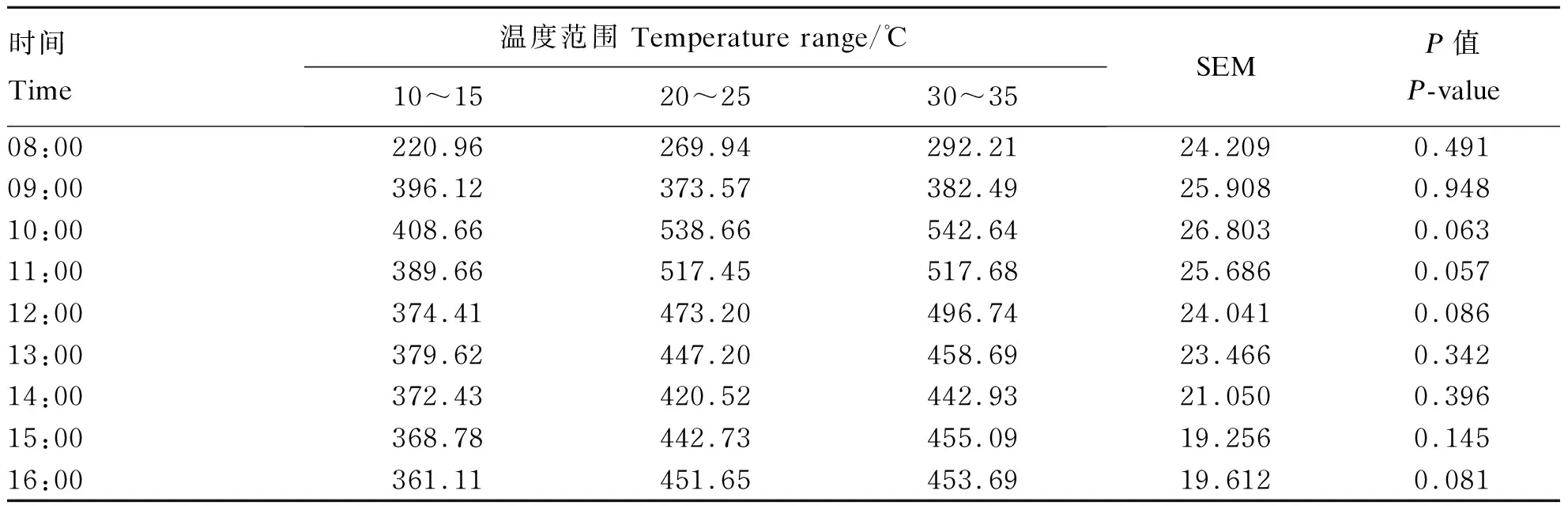
表3 环境温度对肉羊单位代谢体重CO2排放的影响
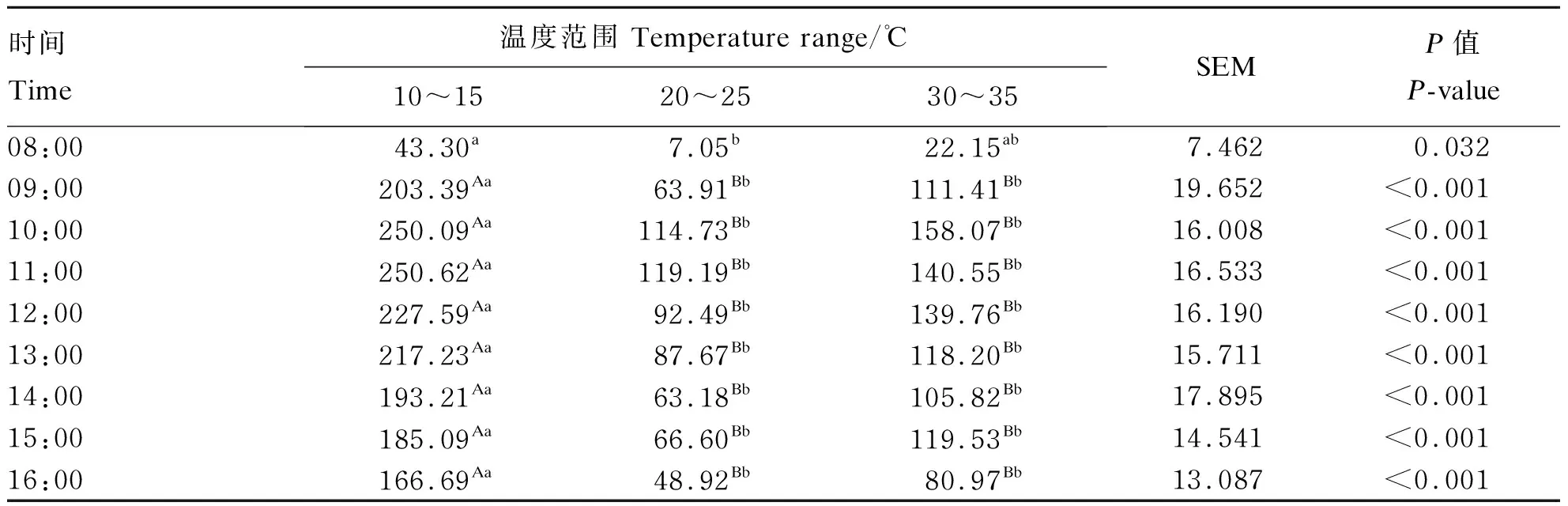
表4 环境温度对肉羊CH4排放的影响
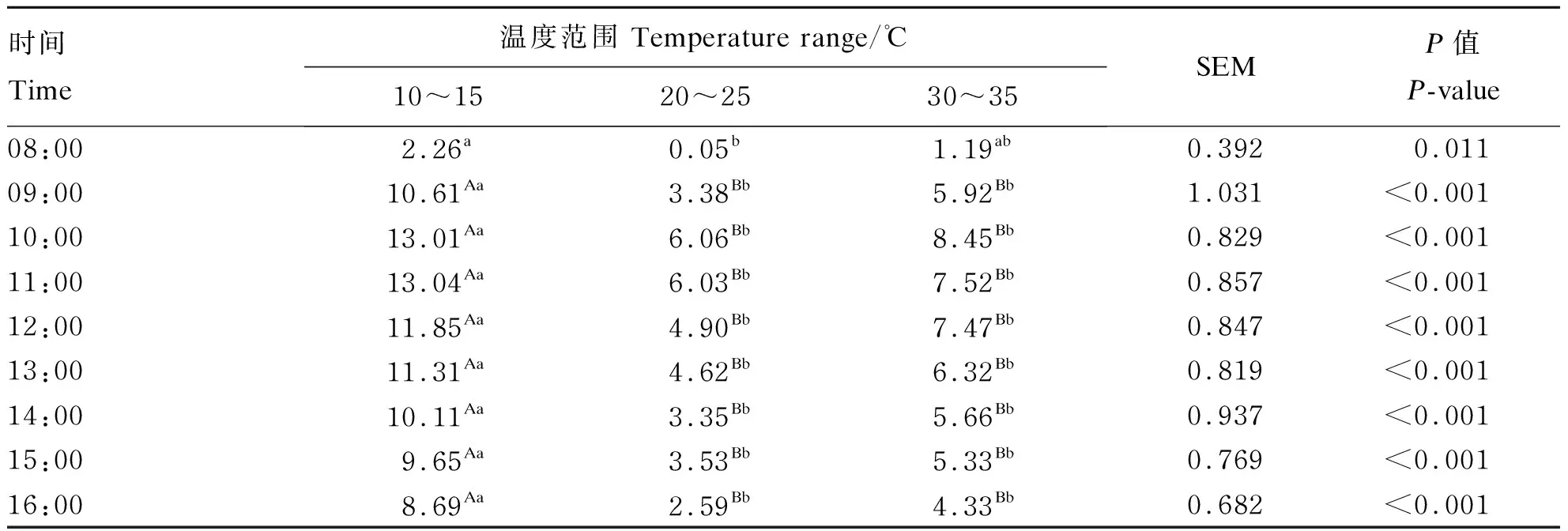
表5 环境温度对肉羊单位代谢体重CH4排放的影响
2.2 环境温度对肉羊CO2和CH4总排放的影响
由表6可知,环境温度对肉羊呼吸代谢室内CO2浓度无显著影响(P>0.05),但对CH4浓度有极显著影响(P<0.01)。在10~15 ℃呼吸代谢室内CH4浓度极显著高于20~25 ℃和30~35 ℃呼吸代谢室内CH4浓度,分别是其他2组呼吸代谢室内CH4浓度的2.13倍、1.83倍(P<0.01)。在20~25 ℃呼吸代谢室内CH4浓度低于10~15 ℃和30~35 ℃呼吸代谢室内CH4浓度;30~35 ℃和20~25 ℃呼吸代谢室内呼吸熵极显著高于10~15 ℃呼吸代谢室呼吸熵(P<0.01)。在10~15 ℃,肉羊干物质采食量显著高于30~35 ℃干物质采食量(P<0.05)。
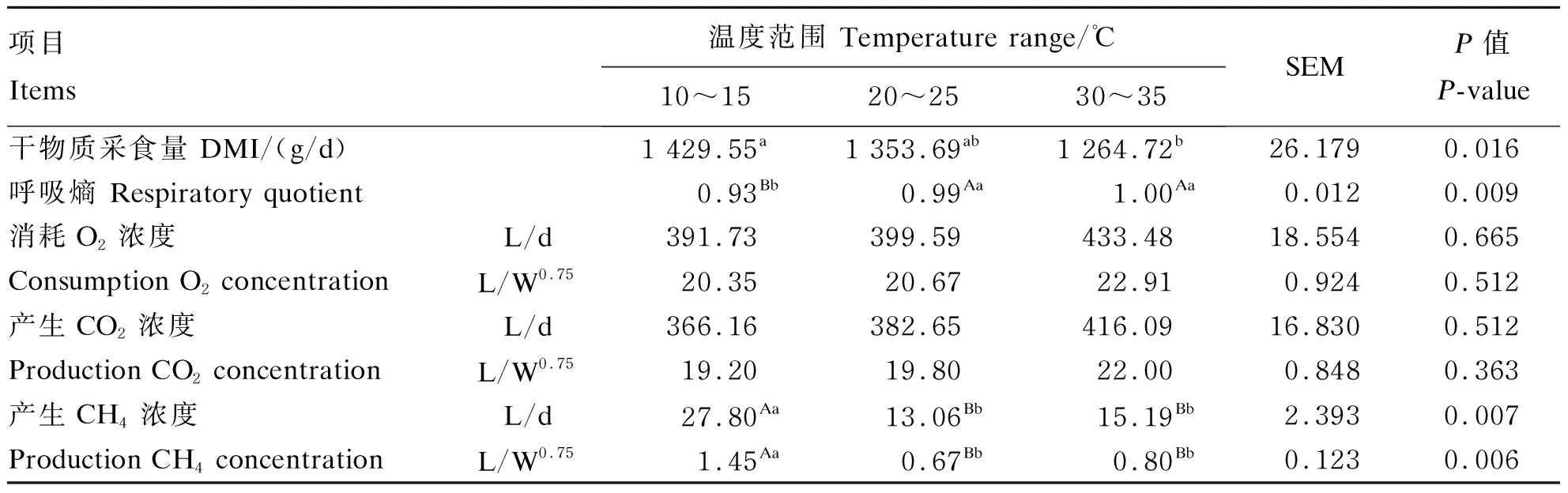
表6 环境温度对肉羊CO2、CH4总排放量及呼吸熵的影响
2.3 环境温度对肉羊NH3和H2S排放的影响
由表7可知,温度对呼吸代谢室内NH3浓度影响极显著(P<0.01),30~35 ℃呼吸代谢室内NH3浓度分别极显著高于10~15 ℃和20~25 ℃呼吸代谢室内NH3浓度(P<0.01),但温度对呼吸代谢室内H2S排放无显著影响(P>0.05)。
2.4 环境温度对呼吸代谢室内微生物数量的影响
由表8可知,在30~35 ℃呼吸代谢室内大肠杆菌数量极显著高于10~15 ℃和20~25 ℃呼吸代谢室内大肠杆菌数量(P<0.01);30~35 ℃呼吸代谢室内沙门氏菌和总菌数量极显著高于10~15 ℃呼吸代谢室内沙门氏菌和总菌数量(P<0.01),但对20~25 ℃呼吸代谢室内沙门氏菌和总菌数量无显著影响(P>0.05);温度对呼吸代谢室内金黄色葡萄球菌数量无显著影响(P>0.05)。
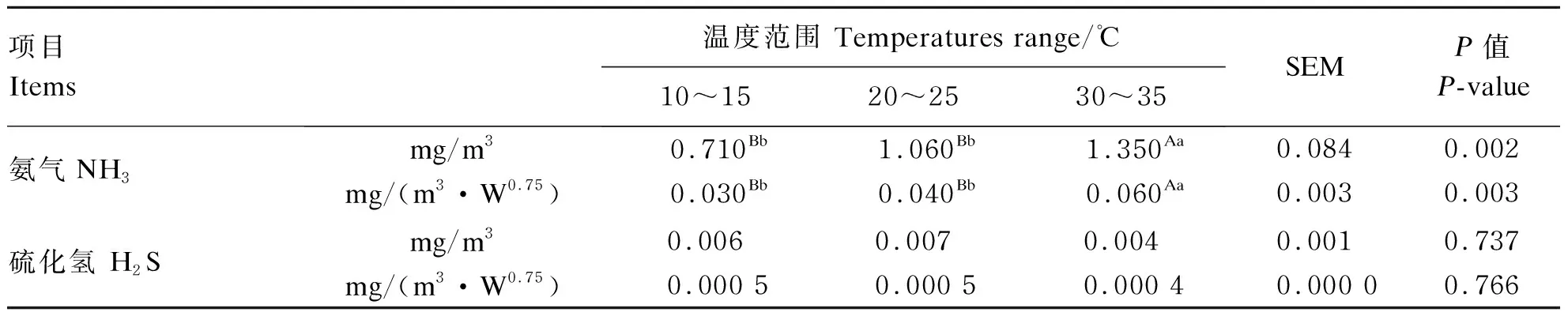
表7 环境温度对肉羊NH3和H2S排放的影响
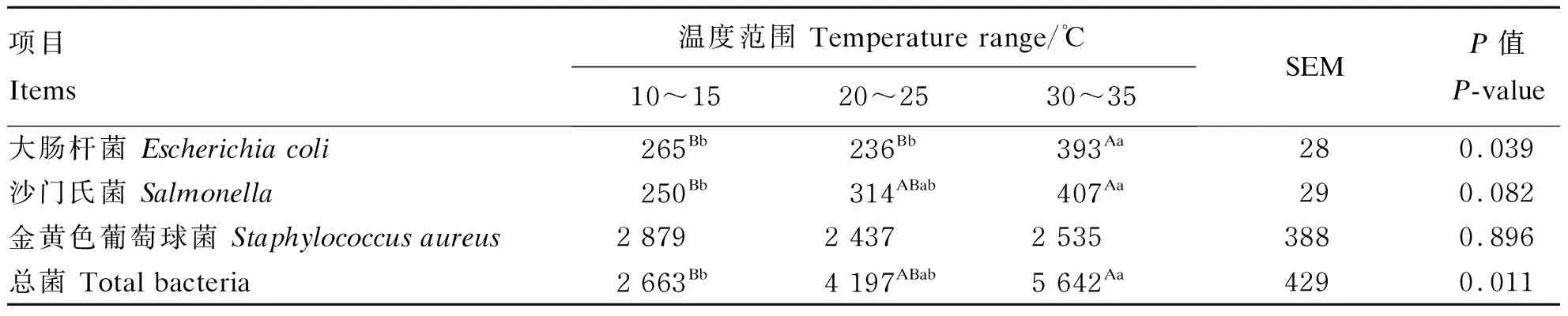
表8 环境温度对呼吸代谢室内微生物数量的影响
2.5 环境温度对肉羊血清生化指标的影响
由表9可知,环境温度对肉羊血清中CORT、IgG浓度和CK、LDH活性均无显著影响(P>0.05)。
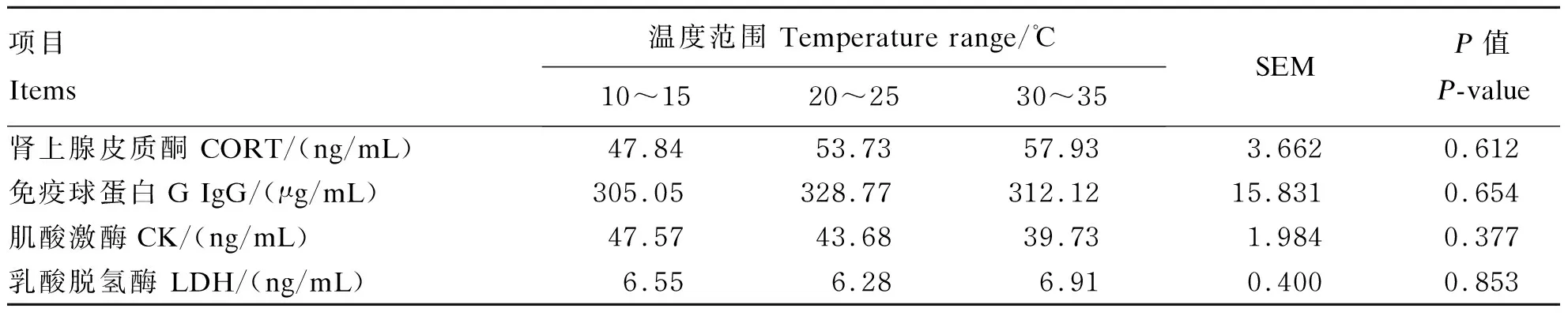
表9 环境温度对肉羊血清生化指标的影响
3 讨 论
3.1 环境温度对肉羊CO2和CH4排放的影响
反刍动物瘤胃发酵中产生的气体速度以采食时最快,其组成为CO240%、CH430%~40%,所以CO2和CH4排放量呈先升高后降低趋势,其中一部分CO2是发酵的副产物,另一部分是有机酸和唾液中碳酸盐反应生成,但所产生的CO2大部分还原形成CH4,部分被微生物利用。CO2为在动物有机体活细胞内,在酶的催化下,以葡萄糖和氧为原料,经过三羧酸循环(TCA)等一系列的氧化还原反应生成终产物,同时为机体提供能量(ATP),是机体正常生理活动的终产物。其在体内总反应式如下,无氧呼吸:C6H12O6→2C2H5OH+2CO2+ATP;有氧呼吸:C6H12O6+6H2O+6O2→6CO2+12H2O+ATP。本试验结果表明,环境温度对CO2浓度无显著影响,这可能是因为哺乳动物可以通过机体产热和散热调节使体温相对恒定,温度对机体生理活动没有产生影响。影响动物CO2排放量的因素主要有温度、畜舍结构和饲养密度等。目前已发表的关于温度对动物CO2排放量影响的试验结果大多与本试验结果类似。陈家宏[8]在夏季羊舍小气候环境监测数据发现,随环境温度变化CO2浓度保持在一个相对稳定的状态,且主要分布在与畜体等高的空间。欧阳宏飞[9]通过检测新疆冬季密闭羊舍的环境参数发现,CO2浓度始终在1 785 ~ 2 582 mg/m3,昼夜温差没有显著影响CO2浓度。丁莹[10]研究了内蒙古四季规模化羊场舍内CO2浓度变化规律,结果发现双坡式羊舍夏季CO2浓度最高,为1 323 mg/m3,但与其他季节无显著差异。陈家宏等[11]在3种南方羊舍夏季小气候环境对比研究中发现,饲养密度与CO2排放量有强相关性,但与温度无相关性。
反刍动物98.7%的CH4主要是瘤胃发酵产生,其中约82%的CH4主要是通过瘤胃甲烷菌以CO2和H2为底物,由一系列酶和辅酶合成CH4,其中纤维分解菌等对饲粮中的植物纤维、碳水化合物等厌氧发酵,最终产物为挥发性脂肪酸(VFA),经过一系列化学反应也生成CH4。本试验结果发现,环境温度对CH4排放有极显著影响,20~25 ℃时呼吸代谢室内CH4浓度最低,为13.06 L/d,但10~15 ℃为27.80 L/d,这可能是因为温度升高使肉羊干物质采食量显著降低,导致低温环境瘤胃发酵时间延长。赵一广[12]研究饲粮不同采食水平对肉用绵羊CH4排放的影响,结果发现CH4排放量与干物质采食量呈极显著线性关系:CH4与干物质采食量的估测方程为CH4(L/d)=44.034×干物质采食量(kg)-6.514(R2=0.680 1,P=0.000 5)。蔡丽媛[13]研究热应激环境对山羊瘤胃发酵的影响,结果发现热应激条件下瘤胃总VFA产量下降,乙酸浓度降低,丙酸和丁酸浓度升高,CH4排放量降低。陈昌明等[14]研究夏季高温对水牛瘤胃代谢的影响,结果发现夏季高温期间,试验水牛的呼吸率、瘤胃温度和直肠温度升高,采食量减少,饮水量增加,瘤胃液流速减缓,高温初期出现瘤胃微生物代谢速率升高,但持续高温会抑制瘤胃微生物代谢速率,乙酸/丙酸降低,从而CH4排放量减少。
3.2 环境温度对肉羊NH3和H2S排放的影响

3.3 环境温度对呼吸代谢室内环境微生物的影响
畜舍内空气微生物数量是评价畜舍空气环境卫生质量的重要指标之一,动物体本身就是各种病原微生物的携带者,反刍动物瘤胃、消化道内含有大量细菌、原虫和真菌,通过呼吸、打喷嚏和动物粪便向外界环境传播,还可借助气流传播到较远的距离,导致疾病的流行,影响人类和畜禽免疫力及生产性能[23],如当猪保育舍环境中大肠杆菌数量较多时,将显著增加仔猪的腹泻发病率,甚至导致死亡。本研究结果表明,随温度升高呼吸代谢室内大肠杆菌、沙门氏菌和总菌数量显著升高,这是因为肉羊在高温环境条件下活动量增大,使室内空气中悬浮颗粒物增多,同时温度升高也可加快空气中悬浮颗粒物的运动速率,导致单位体积微生物数量增多[24-27]。司红丽等[27]报道指出舍内空气微生物数量随温度与饲养密度的升高而升高。王涛等[28]对乌鲁木齐市冬季10个养殖场舍内空气微生物数量检测发现,舍内空气微生物数量与温度呈正相关关系,优势菌群为大肠杆菌。熊云梅[29]研究发现羊场四季气载需氧活菌数量及葡萄球菌浓度变化相对稳定,其变化趋势为春季<秋季<冬季<夏季,表明在高温和高湿环境条件下,适宜细菌繁殖,导致畜舍环境有害微生物数量较多。
3.4 环境温度对肉羊血清生化指标的影响
动物处于高温高湿环境时,动物开始出现体温和呼吸频率升高、采食量和反刍频率降低等热应激反应,动物开始利用自身的防御系统克服热应激造成的不良影响,使机体保持相对恒温状态。宋小珍等[30]研究热应激对肉牛血清激素和生理指标的影响,发现试验牛的呼吸频率、腹泻率、血清LDH活性均显著高于非热应激期,血清皮质醇(COR)浓度在第20天显著升高,而后逐渐恢复正常,表明生理指标不仅与热应激有关,而且也与热应激持续时间有强相关性。李俊杰等[31]研究热应激对公牛血清生化指标的影响,结果发现肉用种公牛夏季血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性最高,而血清CK活性趋于较低水平。本次试验中,环境温度对肉羊CO2排放没有显著影响,这也证明在10~35 ℃动物生理活动基本处于稳恒状态,高温对肉羊生理活动没有产生显著影响。肉羊血清CK活性随温度的升高逐渐降低,与上述报道不同,但杨玉英等[32]研究不同温度对中国荷斯坦奶牛血清生化指标的影响,结果发现血清CK活性随着温度的上升而呈波动性下降趋势,在25 ℃时显著低于其他温度(5、10、15、20 ℃),这与宋小珍等[30]和王士长等[3]关于CK的研究结果不一致。CK是一种与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶,且酶活性升高持续时间比较短,2~4 d恢复正常。这也说明此酶与热应激持续时间有关,如罗宗刚等[33]、蔡明成等[34]研究发现,热应激初期肉牛血清中CK活性随应激持续时间的延长而升高。这种不规律的变化可能是受热应激持续时间和不同品种动物对热应激敏感性的影响,但其深层次原因和机理有待于进一步研究。
4 结 论
① 本研究结果表明,温度对肉羊呼吸代谢室内CO2浓度无显著影响;10~15 ℃呼吸代谢室内CH4浓度极显著高于20~25 ℃和30~35 ℃呼吸代谢室内CH4浓度,20~25 ℃呼吸代谢室内CH4浓度在各个时间点最低。
② 呼吸代谢室内大肠杆菌、沙门氏菌和总菌数量随温度升高显著增加,但金黄色葡萄球菌数量无显著差异。
③ 温度对肉羊血清CORT、IgG浓度及CK、LDH活性无显著影响。
