核酸检测联合酶联免疫吸附试验在献血者血液感染性指标筛查中的应用
2018-11-16孙春玲
孙春玲
(周口市中心血站检验科,河南 周口466000)
为保障临床输血安全,多年来我国采供血机构采用两种不同厂家酶联免疫吸附试验(ELISA)试剂对献血者血液标本进行乙型肝炎表面抗原(HBs Ag)、丙型肝炎抗体(抗-HCV)、人类免疫缺陷病毒抗体(抗-HIV)等血清学项目检测,但由于窗口期感染、病毒核酸变异以及隐匿性感染等因素,使得部分献血者血液虽经血清学检测合格后仍然存在感染乙型肝炎、丙型肝炎和艾滋病的风险[1]。依据《血站技术操作规程(2015)》(国家卫生计生委关于印发血站技术操作规程(2015版)的通知.国卫医发〔2015〕95号)要求,自2016年3月1日始我国采供血机构对献血者血液标本全面实施ELISA和核酸检测(NAT)两种方法联合检测,以降低经输血传播乙型肝炎、丙型肝炎和艾滋病的风险。本文回顾分析64 420例献血者的实验室筛查资料,为提高血液质量及确保输血安全提供依据。
1 材料与方法
1.1 研究对象
选择周口市中心血站2016年3月至2017年4月采集的无偿献血者血液标本64 420例为研究对象,其中男30 790例,女33 630例,年龄18~60岁,中位年龄32岁;初次献血39 940例,重复献血24 480例。所有献血者均符合献血者健康检查要求[2],均签署自愿献血协议书。
1.2 检测试剂与仪器
检测试剂:初检HBs Ag、抗-HCV、梅毒螺旋体抗体(抗-TP)、抗-HIV ELISA试剂由珠海丽珠生物技术有限公司提供,复检 HBs Ag、抗-HCV、抗-TP、抗-HIV ELISA试剂由厦门新创生物技术有限公司提供;初检、复检丙氨酸氨基转移酶(ALT)检测试剂盒分别由贝克曼库尔特实验系统(苏州)有限公司和上海科华生物工程股份有限公司提供;HBV/HCV/HIV三联合核酸提取试剂和检测试剂由上海浩源生物科技有限公司提供。ELISA法和NAT质控品均由北京万泰生物科技有限公司提供。试剂和质控品均批批检合格并在有效期内使用。主要血清学检测仪器:初检仪器主要是瑞士RSP 150加样系统和德国BEPⅢ第三代全自动酶免系统,复检仪器主要是MF-FA ME24/30全自动酶免系统,ALT检测设备为贝克曼AU480型全自动生化分析仪。NAT检测仪器:Chi TaS BSS1200系统、HAMILTON-EZbead系统和ABI7500全自动PCR扩增分析仪。所有检测设备均经过厂家校验,且均可良好运行。
1.3 ELISA和NAT检测方法
1.3.1 标本留取
采集献血者静脉血于两支试管(每管5 mL血样),1支为EDTAK2抗凝管,用于 HBs Ag、抗-HCV、抗-TP、抗-HIV和ALT血清学检测;另1支为含分离胶、无菌、无RNA酶和无DNA酶的真空采血管,用于HBV-DNA、HCV-RNA和HIV-RNA检测。标本留取后在2~8℃环境保存,核酸试管采集血样后4 h内完成离心、分离出血浆并在72 h内完成HBV-DNA、HCV-RNA和HIV-RNA检测。
1.3.2 ELISA 检测
64 420例无偿献血者标本均使用两种不同厂家的试剂检测,每批实验设空白对照孔、阴性对照孔、阳性对照孔、室内质控孔,完成HBs Ag初、复检检测,初检和复检由不同人员操作。结果判定标准:S/CO(样本吸光度值/临界值)≥1.0判为阳性,0.7<S/CO<1.0判为灰区,S/CO≤0.7判为阴性。抗-HIV检测为阳性标本送至周口市疾病预防控制中心HIV确认实验室进行确认。
1.3.3 NAT 检测
将ELISA检测为阴性的无偿献血者标本,每8个标本混为一个混样池,且均设定内标对照。混样测定无反应判为阴性,混样测定有反应时予以拆分检测,拆分后无反应者判为阴性,拆分后有反应者判为阳性。
1.4 统计学方法
采用SPSS20.0统计软件包分析数据,比较采用χ2检验,检验水准a=0.05,以P<0.05表示差异有统计学意义。
2 结果
2.1 血清学指标检测结果
在64 420例献血者中ALT、HBs Ag、抗-HCV、抗-HIV和抗-TP血清学检测共1362项不合格,其中ALT不合格220项,在以上1362项不合格中,21例存在两项指标重叠感染,因而共计1341例献血者血清学检测不合格,63 079例献血者血清学检测结果合格。64 420 例献血者 HBs Ag、抗-HCV、抗-HIV和抗-TP检测结果见表1。

表1 64 420例献血者HBs Ag、抗-HCV、抗-HIV和抗-TP检测结果
2.2 血清学检测结果合格献血者NAT检测情况
在血清学检测均合格的63 079例献血者中,检出HBV-DNA阳性57例(0.09%),HIV-RNA阳性1例,未检出HCV-RNA阳性献血者。
2.3 HBs Ag(-)/HBV-DNA(+)献血员分布情况
在血清学检测均合格的63 079例献血者中,HBV-DNA阳性检出率男性和女性比较差异无统计学意义(P>0.05);初次献血与重复献血者比较及不同年龄段献血者比较差异均有统计学意义(P<0.05,P<0.01)。见表2。
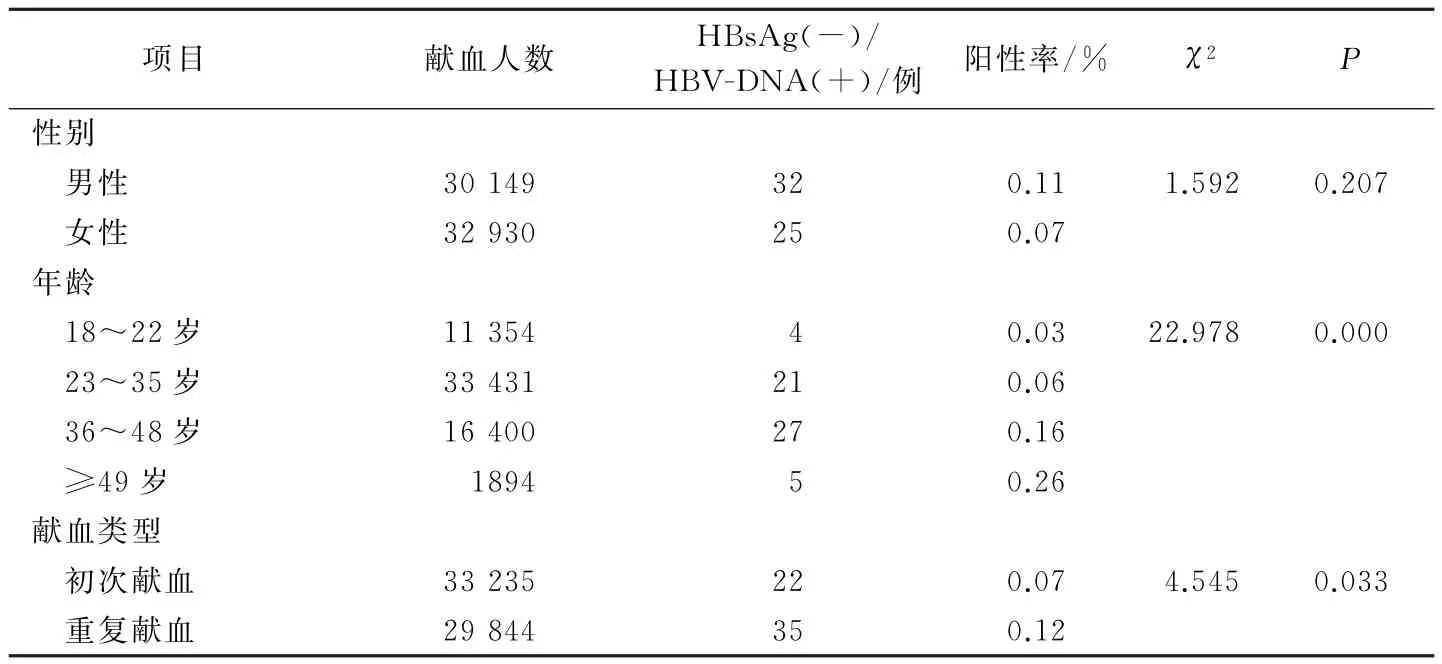
表2 63 079例献血者中HBV-DNA检测阳性/HBs Ag阴性献血员分布情况
3 讨论
目前输血及血液制品是临床疾病治疗不可替代的重要措施,多年来,采供血机构一直采用血清学技术检测输血相关病毒标志物的抗原或抗体,极大地降低了经输血传播乙型肝炎、丙型肝炎等感染性疾病,但由于试剂灵敏度、窗口期感染、病毒基因变异、免疫静默、隐匿性感染等诸多因素存在[3],有极少部分献血者血液虽经ELISA法检测合格,输注患者后仍然可引起乙型肝炎、丙型肝炎、艾滋病等感染性疾病的传播。虽然ELISA检测试剂盒的灵敏度、特异性在不断提高,但仍相继有不同文献报道经输血传播肝炎、HIV的案例[4-6],给患者的健康造成极大危害。
ELISA法检测是以抗原、抗体作为检测对象,曾劲峰等[7]研究显示,约70%的HCV和90%的HIV、HBV ELISA法漏检是由窗口期感染引起,此时ELISA法常检测不出来而造成漏检,而NAT检测可将HCV、HBV和HIV的窗口期分别缩短82%(59 d)、20%(9 d)和50%(11 d)。NAT 是一种具有较高特异性和敏感性的免疫学检测方法,其通过核酸扩增技术捕获献血者血液标本中较早出现的病毒核酸,可检出因病毒变异、窗口期感染ELISA法漏检的标本[8],并且具有操作过程简便、易于自动化、核酸标本回收率高等优势,适于采供血机构对献血者标本进行大规模筛查。
本研究中,63 079例经血清学检测HBs Ag、抗-HCV、抗-HIV呈阴性献血者中,应用上海浩源Chi Tas 1200核酸检测筛查出57份(0.09%)HBV-DNA阳性,高于林红等[9]报道的0.06%阳性率,这可能与本地区是乙型肝炎的高流行病区域,自然人群中乙型肝炎的感染率较高有关。HBV血清转换前窗口期与隐匿性乙肝病毒感染(OBI)献血者是导致HBs Ag筛查后输血传播感染HBV残余风险的主要原因[10]。HBV窗口期感染与隐匿性乙肝病毒感染的献血者均为血清HBs Ag阴性、HBV-DNA阳性,HBV窗口期感染献血者HBs Ag会随着时间推移由阴性转换为阳性,而OBI献血者其HBs Ag一般不会转换为阳性,通常伴随抗-HBc阳性,但部分低滴度抗-HBs献血者中也会存在[11]。河南省是HCV高发地区,1~75岁自然人群中HCV阳性率高于全国平均水平[12],但本文并未检出HCV-RNA,这可能与HCV主要感染肝细胞,当肝细胞坏死后方可释放HCV进入血液中有关。抗体产生通常伴随HCV感染且抗-HCV比较稳定,而HCV-RNA在4℃或室温易被环境中RNA酶降解,其只有在-20℃以下环境保存时比较稳定,因此HCV-RNA检测并不能完全代替以往的ELISA筛查,两种方法互补检测才能更好地提高血液质量。
此外,本研究结果显示,在63 079例血清学检测合格献血者中,不同性别献血者HBV-DNA阳性率比较差异无统计学意义(P>0.05),而在不同年龄段分组比较差异有统计学意义(P<0.01),≥49岁年龄段献血者HBV-DNA阳性率最高(0.26%),18~22岁年龄段献血者阳性率最低(0.03%),这可能与随献血者年龄增长其机体免疫功能逐渐下降相关[11];我国自20世纪90年代开始将乙型肝炎疫苗纳入新生儿计划免疫,因而18~22岁年龄段献血者乙肝疫苗接种率较高,此年龄段献血者HBV-DNA阳性率较低。重复献血人群HBV-DNA阳性率高于初次献血人群,这可能与低病毒载量的重复献血者经过多次NAT检测,增加了HBV-DNA检出的概率;另外,由于重复献血人群长期坚持献血,这部分献血者年龄普遍较初次献血者大,这也与表2中献血者HBV-DNA阳性检出率与年龄相关相映衬。
综上所述,ELISA筛查献血者血液标本存在一定的漏检现象,NAT检测可有效降低经输血传播乙型肝炎、丙型肝炎、艾滋病的风险,从而提高血液质量和临床输血安全。
