栀子苷干预LPS诱导RAW264.7巨噬细胞炎性反应递质的研究
2018-11-15纪雯婷尹湘君刘姝伶张海霞王雪茜
纪雯婷 尹湘君 刘姝伶 张海霞 王雪茜 魏 玮
(1 北京中医药大学,北京,100029; 2 中国中医科学院望京医院,北京,100102)
栀子是目前公认从古沿用至今的品种,在历代本草中均有详细论述。其首载于《神农本草经》,被列为中品,主治“五脏邪气”“胃中热气”[1]。《本草纲目》中详细论述了栀子的作用,后代医家更是多有发挥,总的来说,栀子具有能清热,降火、止血的功效[2-6]。现代药理学研究证明,栀子苷中含有有机酸类化合物、挥发油类,黄丽类、香豆素类及其他多种化合物及微量元素[7-9],可用于中枢神经系统疾病[10-11]、糖尿病[12-13]、心血管系统疾病、等[14-15]。此外,栀子具有强大的抗炎作用[16-17]。研究证明,栀子能抑制炎性反应分子NO以及炎性反应分子TNF-α等的作用[18]。
栀子苷,属于环烯醚萜类化合物,是栀子中的主要成分[19]。栀子强大的抗炎作用是由栀子苷单独发挥,还是栀子中的其他成分主导,其研究结果尚不明确。本实验比较栀子苷水提液、栀子苷标准品、50%栀子苷敲除液、50%栀子苷回填液对LPS刺激巨噬细胞后分泌NO与细胞因子IL-6及TNF-α的调控,试探究栀子发挥抗炎功效的主要成分。
1 材料与方法
1.1 材料
1.1.1 细胞 细胞为小鼠单核巨噬细胞白血病细胞(RAW264.7)购买于协和细胞资源中心。
1.1.2 药物 栀子购于北京同仁堂科技发展股份有限公司,栀子苷标准品(贵州迪大,a0057),栀子苷敲除液自备。
1.1.3 试剂与仪器 CO2培养箱(Thermo Fisher scientific公司),离心机(Eppendorf公司),胎牛血清(GBICO公司,10099141),DMEM培养基(GBICO公司,11995065),PBS(南京凯基公司,KGB5001),青链霉素(Hyclone公司,SV30010),脂多糖LPS(Sigma公司,L2630-100MG),TFN-αELISA试剂盒(Proteintech公司,KE10002)和IL-6ELISA试剂盒(Proteintech公司,KE10007),E-Plate板(艾森生物有限公司,00300600890),一氧化氮检测试剂盒(碧云天公司,S0021)
1.2 方法
1.2.1 干预药物的制备 栀子水提液:栀子100 g,用超纯水煎煮药物1 h,浓缩药物浓度至1 g/mL。高速离心2次,5 000 r/min,离心10 min/次,收集上清,用0.22 μm的微孔滤器过滤除菌并分装,置-20 ℃冻存备用。50%栀子苷敲除液:栀子苷免疫亲和色谱巧除法进行[20],敲除约50%的栀子苷,敲除液放入-20 ℃冻存备用。50%栀子苷回填液用栀子苷水提液会回填50%栀子苷标准品,放入-20 ℃冻存备用。
1.2.2 分组与模型制备 收集培养的巨噬细胞,调整细胞浓度为1×105个/mL,种于24孔培养板中,每孔500 μL。设立空白对照组、LPS模型组、栀子苷水提液组、栀子苷标准品组、50%栀子苷敲除液组、50%栀子苷回填组。除空白对照组外,其余各组均加入LPS建立炎性反应模型,使LPS浓度达1 μg/mL,空白组则加入等量培养基。
1.2.3 给药方法 栀子苷水提液组,栀子苷标准品组以及50%栀子苷敲除液组分别加入相应药物,经调整药物浓度,使栀子苷含量相同而50%栀子苷回填液组加入栀子苷回填液,使回填液组栀子苷含量是上述3组中栀子苷的2倍。空白对照组与模型组LPS模型组加入等量培养基,使各组终体积相同。把细胞培养板放置于37 ℃、含5%CO2、饱和湿度培养箱中培育24 h后,收取各组细胞上清,放入-20 ℃冻存备用。
1.2.4 检测指标与方法
1.2.4.1 栀子水提液、栀子苷标准品及50%栀子苷敲除液对巨噬细胞的毒性作用 按照RTCA仪器说明操作。本实验采用无标记细胞功能分析技术(Real Time Cellular Analysis,RTCA),能高效率、客观、完整的获取细胞的毒性动力学曲线。收集培养的巨噬细胞,调整细胞浓度为1×105个/mL,吹打均匀,加入16孔板,100 μL/孔,10倍稀释等比例稀释栀子水提液、栀子苷标准品及50%栀子苷敲除,按顺序加入16孔中,每个浓度药物设3复孔,把细胞培养板放置于RTCA仪之中培育72 h后,结束实验,记录干预24 h实验数据并分析。
1.2.4.2 Griess法检测各组NO含量 按照说明书法检测NO的含量。取各组细胞培养上清液50 μL加入96孔板中,每组设6个复孔,依次加入氨基苯磺酸、萘基乙二胺,室温避光孵育10 min,酶标仪540 nm波长检测,并计算出各组NO的含量(浓度)。
1.2.4.3 ELISA法检测细胞培养上清IL-6与TNF-α含量 按照试剂盒说明书推荐方法测定。根据说明书要求配制标准品液、10×标本稀释液及洗涤液。于96孔酶标板中每孔各加入标准品与待测样品100 μL,将反应板充分混匀后置37 ℃ 2 h,用洗涤液将反应板充分洗涤4~6次,向滤纸上印干;每孔加入蒸馏水和第一抗体工作液各100 μL(空白除外),将反应板充分混匀后置37 ℃ 1 h,同前洗板;每孔加酶标抗体工作液100 μL。将反应板置37 ℃ 30 min,同前洗板;每孔加入底物工作液100 μL,置37 ℃暗处反应10 min;每孔加入100 μL终止液混匀;5 min内用酶标仪检OD值,计算出各组相应IL-6与TNF-α含量。
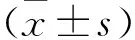
2 结果
2.1 栀子水提液、栀子苷标准品、50%栀子敲除液对巨噬细胞的毒性研究 实验可知,栀子水提液与栀子苷表标准品对巨噬细胞毒性很小,细胞培养24 h后,10 mg/mL的栀子水提液与栀子苷标准品对巨噬细胞较空白对照组差异有统计学意义(P<0.05),而浓度为150 μg/mL的50%栀子苷敲除液干预巨噬细胞24 h后即可表现出细胞毒性(P<0.05)。值得注意的是,50%的栀子苷敲除液在干预巨噬细胞的过程中,随着敲除液浓度的增大,巨噬细胞的细胞指数反而上升,具有一定的促细胞增殖作用,75 μ/mL的敲除液效果最为突出(P<10-4)。后续实验各组干预药物的浓度依据50%敲除液毒性浓度进行选择。
2.2 各组巨噬细胞炎性反应递质NO表达(Griess法)实验可知,LPS刺激巨噬细胞后NO释放增多(P<10-4),而栀子苷水提液、栀子苷标准品、栀子苷敲除液均能降低LPS刺激巨噬细胞后NO的释放,其中栀子水提液、50%栀子苷敲除液以及50%栀子苷回填液的作用最强,且作用差异有统计学意义(P<10-2)。而栀子苷标准品的作用相对较小(P<0.05)。
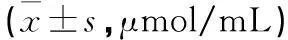
表1 实验各组细胞上清NO水平比较
注:与空白对照组比较*P<0.05,**P<10-2,***P<10-3,****P<10-4;与LPS模型组比较,△P<0.05,△△P<10-2

图1 栀子水提液对巨噬细胞的毒性研究

图2 栀子苷标准品对巨噬细胞的毒性研究
图3 50%栀子苷敲除液对巨噬细胞的毒性研究
注:图1、图2、图3中RTCA法检测栀子水提液、栀子苷表标准品以及50%栀子苷敲除液对巨噬细胞的毒性研究,与空白对照组(0 mg/mL)比较,*P<0.05,**P<10-2,***P<10-3,****P<10-4,NS:差异无统计学意义

图4 检测各组NO的表达统计结果
注:与空白组比较*P<0.05,**P<10-2,***P<10-3,****P<10-4;与LPS组比较△P<0.05,△△P<10-2
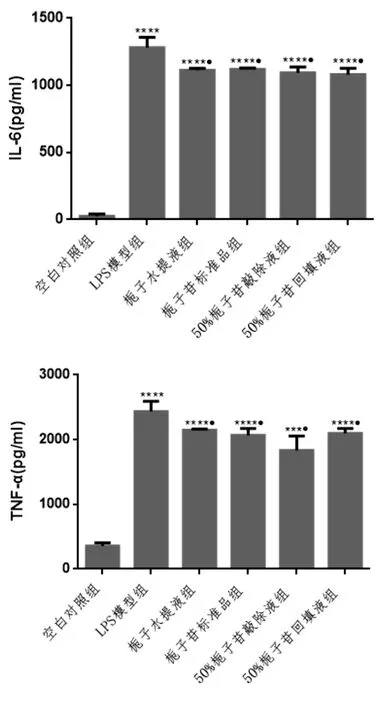
图5 检测各组IL-6与TNF-α的表达统计结果
注:与空白组比较*P<0.05,**P<10-2,***P<10-3,****P<10-4;与LPS组比较△P<0.05,△△P<10-2
2.3 各组巨噬细胞IL-6与TNF-α炎性反应因子表达(ELISA检测)实验可知LPS刺激巨噬细胞后,巨噬细胞分泌TNF-α与IL-6较空白对照组增加(P<10-4),栀子水提液干、栀子苷标准品、50%栀子苷敲除液以及含50%栀子苷的栀子水提液干预后,能降低上述细胞因子的分泌(P<0.05),但各组调控作用差异无统计学意义。
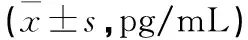
表2 实验各组细胞上清中IL-6与TNF-α水平
注:与空白对照组比较*P<0.05,**P<10-2,***P<10-3,****P<10-4;与LPS模型组比较,△P<0.05,△△P<10-2
3 讨论
经LPS刺激的巨噬细胞是成熟的炎性反应模型[21]。在炎性反应过程中,巨噬细胞作为重要的效应细胞,一方面通过抗原识别及呈递,激活免疫反应;另一方面分泌大量的炎性反应递质,导致广泛的炎性反应级联反应[22]。NO作为主要的炎性反应递质,在炎性反应的发生和发展中发挥着重要作用。实验结果可知,栀子水提液、栀子苷标准品、50%栀子苷敲除液、以及50%栀子苷回填液均对NO的分泌有抑制作用。其中,栀子苷标准品的作用较其他温和。可见,栀子中并不是单一成分栀子苷对NO的分泌起到抑制作用,栀子苷中的其他成分对NO的抑制作用可能更大。
TNF-α与IL-6均是巨噬细胞在炎性反应中分泌的非常重要的促炎因子和调节免疫因子[23]。LPS刺激巨噬细胞促进IL-12、IFN-γ、IL-6、IL-1β等细胞因子的分泌[24]。IL-6、TNF-α细胞因子的增多,无疑介导或加重机体炎性反应。当栀子水提液、栀子苷标准品、50%栀子苷敲除液、以及50%栀子苷回填液均对TNF-α与IL-6的分泌有抑制作用,且作用差异无统计学意义。可见栀子苷在栀子抗炎这一功效中发挥了作用,这种抗炎作用可能与栀子苷的含量相关。一定范围内的栀子苷能较为稳定的发挥抗炎功效。此外,栀子中的其他成分也不能排除其抗炎的效能,其很可能与栀子苷共同调节炎性反应,使炎性反应的其他症状得到改善。
综上所述,栀子具有强大的抗炎作用,这种功效不仅仅体现在其主要成分栀子苷上,栀子中的其他成分也发挥了抗炎的作用。且栀子中不同成分很可能从不同的方面调节炎性反应,成分之间可能具有相互协助或者抑制的作用,从而改善炎性反应。本次实验仅从炎性反应下游的致炎成分展开,尚需要进一步研究栀子苷与栀子在其他药效作用上的关联性,全面了解栀子苷对栀子的药效贡献。
