内毒素经不同给药途径建立新生鼠急性肺损伤模型对比分析*
2018-11-15李清香曹云涛遵义医学院附属医院新生儿科贵州遵义563003
罗 艳,李清香,曹云涛(遵义医学院附属医院新生儿科,贵州遵义563003)
新生儿急性肺损伤(ALI)是新生儿的常见疾病之一,主要由肺内外因素引起肺泡炎症水肿和毛细血管膜损伤,从而导致肺泡通气血流比例失调,其主要临床表现是缺氧、进行性呼吸困难和呼吸衰竭[1-2]。ALI的进一步加重可发展为新生儿急性呼吸窘迫综合征(ARDS)。随着人们生活水平的不断提高,越来越多的早产儿被送入重症监护室救治。因此,ALI∕ARDS的发病率和死亡率都不断提高,成为学者们的研究热点之一。
新生儿特别是早产儿,因其免疫力低下,极易被细菌感染,各类细菌均可接触气道导致局部炎症反应失调[3-4]。据统计,气道感染中以革兰阴性杆菌感染为主[5]。有学者报道,革兰阴性细菌死亡或活跃繁殖时所释放的内毒素(LPS)(其化学本质为脂多糖)可通过募集大量中性粒细胞到气道局部而引起ALI∕ARDS[6]。然而ALI∕ARDS在人活体肺中的发生、发展过程大部分来自于尸体解剖,在一定程度上限制了人们对ALI∕ARDS肺部病理变化的认识[7]。因此,动物模型对ALI∕ARDS发病机制、有效治疗药物研究具有重要意义。
目前,已报道的LPS诱导ALI∕ARDS动物模型主要针对成人ALI∕ARDS,LPS的给药途径主要有气管给药、腹腔给药、尾静脉给药。而ALI∕ARDS新生鼠ALI∕ARDS动物模型LPS的给药途径主要是腹腔给药。鉴于临床引起新生儿肺部感染性损伤的细菌传播方式可能为空气或血源性传播,是制备最理性的ALI∕ARDS动物模型。本文通过比较LPS鼻腔滴药、气管给药、腹腔给药3种不同给药途径所制备动物模型的区别,为更好地研究ALI∕ARDS发病机制奠定基础。
1 材料与方法
1.1 材料 清洁级SD大鼠,成年雌性6只,雄性3只,均购自重庆医科大学实验动物中心,饲养于独立、清洁的通气饲养盒内,饲料、水均经严格消毒,所有操作于超净台内完成。实验过程中,动物的使用严格遵循遵义医学院动物伦理委员会要求。
1.2 方法
1.2.1 分组方法 将新生2~3 d SD大鼠分为3组:(1)鼻腔滴药组(对照组和LPS组),LPS组采用左手大拇指和食指固定新生鼠头,鼻腔中滴入不同剂量LPS(3、4、5、6、8 mg∕kg),然后分别于 1、6、12、24、72 h 处死新生鼠(n≥5);对照组鼻腔滴入等量生理盐水,同样于1、6、12、24、72 h 处死新生鼠(n≥5)。(2)气管给药组(对照组和LPS组):将新生鼠取仰卧位固定于操作台上,正中切开颈前皮肤,钝性分离皮下组织,暴露气管。用小儿静脉留置针植入暴露的气管后,拔出针芯,LPS组给予气管内滴入LPS(LPS量、处死时间同鼻腔滴药组)(n≥5);其对照组给予气管内滴入等量生理盐水。(3)腹腔给药组(对照组和LPS组):LPS组给予腹腔注入LPS(LPS量、处死时间同鼻腔滴药组)(n≥5);其对照组给予气管内滴入等量生理盐水。观察不同组新生鼠给予LPS后的食欲、活动情况及死亡率。依据第一步实验结果,将 LPS 剂量选定为 3、4、5 mg∕kg。
1.2.2 组织学检查 各组于各时间点用10%水合氯醛麻醉新生SD大鼠,打开胸前后,首先肉眼观察肺组织的大体病理改变,然后取右肺常规固定、包埋、脱水、切片后苏木精-伊红(HE)染色。肺部病理评分主要依据参考文献[8]对肺组织细支气管周围炎症、血管周围炎症、肺泡周围炎症进行病理评分。
1.2.3 肺组织湿重∕干重(W∕D)比值的测定 处死新生鼠后快速打开胸腔游离双肺(n=8),首先用无菌纱布蘸干双肺表面的血水,取左肺称其湿重(W),然后将其放入57℃烤箱内将湿肺烘干(烘烤时间为24 h),再称其干重(D);最后计算左肺的W∕D值。以此来反映肺水肿程度。
1.2.4 支气管肺泡灌洗 大鼠取仰卧位麻醉,处死新生鼠(n=8),并暴露气管后用小儿静脉留置针进行气管插管,用冷磷酸盐缓冲溶液(PBS)反复灌洗3次,每次0.3 mL,最终收集PBS共0.5 mL,灌洗液细胞计数后离心,取上清液-80℃保存,对细胞因子水平进行检测,细胞沉渣瑞氏染色进行分类计数。
1.3 统计学处理 采用Graphpad Prism5.03统计软件进行数据分析,计量资料以表示,两样本间比较采用t检验;多样本间比较采用One-Way ANOVA分析。P<0.05为差异有统计学意义。
2 结 果
2.1 不同时间点、不同剂量、不同途径给药后新生鼠的死亡率 给予新生儿鼠LPS后,出现吃奶反应差及活动量明显减少,剂量越大症状越明显,死亡率越高。当LPS剂量小于5 mg∕dL时新生鼠死亡率可降低至25%以下。见表1。
2.2 不同时间点不同给药途径肺组织的病理改变 当LPS剂量为3 mg∕dL时,鼻腔滴药组、气管给药组、腹腔给药组各个时间点的炎症病理评分在支气管细支气管周围、血管周围、肺间质与对照组比较,差异均无统计学意义(P>0.05);当 LPS 剂量为 4 mg∕dL 或 5 mg∕dL,滴入LPS后1、24、72 h,支气管细支气管周围炎症、血管周围炎症、肺间质炎症病理评分与对照组比较,差异无统计学意义(P>0.05);但时间点为 6、12 h各组病理评分均高于对照组,差异均有统计学意义(P<0.05)。见图1~6。

表1 不同时间点、不同剂量、不同途径给药后新生鼠的死亡率比较(n=8)
2.3 不同时间点不同给药途径肺组织水肿参数检测 LPS经鼻腔途径或腹腔注射途径进入新生鼠肺部6~12 h后,发现剂量为 3 mg∕kg 或 4 mg∕kg时,肺部水肿明显且肺脏无明显出血点,当剂量增加至5 mg∕kg时,肺部除水肿外,还可见大量出血点及胸腔积液。当LPS(3 mg∕kg或 4 mg∕kg)经气管途径进入肺部 6~12 h,可见肺部水肿明显且肺脏有少许出血点。
三组各个时间点的W∕D值均高于对照组,差异均有统计学意义(P<0.05),其中时间点为 6、12 h 时 W∕D值均达高峰,时间点为24、72 h时W∕D值均呈下降趋势。见表2。
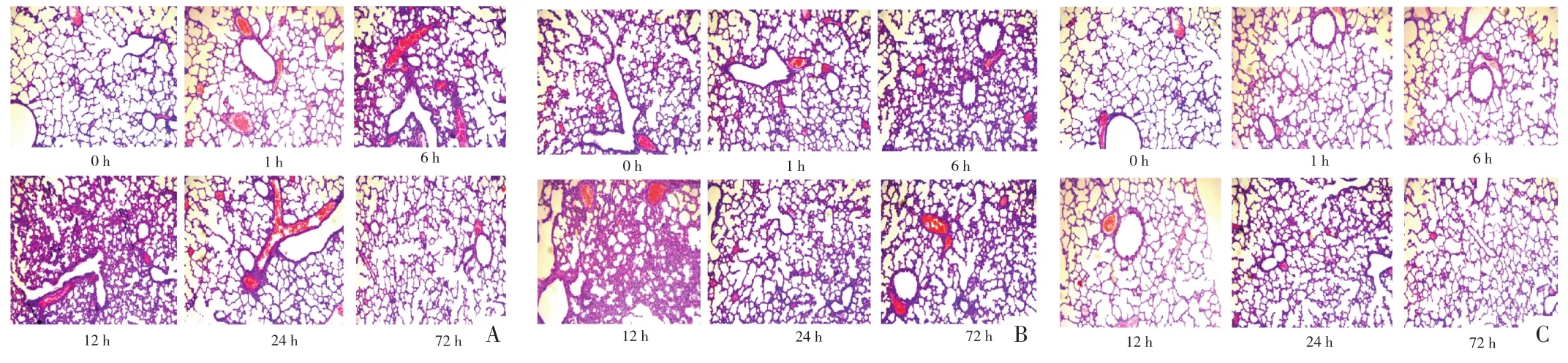
图1 鼻腔滴药组不同剂量LPS、不同时间点肺组织的病理情况(HE,200×)
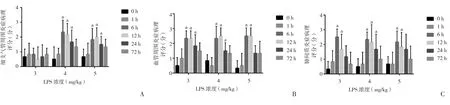
图2 鼻腔滴药组不同剂量LPS、不同时间点细支气管周围炎症、血管周围炎症、肺间质炎症病理评分
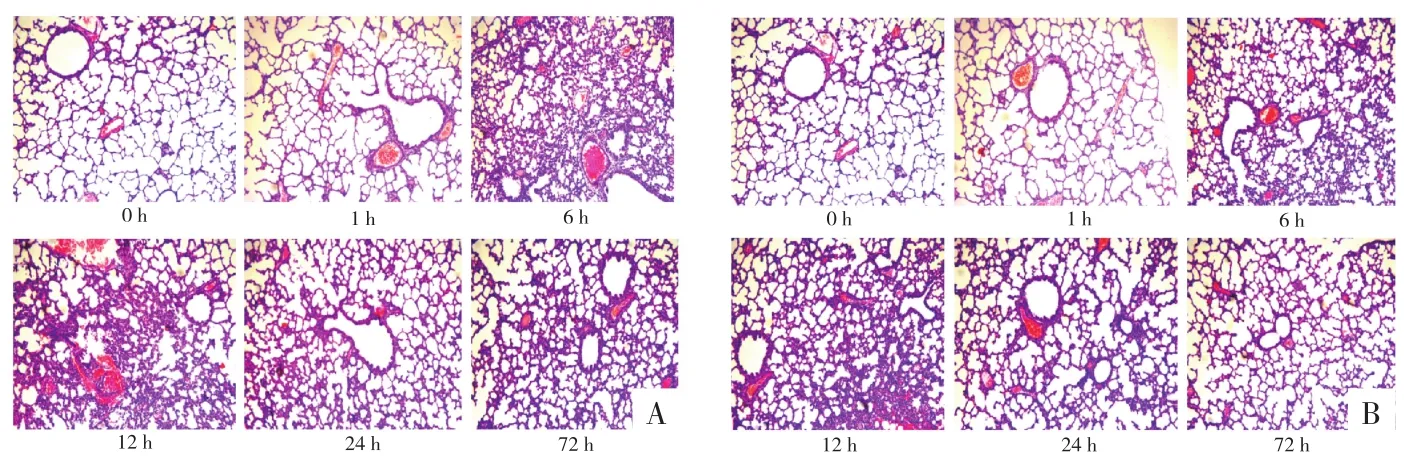
图3 气管给药组不同剂量LPS、不同时间点肺组织的病理情况(HE,200×)

图4 气管给药组不同剂量LPS、不同时间点细支气管周围炎症、血管周围炎症、肺间质炎症病理评分
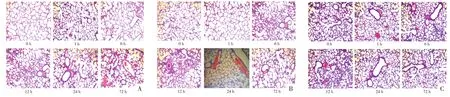
图5 腹腔给药组不同剂量LPS、不同时间点肺组织的病理情况(HE200×)

图6 腹腔给药组不同剂量LPS、不同时间点细支气管周围炎症、血管周围炎症、肺间质炎症病理评分
表2 不同时间点、不同剂量、不同途径给药后各组新生鼠左肺W∕D比值比较(n=5,±s)
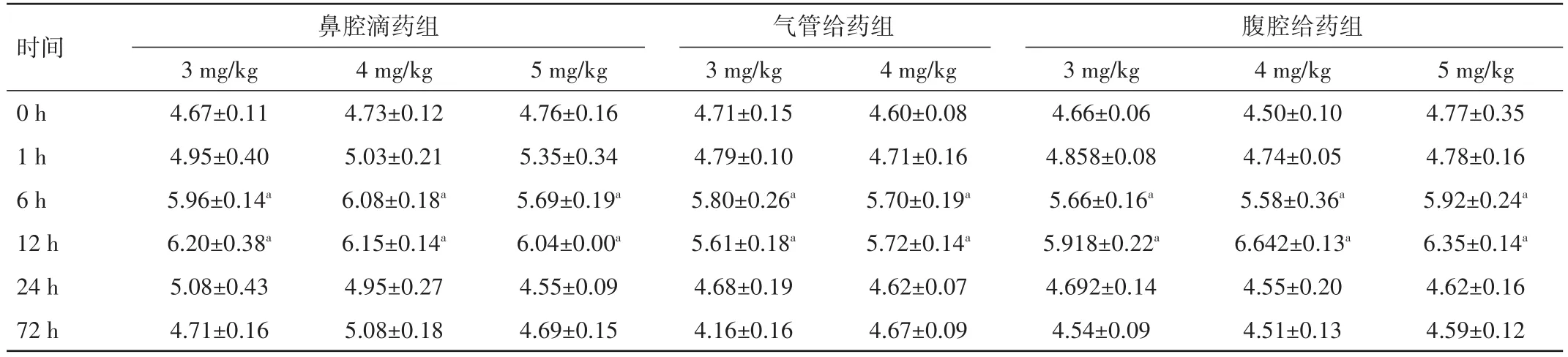
表2 不同时间点、不同剂量、不同途径给药后各组新生鼠左肺W∕D比值比较(n=5,±s)
注:与对照组比较,aP<0.05
时间 鼻腔滴药组腹腔给药组0 h 1 h 6 h 12 h 24 h 72 h 3 mg∕kg 4.67±0.11 4.95±0.40 5.96±0.14a 6.20±0.38a 5.08±0.43 4.71±0.16 4 mg∕kg 4.73±0.12 5.03±0.21 6.08±0.18a 6.15±0.14a 4.95±0.27 5.08±0.18 5 mg∕kg 4.76±0.16 5.35±0.34 5.69±0.19a 6.04±0.00a 4.55±0.09 4.69±0.15气管给药组3 mg∕kg 4.71±0.15 4.79±0.10 5.80±0.26a 5.61±0.18a 4.68±0.19 4.16±0.16 4 mg∕kg 4.60±0.08 4.71±0.16 5.70±0.19a 5.72±0.14a 4.62±0.07 4.67±0.09 3 mg∕kg 4.66±0.06 4.858±0.08 5.66±0.16a 5.918±0.22a 4.692±0.14 4.54±0.09 4 mg∕kg 4.50±0.10 4.74±0.05 5.58±0.36a 6.642±0.13a 4.55±0.20 4.51±0.13 5 mg∕kg 4.77±0.35 4.78±0.16 5.92±0.24a 6.35±0.14a 4.62±0.16 4.59±0.12
表3 BALF中不同剂量LPS、不同时间点PMN总数比较(±s,%)
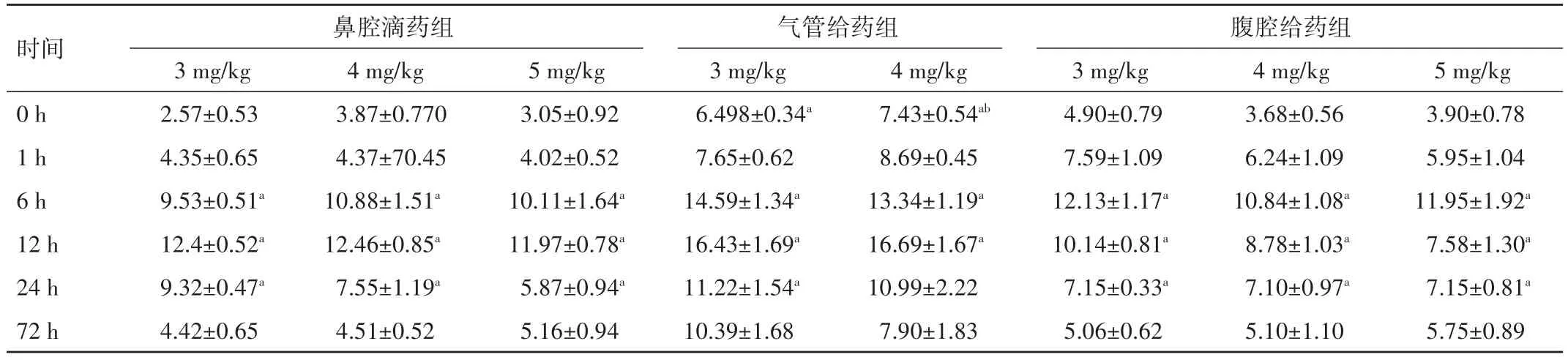
表3 BALF中不同剂量LPS、不同时间点PMN总数比较(±s,%)
注:与对照组比较,aP<0.05;与鼻腔滴药组比较,bP<0.05
时间0 h 1 h 6 h 12 h 24 h 72 h鼻腔滴药组腹腔给药组3 mg∕kg 2.57±0.53 4.35±0.65 9.53±0.51a 12.4±0.52a 9.32±0.47a 4.42±0.65 4 mg∕kg 3.87±0.770 4.37±70.45 10.88±1.51a 12.46±0.85a 7.55±1.19a 4.51±0.52 5 mg∕kg 3.05±0.92 4.02±0.52 10.11±1.64a 11.97±0.78a 5.87±0.94a 5.16±0.94气管给药组3 mg∕kg 6.498±0.34a 7.65±0.62 14.59±1.34a 16.43±1.69a 11.22±1.54a 10.39±1.68 4 mg∕kg 7.43±0.54ab 8.69±0.45 13.34±1.19a 16.69±1.67a 10.99±2.22 7.90±1.833 mg∕kg 4.90±0.79 7.59±1.09 12.13±1.17a 10.14±0.81a 7.15±0.33a 5.06±0.62 4 mg∕kg 3.68±0.56 6.24±1.09 10.84±1.08a 8.78±1.03a 7.10±0.97a 5.10±1.10 5 mg∕kg 3.90±0.78 5.95±1.04 11.95±1.92a 7.58±1.30a 7.15±0.81a 5.75±0.89
2.4 肺泡灌洗液(BALF)中多形核白细胞(PMN)计数 三组时间点为6、12 h时,BALF中PMN值均显著高于对照组,24 h时PMN仍高于对照组,但较12 h时BALF中PMN值降低,差异均有统计学意义(P<0.05),但1、72 h时BALF中PMN值与对照组比较,差异无统计学意义(P>0.05)。不同给药途径的对照组中PMN比较,气管滴入组中PMN值显著增加,差异有统计学意义(P<0.05)。见表3。
3 讨 论
ALI是一种常见于重症监护室里的危重疾病。据统计,该病的死亡率约为 50%~60%[9]。然而,ALI∕ARDS 的发病机制十分复杂,至今仍不清楚。目前,机械通气是治疗ALI∕ARDS的基础方式,但由此导致的呼吸机相关性肺炎是增加患儿死亡的原因之一,其病原菌以革兰阴性杆菌为主[3]。有研究表明,革兰阴性菌(如肺炎克雷伯、大肠埃希菌)是新生儿肺部感染的主要致病菌[5]。目前,针对ALI∕ARDS发病机制的研究资料主要来源于动物模型,其中报道的ALI∕ARDS动物模型中成年鼠与新生鼠的给药途径不同。众所周知,抗原进入机体因其途径、剂量或频次的不同可使机体产生不同强度的免疫应答,且过高、过低的抗原剂量可诱导免疫耐受,只有适中的剂量方可诱导机体产生免疫应答。
本研究比较了LPS剂量3~8 mg∕kg不同给药途径新生鼠的死亡率,经统计发现,当给药途径为鼻腔滴药和腹腔给药时LPS剂量为3~5 mg∕kg时,新生鼠的死亡率可控制在25%以下;但给药途径为气管给药时,如果将死亡率控制在25%以下,LPS剂量范围应为3~4 mg∕kg。因此,本研究选择了 LPS 剂量为 3、4、5 mg∕kg,给药途径为鼻腔滴药、腹腔给药建立肺损伤模型;而气管给药途径的肺损伤模型的LPS剂量为3、4 mg∕kg,进而对比选择最佳肺损伤模型。
本研究结果显示,LPS经鼻腔途径或腹腔注射途径进入新生鼠肺部时,肺部炎症结果相似,均随着LPS剂量的增加而加重。LPS(3 mg∕kg 或 4 mg∕kg)进入体内 6~12 h,肺部体积增大、炎症明显,且肺脏无明显出血点,24 h后炎症呈减轻趋势。当剂量增加至5 mg∕kg时,肺部除体积增大及炎症细胞浸润外,还可见大量出血点及胸腔积液,提示该剂量可导致肺出血,从而并不适合制备该模型。这与施展等[10]的研究结果相似。当LPS经气管途径注入新生鼠体内时,肺部体积、炎症程度也随剂量的增加而加重,且肺脏表面可见少许出血点,24 h后炎症较LPS注入前减轻。肺W∕D值可反映新生鼠予LPS后肺部水肿情况,该实验发现LPS组在6~12 h W∕D值增加,但24 h后W∕D值与对照组比较无显著差异,提示新生鼠给予LPS 24 h内可能引起肺部血管通透性增加,导致肺损伤。
导致ALI最常见的因素是革兰阴性菌败血症。SOOD等[11]将大肠埃希菌内毒素注入新生猪体内成功诱导肺部中性粒细胞聚集,产生肺损伤。本研究结果显示,气管给药模型新生鼠肺部有大量PMN浸润,鼻腔滴药次之,腹腔给药时,模型组肺内PMN数量明显较前二者少。这与李红霞等[12]的研究结果相似。但值得注意的是,本实验发现气管给药途径的对照组中PMN值较另外两组中的对照组中PMN值得显著增高,这可能与气管给药途径需切开颈前皮肤暴露气管后将药经注射器注入肺内,属于有创操作相关。
综上所述,以上3种途径均可成功诱导新生大鼠ALI∕ARDS动物模型。但气管给药途径属于有创操作,该操作本身可能导致PMN在肺部聚集,从而影响结果的准确性。而腹腔注射虽可诱导肺部损伤,但腹腔注射LPS也可成功诱导脓毒血症导致肾损伤,这使建立的模型可能同时存在肺、肾等脏器损伤,而影响实验结果[13]。鼻腔滴药可以成功制备肺损伤模型,且其感染途径接近临床新生儿呼吸道感染途径类型,故根据本实验结果推荐该途径为首选制备ALI∕ARDS动物模型。
