纳豆菌的分离、筛选、鉴定及发酵特性对比研究
2018-11-15王欢李宏梁杜磊尉璐杰
王欢,李宏梁,杜磊,尉璐杰
(陕西科技大学 食品与生物工程学院,西安 710021)
纳豆是大豆经接种纳豆芽孢杆菌发酵而成的具有特殊气味的豆制品,除富含多种人体易吸收的营养成分之外,同时还含有多种生理活性物质[1],因此享有“超级健康食品”的美称。研究证实,经常食用纳豆可以增强身体机能,起到良好的保健作用[2]。纳豆芽孢杆菌抗逆性极强,具有耐高温和耐酸的特性,可在微酸环境中生存长达4 h[3],有研究表明,食用纳豆之后,纳豆菌在肠道内萌发增殖,分泌各种酶及维生素,进而促进肠道有益菌的增殖,对维持并调节肠道微生态的平衡起着重要作用[4]。大量文献证明,纳豆菌的代谢产物纳豆激酶具有多种功能[5-8],其中,溶栓及抑制血栓形成效果较为突出[9,10]。
目前对纳豆的研究开发主要集中于纳豆成分分析,纳豆及保健品制作,纳豆激酶等功能成分提取,而对于不同产地的纳豆菌发酵性能对比研究报道比较少,因此,本研究拟从北京燕京、日本顺食真、大连美屋的鲜纳豆产品中分离筛选出多株蛋白酶活性较高的纳豆菌,利用其发酵黄豆,对发酵特性进行对比,以期得到1株蛋白酶活性高且发酵性能较好的生产用菌株。
1 材料与方法
1.1 实验材料
燕京纳豆:北京燕京中发生物技术有限公司;顺食真纳豆:北海道小樽市钱函株式会社;御城纳豆:大连美屋食品有限公司;枯草芽孢杆菌:实验室保存;黄豆:山西绿色山区农副产品销售有限公司。
1.2 仪器与设备
LDZX-40II型立式自动电热压力蒸汽灭菌器 上海申安医疗器械厂;THZ-C-1 全温振荡器 上海中庸检验设备有限公司;BSC-1300II超净工作台、SPX-250B-Z生化培养箱 上海博迅实业有限公司医疗设备厂;BK5000生物显微镜 重庆奥特光学仪器有限公司;722N可见分光光度计 上海精密科学仪器有限公司。
1.3 培养基
1.3.1 液体种子培养基
蛋白胨1%,酵母粉0.5%,NaCl 1%,琼脂1.5%,pH 7.0~7.2,121 ℃灭菌15 min。
1.3.2 脱脂牛奶培养基
A脱脂奶粉4% 115 ℃灭菌15 min;B 琼脂粉4%,121 ℃灭菌15 min;冷却后混匀倒平板。
1.3.3 明胶培养基
蛋白胨0.5%,明胶12%,pH 7.2~7.4,115 ℃灭菌20 min。
1.3.4 甲基红培养基
蛋白胨0.5%,葡萄糖0.5%,NaCl 0.5%,pH 7.0~7.2,115 ℃灭菌30 min。
1.3.5 淀粉水解培养基
A 肉汁胨:蛋白胨1%,牛肉膏0.3%,pH 7.1~7.6;B 肉汁胨中加0.2%的可溶性淀粉,121 ℃灭菌20 min。
1.3.6 LB琼脂培养基
胰蛋白胨1%,酵母提取物0.5%,氯化钠1%,琼脂粉1.5%,pH 7.2~7.4,121 ℃灭菌15 min。
1.4 实验方法
1.4.1 菌种分离
采用平板稀释法进行分离。取3种市售鲜纳豆各25 g,分别置于225 mL灭菌生理盐水中,制得10-1稀释度的菌悬液,于120 r/min震荡30 min,80 ℃水浴30 min(目的是杀死杂菌及纳豆菌营养体),然后迅速冷却至室温制得芽孢悬液。将芽孢悬液进行梯度稀释,直至稀释到10-9,取10-7,10-8,10-9稀释度的样品匀液100 μL涂布于LB琼脂培养基上于37 ℃倒置培养24 h,进行分离培养。
1.4.2 菌株筛选
对于从LB琼脂培养基上分离出的单菌落进行菌落形态观察,对符合目标的疑似菌株进行脱脂牛奶平板筛选。
具体筛选过程如下:用灭菌牙签蘸取少许待测菌株,点植于脱脂牛奶培养基上,于37 ℃恒温培养箱中倒置培养18 h,测定透明圈及菌落直径。
在各产地纳豆产品中,分别选取水解圈大的菌落作为后续实验菌株,在脱脂牛奶培养基上连续划线分离至纯,斜面保藏备用。
1.4.3 生理生化鉴定
对筛选出的菌株分别进行革兰氏镜检、甲基红、淀粉水解、明胶液化、柠檬酸盐利用试验,试验参照《常用细菌系统鉴定手册》进行。
甲基红试验:有的细菌在糖代谢过程中,分解葡萄糖产生丙酮酸,丙酮酸可进一步分解,产生甲酸、乙酸、乳酸等,使培养基pH下降至4.5以下,加入甲基红试剂则呈红色。
淀粉水解试验:有的细菌具有合成淀粉酶的能力,可以分泌胞外淀粉酶,淀粉酶可以使淀粉水解,则淀粉培养基遇碘不再变蓝。
明胶液化试验:有的细菌代谢可产生明胶酶,使半固体的明胶培养基失去凝固力而成为流动的液体。
柠檬酸盐利用试验:柠檬酸盐培养基中,柠檬酸钠为唯一碳源,磷酸二氢铵为唯一氮源,某些细菌能利用柠檬酸钠为碳源,分解产生碳酸盐,使培养基呈碱性,则加入0.04%酚红指示液后呈桃红色。
1.4.4 纳豆菌生长曲线的测定
将分离菌株在斜面培养基上活化24 h,用接种环挑取1环接种至液体种子培养基(装液量50 mL/250 mL)中,于37 ℃,200 r/min摇床培养,每隔2 h或4 h取样,按照浓度适当稀释后测定OD600值。以培养时间为横坐标,OD600值为纵坐标,绘制纳豆菌的生长曲线,并确定最适种龄。
1.4.4.1 纳豆制作过程
取色泽金黄的大豆200 g,按照1∶3(W/V)的比例加入水浸泡过夜,沥干水分后于高压灭菌锅中121 ℃下蒸煮30 min,待温度降至50 ℃时按照6%的接种量进行接种,于37 ℃条件下发酵24 h后,置于4 ℃冰箱中后熟24 h即可得到纳豆成品。
1.4.4.2 纳豆发酵特性评定
对发酵纳豆的感官指标、拉丝长度、粘液产率、纳豆活菌数等指标进行评价。
在本实验室选择16名学生(8男8女)组成感官评价小组,分别从纳豆的颜色、气味、口感3个方面进行打分。随机对样品进行数字编码,排列样品顺序,满分10分,感官评分标准见表1。

表1 纳豆感官评分标准Table 1 Sensory evaluation standard of natto
拉丝长度的测定:将后熟的纳豆均匀搅拌后,用镊子将2颗纳豆夹起,向两侧拉伸,记下丝断时的长度即为拉丝长度,每个样品做3次平行试验,求平均值。
粘液产率的测定:准确称取5.000 g的纳豆,一式两份,一份直接在70 ℃烘箱中烘至恒重W1,另一份用蒸馏水洗去纳豆表面的粘液,移入烘箱至恒重W2,粘液产率即为(W1-W2)/W1。
纳豆活菌数的测定:采用平板计数法,参照GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》进行。
2 结果与讨论
2.1 菌株分离结果
样品稀释液经80 ℃,30 min高温处理后,涂布于LB琼脂培养基,于37 ℃培养24 h后结果见图1。
图1 纳豆菌分离结果图Fig.1 The result of natto isolation
由图1可知,在平皿上总共分离出17株菌,并且多以单菌落分布,说明稀释度比较合适。17株菌菌落直径较大,呈圆形,且表面粗糙不透明,污白色或微黄色,中心有少量粘液,均符合纳豆菌的菌落形态。对17株菌编号为A1~A6,B1~B6,C1~C5。
2.2 菌株筛选结果
主要利用了纳豆菌产蛋白酶的特性,将分离得到的17株菌用牙签点种于脱脂牛奶培养基上,每个平板点4次,37 ℃培养18 h,测定菌落及透明圈直径,透明圈直径-菌落直径表示水解圈大小,其值越大,表示产蛋白酶能力越强。
分离出的17株菌在脱脂牛奶培养基上均产生了透明圈,说明均具有产蛋白酶的能力,其中从产地A中分离的6株菌中,A1产酶能力最强,从产地B中分离出的6株菌中,B2产酶能力最强,从产地C中分离出的5株菌中,C2产酶能力最强,具体结果见图2。
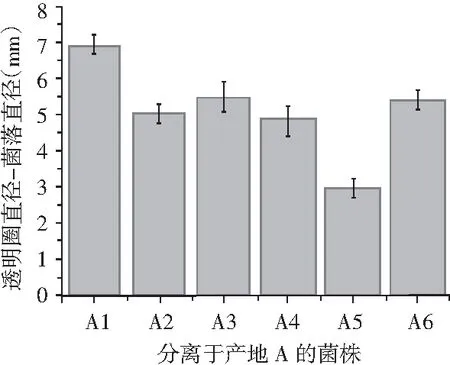
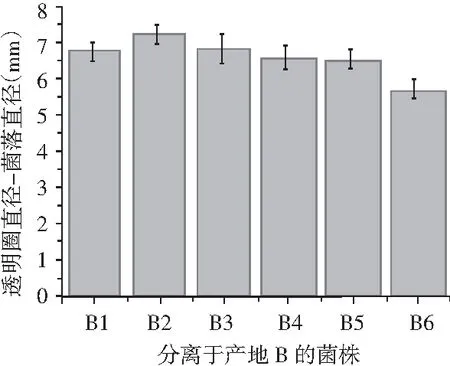
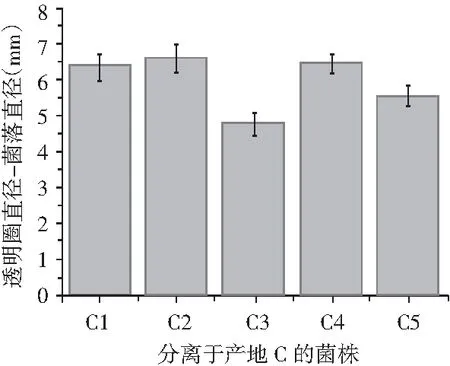
图2 17株菌相对蛋白酶活性Fig.2 Relative protease activities of 17 strains
2.3 生理生化鉴定结果
对筛选出的3株高产蛋白酶的纳豆疑似菌进行了6项生理生化试验,即革兰氏染色镜检、甲基红、淀粉水解、明胶水解、柠檬酸盐利用试验,鉴定过程中以枯草芽孢杆菌做对照,结果见表2和图3。
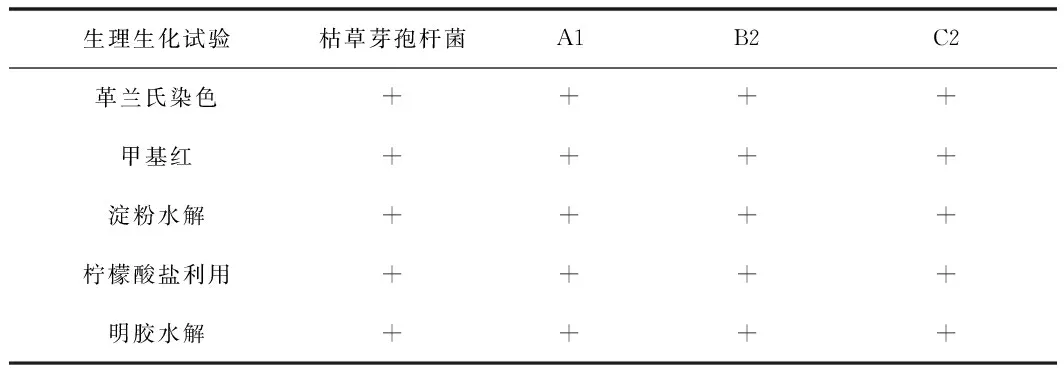
表2 菌株A1,B2,C2生理生化鉴定结果表Table 2 The physiological and biochemical identification results of strain A1, B2 and C2


图3 菌株A1,B2,C2生理生化鉴定结果图Fig.3 The physiological and biochemical identification results of strain A1, B2 and C2
由表2和图3可知,筛选出的菌株A1,B2,C2其理化性质为:革兰氏染色、甲基红试验、淀粉水解试验、明胶液化试验、耐盐生长试验和对照组枯草芽孢杆菌一样呈阳性结果,由此判断这3株菌均为纳豆菌。
2.4 发酵特性对比结果
2.4.1 3株菌的生长曲线
对纳豆菌A1,B2,C2进行了生长曲线测定,其结果见图4。
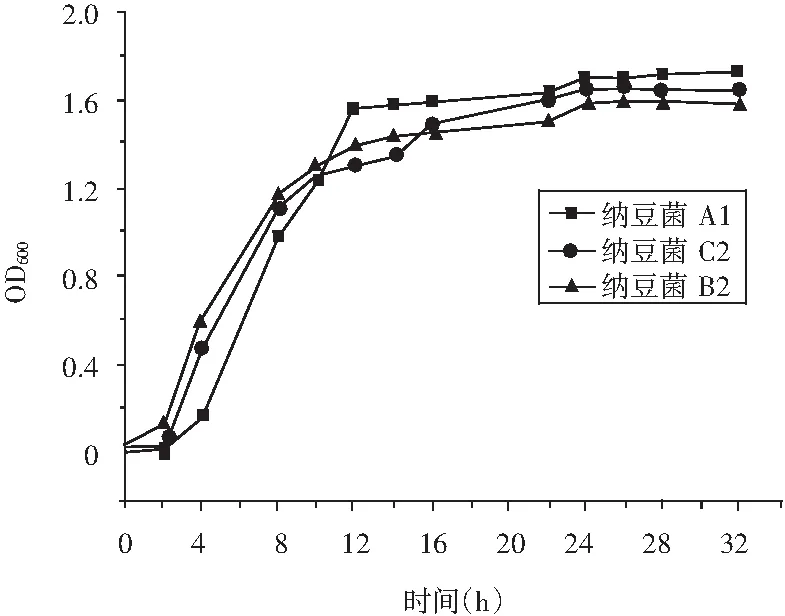
图4 纳豆菌A1,B2,C2的生长曲线Fig.4 The growth curves of Bacillus natto A1, B2 and C2
由图4可知,3株菌在液体种子培养基中的生长状况大体一致,在0~2 h时,菌体浓度增长缓慢,处于环境适应期;2~14 h时,培养基内营养物质丰富,菌体大量繁殖,菌体浓度呈指数上升状态;14 h之后,菌体浓度变化不大,纳豆菌处于生长稳定区。在衰退期内,活菌数量会有所减少,但从图4中未能明显看出衰退期开始时间,这是由于菌悬液的浓度与光密度成正比,利用分光光度计测定菌悬液的光密度来反映菌液浓度时,测定的是培养液中的总菌数,包含了活菌与死菌,反映在图4中则OD600值基本不变。因此,综合比较,3株菌均选用种龄为14 h的纳豆芽孢杆菌进行后续发酵试验。
2.4.2 3种纳豆的指标评价结果
2.4.2.1 感官评价对比
对源于不同产地的纳豆菌进行发酵试验,对成品纳豆进行了感官评定。其中纳豆菌A1,C2发酵的产品均颜色黄亮,具有纳豆特有的酱香味,口感软硬适中,并且粘液较多,A1的感官平均得分为7分,C2的感官平均得分达8分。纳豆菌B2发酵的产品颜色呈褐色,粘液较少,氨臭味较重,平均感官评分仅为4分。
2.4.2.2 3种纳豆的粘液产率、拉丝情况对比
3种纳豆的拉丝情况及粘液产率见表3。
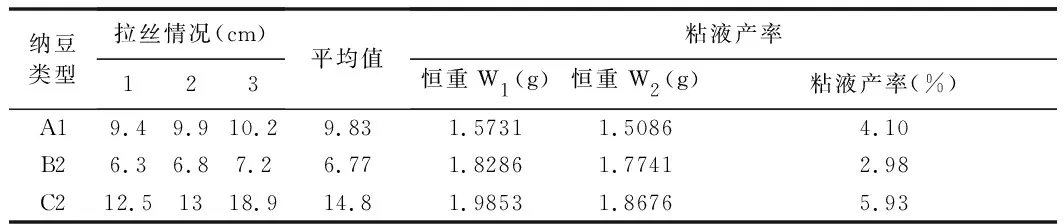
表3 3种纳豆的拉丝情况及粘液产率Table 3 The wire drawing condition and mucus yields of three types of natto
由表3可知,3种纳豆的拉丝长度存在差别:其中C2菌发酵的纳豆拉丝长度最好,为14.8 cm;其次为A1菌发酵的纳豆,拉丝长度为9.83 cm,B2相对较短,拉丝长度仅为6.77 cm。粘液产率印证了拉丝长度,粘液产率值越高,则拉丝情况越好。
2.4.2.3 纳豆活菌数分析
本实验对接种前的种子液及发酵好的成品纳豆分别进行了活菌数测定。其中纳豆菌A1种子液中活菌数为1.1×109cfu/mL,发酵的成品纳豆中活菌数为2.21×109cfu/g,活菌数增长了32.48倍。纳豆菌B2种子液中活菌数为2.4×109cfu/mL,发酵的成品纳豆中活菌数为4.14×109cfu/g,活菌数仅增长了27.75倍,纳豆菌C2种子液中活菌数为5.4×108cfu/mL,发酵的成品纳豆中活菌数为3.78×109cfu/g,活菌数增长达115.67倍。尽管这3株纳豆菌在液体种子培养液中增殖状况大致相同,但从以上数据来看,当以大豆作为培养基质时,生长状况还是存在较大差异。
菌株B2发酵的纳豆中虽然活菌数最高,但从增长倍数分析来看,纳豆菌B2的增殖能力明显弱于其他2株菌,纳豆菌C2的增殖能力最强,A1次之。而纳豆表面的粘液物质是纳豆菌在生长增殖过程中的代谢产物,这也可能是C2纳豆粘液产率及拉丝长度高于其他2株菌发酵物的原因。
3 结论
本研究根据待分离菌株的耐热性以及水解酪蛋白的特点,从北京燕京、日本顺食真、大连美屋纳豆中各分离、筛选出1株纤溶活性较高的菌株A1,B2,C2后,以枯草芽孢杆菌为对照,对这3株菌进行了生理生化验证试验,结果判定A1,B2,C2均为纳豆菌。其中,纳豆菌C2在发酵纳豆过程中,活菌数增殖最快,粘液产率为5.93%,拉丝长度最长且感官评价较高;纳豆菌B2在发酵过程中活菌数增殖最慢,尽管发酵的纳豆中活菌数最高,但粘液产率及拉丝长度均不理想,发酵的产品颜色呈红褐色,整体评价偏低,纳豆菌A1在发酵过程中,活菌数增加了32.48倍,粘液产率为4.10%。因此,分离的纳豆菌C2有待于进一步开发利用。
