多刺绿绒蒿的组织培养※
2018-11-15陈序昉刘聚源冯虎元兰州大学生命科学学院甘肃兰州730000
●陈序昉 刘聚源 冯虎元(兰州大学生命科学学院 甘肃 兰州 730000)
●蒋跃明(中国科学院华南植物园植物资源保护与可持续利用重点实验室 广东 广州 510650)
多刺绿绒蒿(Meconopsis horridula Hook.f.& Thomas.)属于罂粟科绿绒蒿属植物,主要分布于喜马拉雅山脉一带[1]。该植物花型美丽,具有重要的观赏价值,同时还具有一定的药用价值,如对心肌缺血性炎症具有防治效果[2];同时在抗肿瘤、抗病毒方面也具有较好效果[3]。在作为传统药物方面,根据《晶珠本草》所记载,多刺绿绒蒿具有广泛的功效,其中包括对骨折以及各类颅内损伤恢复具有治疗效果。
多刺绿绒蒿生长需要特殊环境,面临引种困难,部分样地植株分布甚至呈现破片化与板块化的局面,野外种群也因人为活动干扰 (包括西部旅游业的开发以及野外药物的采集)而使其种群正常生存受到威胁[4]。随着现代生物技术的发展,组织培养已成为繁育植物的有效途径[5]。考虑到多刺绿绒蒿具有一定的经济价值,同时结合野外保护需要以及可以作为我国东南沿海园艺观赏需求,有必要对该植物进行组织培养研究,实现大规模繁育,进而引种栽培。
1 材料与方法
1.1 材料
本研究以多刺绿绒蒿作为研究对象,分别采集夏玛林场以及西宁大通县祁连山保护区的多刺绿绒蒿幼株与成株作为外植体;选取生长活跃的幼嫩叶片等多个部位作为诱导愈伤组织的实验材料。实验中所用的NAA、6-BA以及各种实验试剂均购于上海伯奥公司,实验用水为超纯水。
1.2 方法
1.2.1 消毒 外植体于清水中洗净后[6],用酒精棉球对外植体进行擦拭,用少量洗洁精去除幼株表皮毛,然后用0.1%的升汞溶液灭菌3~5分钟;倒去升汞溶液后,用无菌水冲洗叶片3~4次,每次1分钟。在无菌环境下对外植体进行切割,分别将叶片切割成0.5 cm方形小块,叶柄切成1 cm长小块、子房沿底茎纵切后切成0.5~1.0 cm的小块,生长点切成直径0.5 cm的半圆小块后进行接种;花药则直接接种于培养基上。
1.2.2 培养基与培养条件 外植体愈伤组织诱导培养基以MS作为基础培养基,外源激素控制为0.1 mg/L NAA分别与 1mg/L、3mg/L、5 mg/L 6-BA配合使用[7],另添加30 g/L的蔗糖和8.6 g/L的琼脂,调整pH 5.8~6.0。培养条件:温度为 20±2℃、光照强度为 1 000~1 200 lux、50~120 lux和完全避光 3 种[8],24小时光照。每瓶接种4块外植体。
1.2.3 外植体继代培养 选择愈伤组织萌出前期(接种后第10天)和不再出现愈伤组织时期(接种后第25天),在此期间每5天进行一次继代培养。将愈伤组织切割成0.5 cm方形小块后,切除珠被内所有部分,仅保留子房外壁,接入MS培养基进行继代培养。
1.2.4 数据统计分析 每个培养瓶中接种3~4块,每组7瓶,进行4次重复实验。在其余相同条件下组中,每瓶接种3~4块,每组3瓶,共进行4次重复实验。愈伤组织诱导率和褐化率的计算公式如下:
愈伤组织诱导率(%)=(形成愈伤组织的外植体数/接种的外植体总数)×100
愈伤组织褐化率(%)=(发生褐化的外植体数/接种的外植体总数)×100
继代愈伤组织萌发率(%)=(愈伤组织继续膨大/接种的愈伤组织总数)×100
继代愈伤组织褐化率(%)=(愈伤组织褐化萎缩/接种的愈伤组织总数)×100
所获得数据采用Excel与Statistics 20软件进行分析。
2 结果与分析
2.1 不同条件对外植体诱导愈伤组织影响
2.1.1 不同部位保存时间以及外植体不同发育时期对愈伤组织诱导的影响。 如图1和表1结果所示,在相同激素条件下,对在4℃下分别保存3天、6天、9天、12天、15天、18天和21天的外植体进行观察,当外植体在4℃下保存时间超过15天时,叶片接入培养基后6天,褐化明显上升。实验结果还表明,多刺绿绒蒿外植体在4℃下保存不宜超过12天;同时在本研究中,花托和生长点在培养过程中未有明显褐化现象,认为其具有诱导愈伤组织的更好潜力,并且以未受粉的成熟子房效果最好。
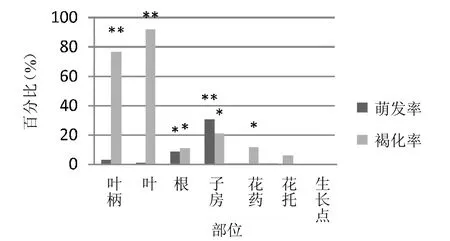
图1.不同外植体部位的褐化以及萌发情况(*p<0.05,**p<0.01)
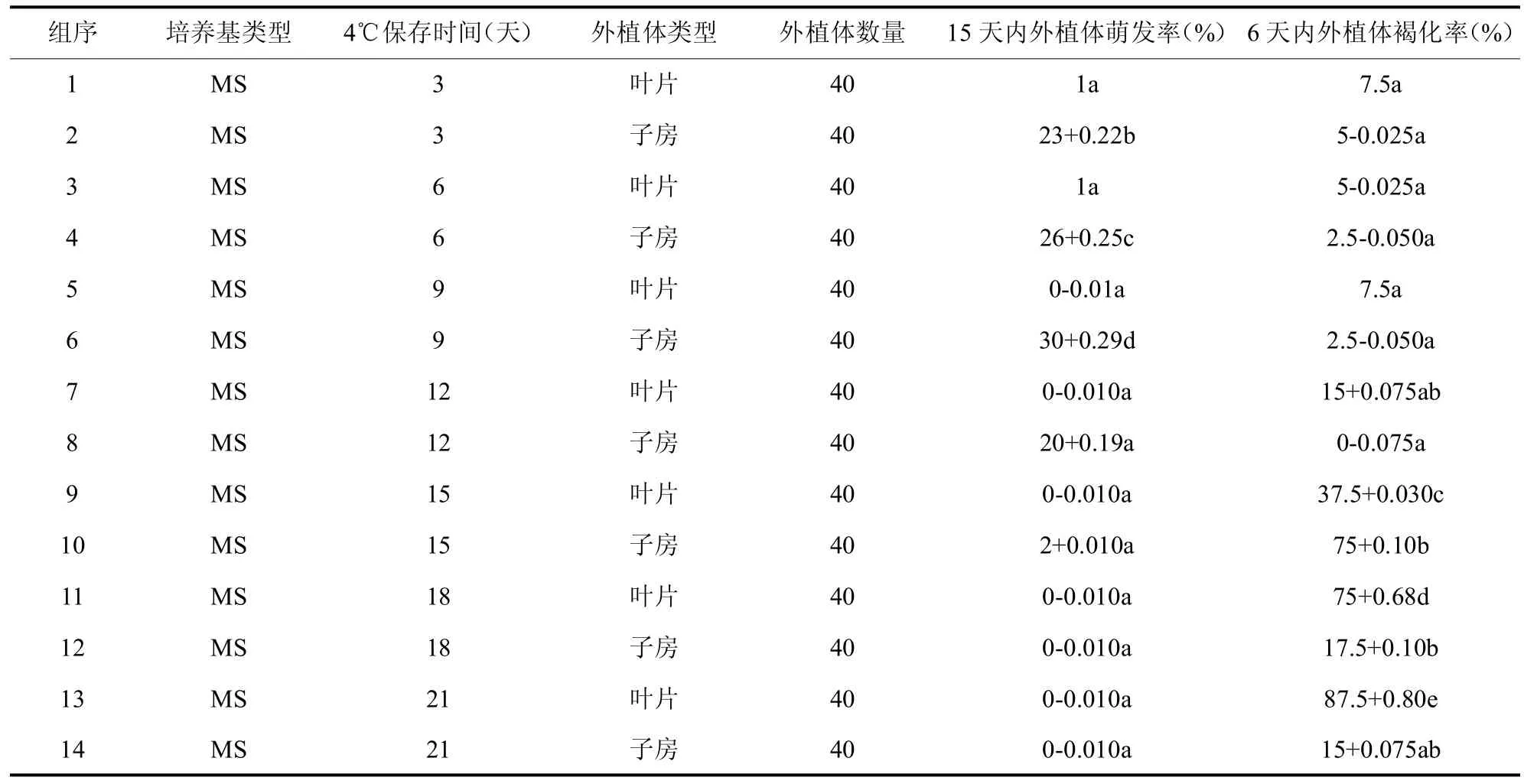
表1 在不同保存时间下的外植体褐化以及萌发情况(p<0.05)
2.1.2 不同浓度6-BA培养对外植体的影响以多刺绿绒蒿未受粉子房作为外植体,0.1mg/L NAA加不同浓度6-BA添加到MS培养基上。由表2所知,5 mg/L 6-BA培养导致外植体大量发生褐化并阻碍愈伤组织的形成,随着6-BA浓度的降低,根与子房壁的诱导率增大;当6-BA浓度为1 mg/L时可超过30%,同时子房、根以及花托的褐化率明显下降。另外,随着6-BA浓度的下降,愈伤组织质地变软同时发生膨大,可见,0.1 mg/L NAA+1.0 mg/L 6-BA为合适浓度。
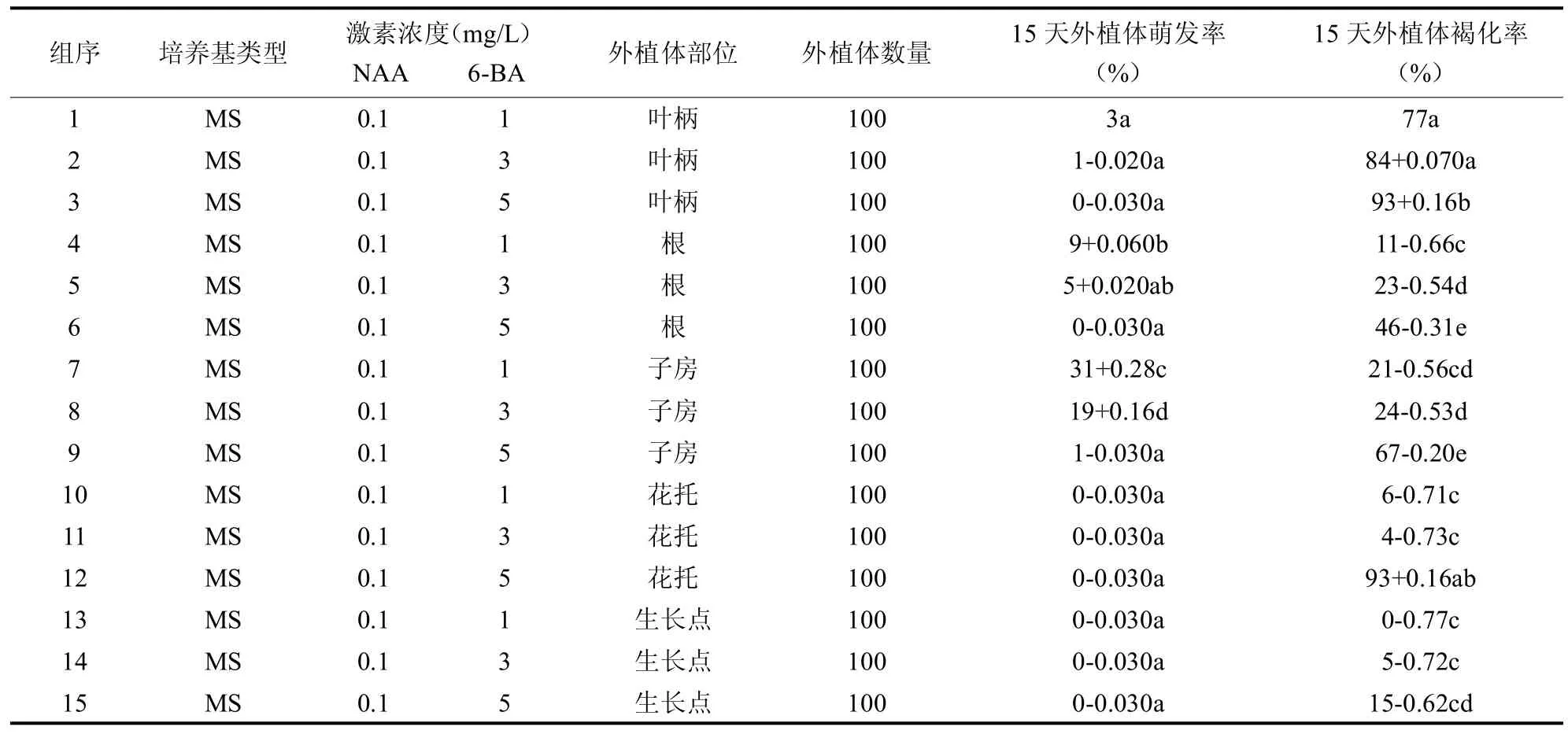
表2 不同激素浓度及不同外植体部位褐化以及萌发情况(p<0.05)
2.1.3 不同光照条件对外植体的愈伤组织诱导的影响 由图2和表3可知,在1000~1200lux全天光照培养可导致外植体褐化率明显上升,而在50~120 lux光强下培养的外植体萌发率明显高于其他条件培养。另外,1 000~1 200 lux全天光照培养6天使褐化率小幅上升,但无显著性差异,并且发现在无光条件下未有愈伤组织形成。研究结果还表明,1000~1200lux 24小时光照可导致未受粉子房褐化,以50~120 lux弱光环境有利于未受粉子房的愈伤组织诱导。
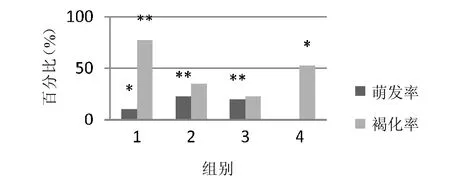
图2 不同光照对外植体的愈伤组织诱导的影响(*p<0.05,**p<0.01)
2.1.4 不同消毒方式对外植体褐化的影响 从图3和表3结果可知,幼株未去除表皮毛组中污染程度明显上升,但与去除皮刺后相比,无明显差异。使用酒精浸泡植株也导致褐化率明显升高,但与含酒精棉球擦拭相比没有明显差异。另外,消毒时间短于4分钟可使污染率上升。因此,对多刺绿绒蒿外植体的消毒方式建议去除表皮毛,使用酒精棉球擦拭,升汞处理时间以超过4分钟为宜。
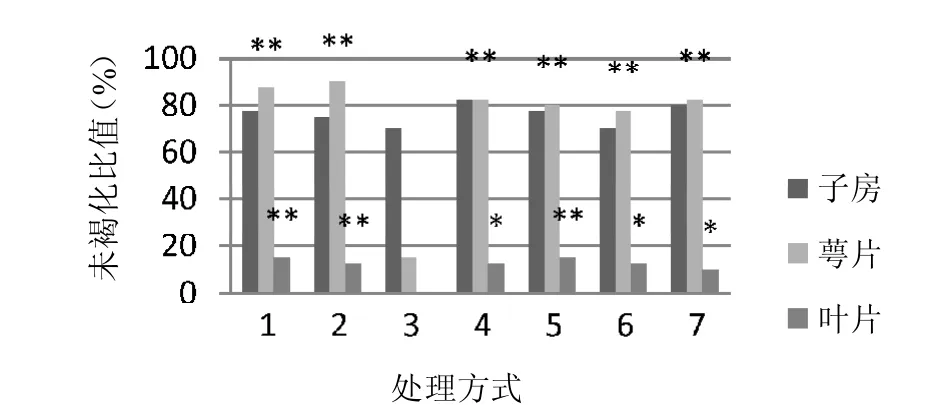
图3 不同消毒方式对外植体褐化的影响(*p<0.05,**p<0.01)

表3 培养15天外植体污染情况
2.1.5 外植体大小对外植体萌发率和褐化率的影响 在愈伤组织诱导过程中,未发现受粉的裸露子房出现萌发。愈伤组织的萌发速率受外植体大小影响,并且组织块过小明显影响到愈伤组织萌发率和褐化率,见表4和表5。根据实验结果可知,未受粉子房较为适合作为愈伤组织诱导的外植体;同时如表5结果所示,当作为外植体的子房切割大小为0.7cm×0.4cm×0.4cm时,外植体愈伤组织萌发率明显升高,可认为适当的外植体小组织块可提升愈伤组织的萌发速率。
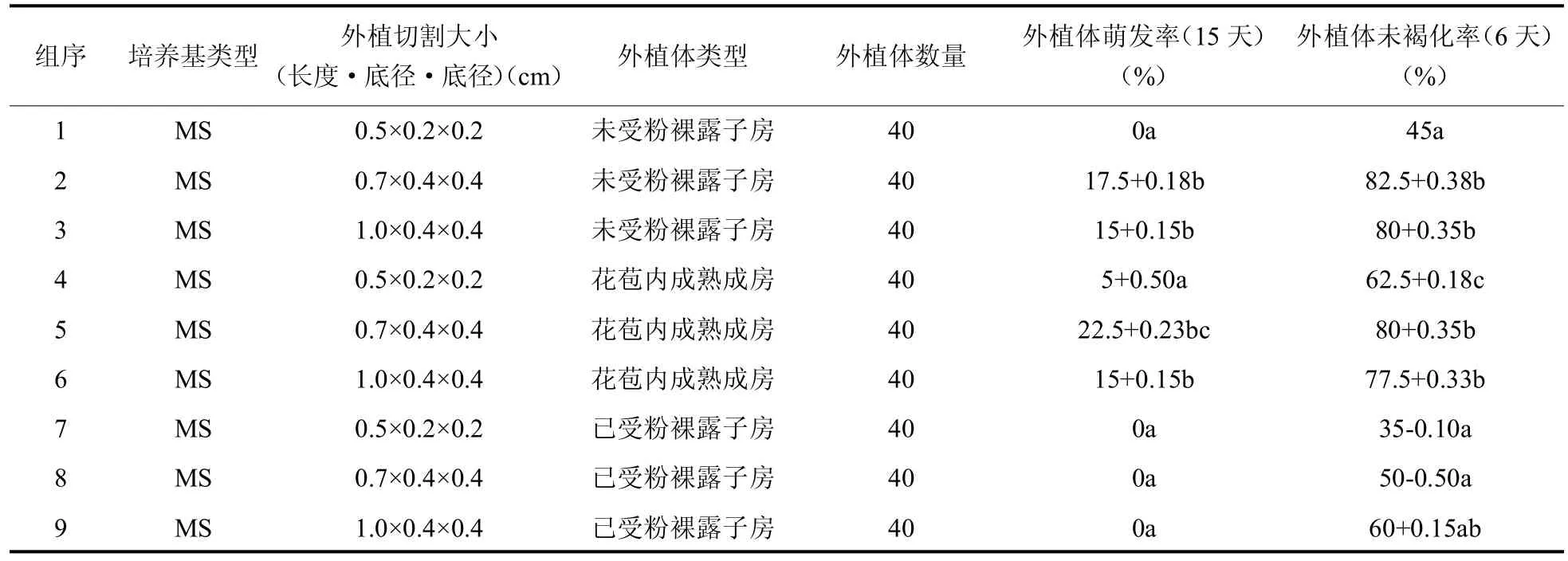
表4 外植体大小对外植体愈伤组织萌发率以及未褐化率的影响(cm,p<0.05)
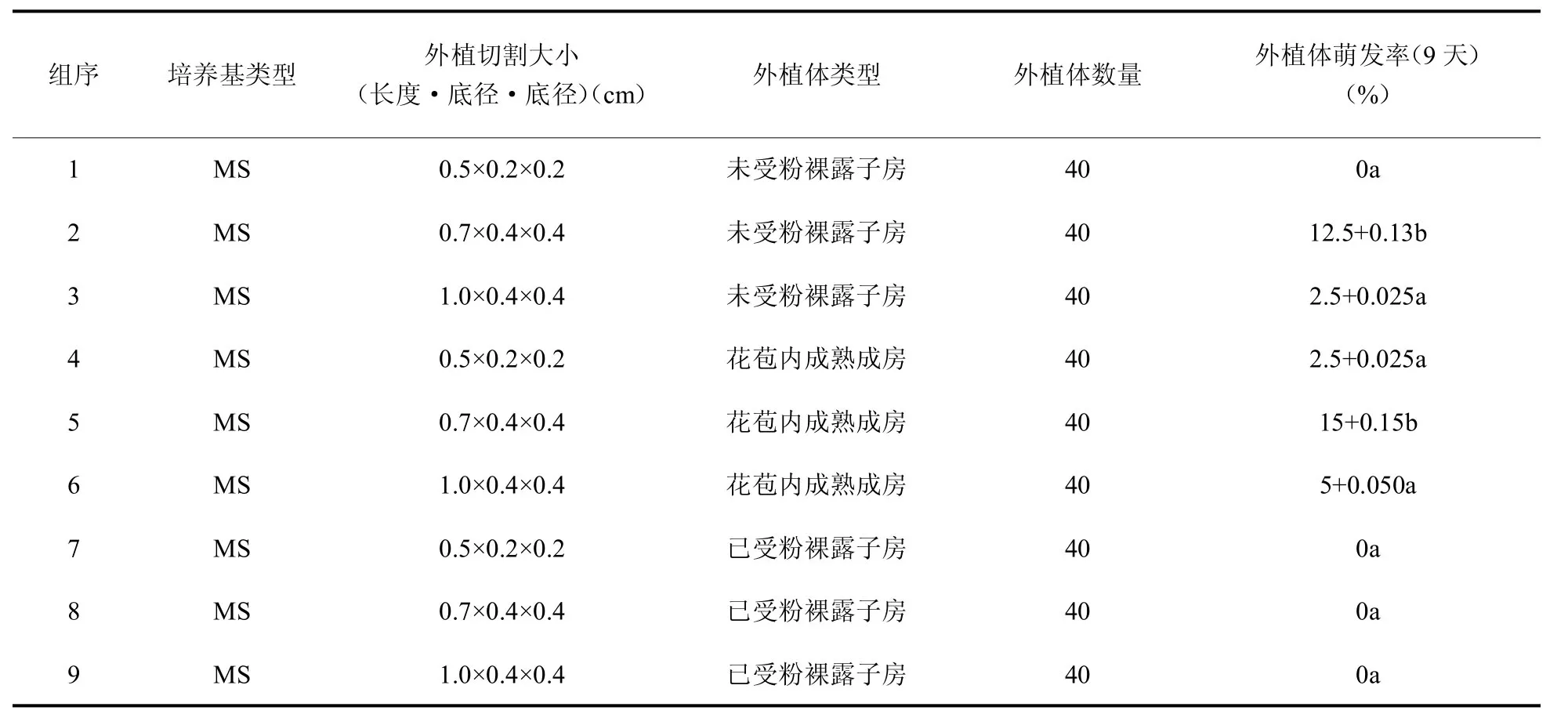
表5 外植体切割大小对外植体愈伤组织萌发速度的影响(p<0.05)
2.2 外植体继代培养与保存条件
2.2.1 继代时间 实验使用MS培养基对愈伤组织进行继代培养。研究结果见表6,确定多刺绿绒蒿未受粉子房为最适材料。研究还表明,切除子房内壁可显著降低褐化率。另外,子房与根部分别在接种后20天和15天后进行继代培养,外植体褐化率也 显著下降。可见,外植体在萌发后生长至一定大小适 合继代接种培养,并且子房胎座等结构影响到继代 培养。
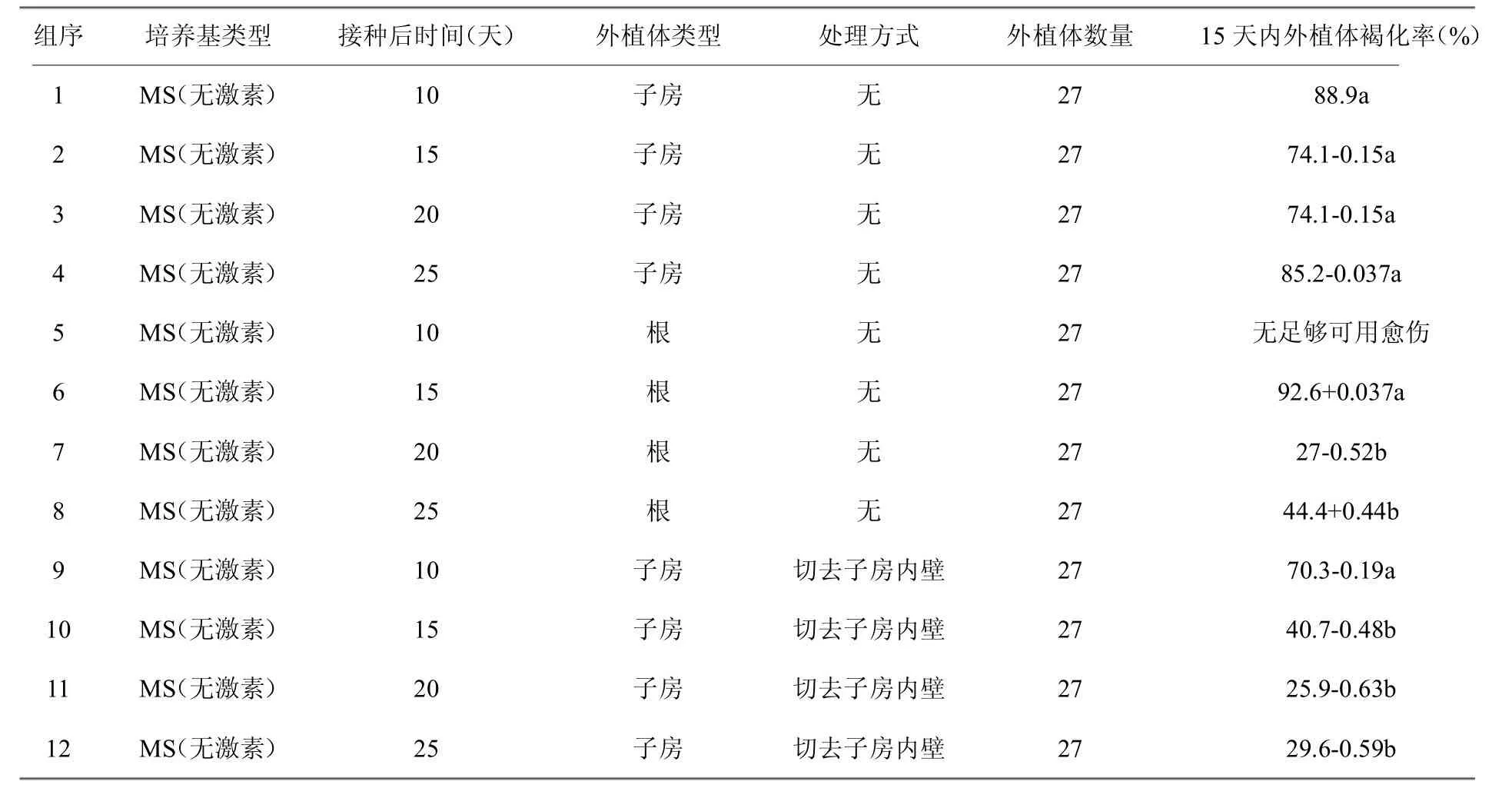
表6 外植体继代处理与时间对外植体继代后外植体褐化率影响(p<0.05)
2.2.2 外植体保存条件
结果表明,见图4。外植体在温度4℃、土壤含水量在较低湿度下(相对含水量13.5%)密封袋保存能维持外植体较长时间;伴随着温度升高,植株出现生长点/根部出现腐败,见表7,建议低温低湿度保存比较适宜。
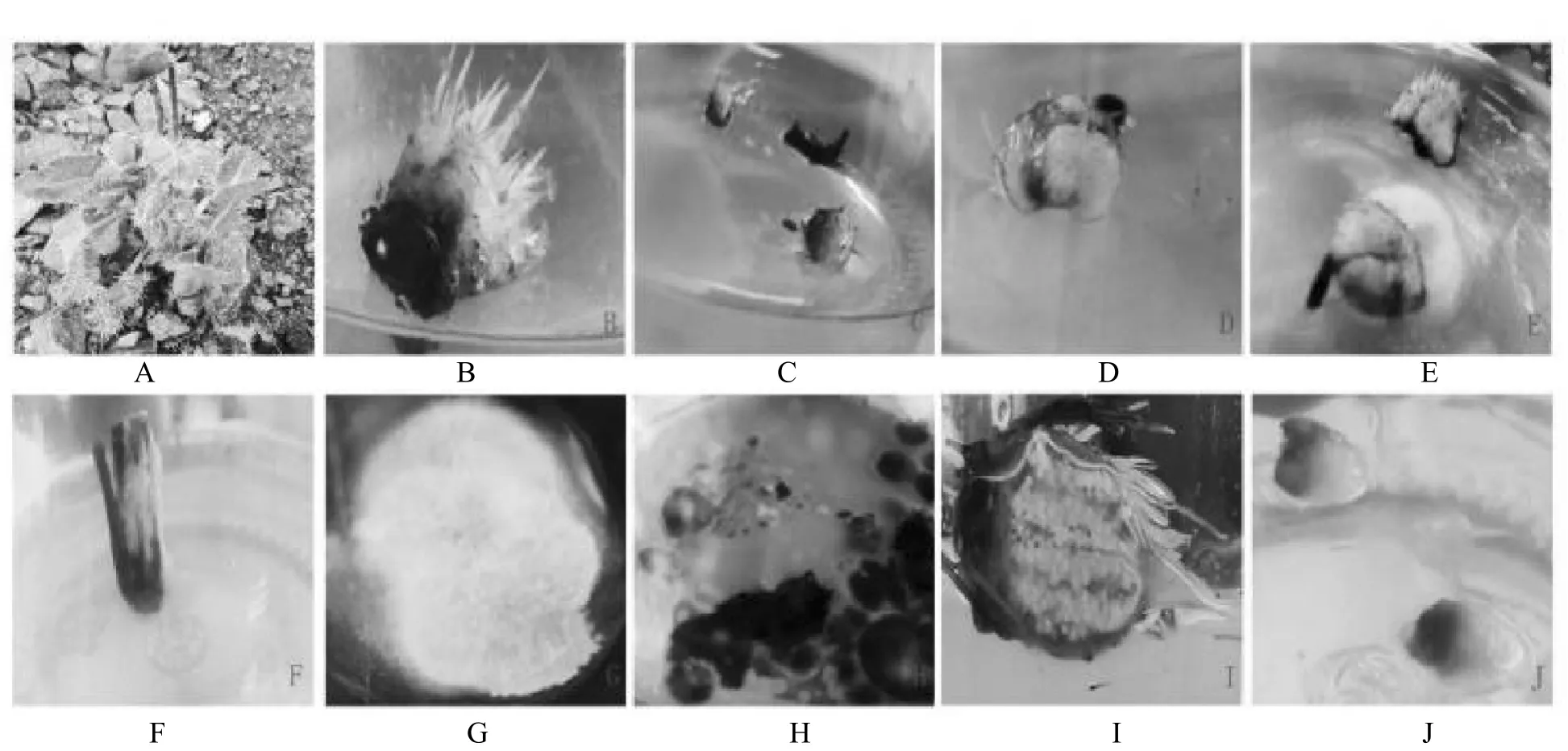
图4 外植体保存观察
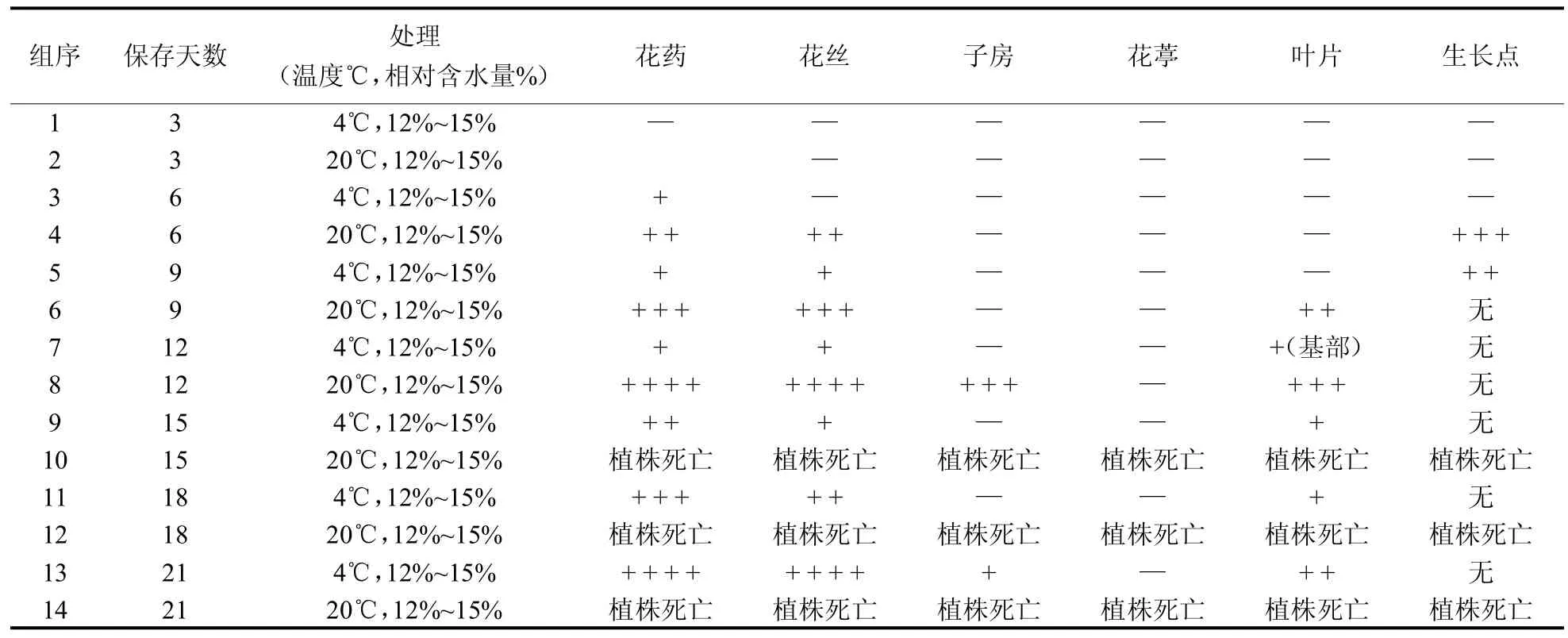
表7 外植体保存时间腐败情况
3 讨论
由于前人对于多刺绿绒蒿同属以及其同科植物研究极少,同时考虑到高原环境的特殊性以及植株部分部位具有角质层增厚等情况,根据实验现象与相关文献推测,并根据胡选萍相关综述文章中提及的外植体自身的生理结构、分化状态以及脱分化能力存在差异而导致愈伤组织的诱导率不同[9],并研究采用不同外植体,以寻找最适合此植株愈伤组织诱导的部位,筛选具有潜力诱导愈伤组织的外植体[10],确定了多刺绿绒蒿适合作为愈伤组织诱导的外植体部位为子房与根,其他位置可能为外植体生长点,但未对激素梯度以及相关的配比进行比较研究。
在本研究中发现,已受粉的子房或者放置过久的未离体子房在进行诱导过程中,子房壁未见愈伤组织萌发;经观察,受粉后子房与放置时间过长到子房内的未成熟种子均出现了不同程度的膨大且子房壁表皮毛特化为皮刺,但子房壁未出现膨大情况,并且子房壁硬化向成熟果荚发展并发生褐化。对比花苞内成熟但未受粉子房诱导情况,考虑果实在成熟过程中整个过程涉及到果实褪绿、色素积累、细胞壁代谢和细胞膨压变化以及糖、酸和挥发物的积累等过程[11],推测过长时间的冷藏导致了部分物质的积累,进而使果实向成熟方向转化。在其他研究中也有报道,刚成熟的果实不利于愈伤组织的诱导[12]。根据相关文献显示,植物在逆境情况下将导致过氧化物积累,进而部分酶系激活,过氧化物酶体在低温胁迫下呈现出活性先升高后下降的情况,活性整体上升[13];推测过长冷藏时间导致植物产生逆境响应,进而导致外植体在组织培养过程中发生褐化,同时研究表明过氧化物酶活性提高促进植株愈伤组织褐化发生[14]。至于是否子房受粉或植株离开母体后,在保存过程中激活了部分酶系,进而导致外植体活性下降,不能有效诱导愈伤组织的形成,需要进一步研究阐明。
由于多刺绿绒蒿生长地的特殊性,为适应其环境,因此,植株在诱导分化过程中需要特殊条件进行相关诱导。本研究发现,多刺绿绒蒿愈伤组织在尝试进行再分化诱导过程中,均会导致发生褐化而死亡。据文献报道,当多刺绿绒蒿种子萌发温度超过25℃时,植株萌发率大幅下降[15];其他如雪莲等具有与多刺绿绒蒿类似生境的植株的愈伤组织分化也明显受环境温度的影响[16,17]。因此,在考虑多刺绿绒蒿再分化过程中,需要进一步考虑温度等环境条件。
目前,无论是细胞生物反应器还是通过愈伤组织,均能获得类黄酮类次生代谢产物,但面临愈伤组织离体后遗传不稳定性问题,需要通过合适的继代培养获得[18,19]。本研究进行了6~8代培养后,出现了组织褐化率升高等情况。有研究表明,植株次生代谢产物产生与培养基浓度以及光质有重要的联系[20]。根据本研究结果,光照条件变化引起愈伤组织保存过程中褐化,因此,对于优化多刺绿绒蒿愈伤组织培养,进行次生代谢产物批量化生产仍有待进一步研究。
4 结论
本研究成功建立了多刺绿绒蒿完整的外植体愈伤组织诱导与继代保存的技术体系,确定激素配比为0.1mg/LNAA+1.0mg/L6-BA,保存天数不超过12天,在50~120lux下全天光照,组织块大小超过0.7cm×0.4cm×0.4cm,使用酒精棉球与0.1%升汞溶液消毒5分钟。
