Merkel细胞局部注射联合MEBO外用对大鼠足底创面神经再生的实验研究
2018-11-15魏在荣邓呈亮张文夺王达利龚飞宇
游 兴,魏在荣,陈 伟,邓呈亮,张文夺,王达利,龚飞宇
(遵义医学院附属医院 烧伤整形外科,贵州 遵义 563099)
随着机械化进程的推进,皮肤软组织缺损病例在临床上有增无减。纵使医疗技术的飞速发展,已使得创面的简单修复基本得到解决。但伤后感觉功能的重建往往比较棘手,尤其是常与外界接触的四肢创面,感觉的重获显得尤为重要,目前临床上已较成熟地应用了带感觉神经的皮瓣进行修复[1],且效果满意。但对于部分患者,因自身解剖变异或局部毁损过重,缺少甚至没有可切取带神经皮瓣的理想供区,这部分患者感觉功能的重建给临床医师提出了新的要求,局部神经再生成为了新的研究方向。以往在感觉功能重建方式上主要是针对痛、温觉的恢复,然而感觉的完美重建应该是多方面的,包括触、压、痛、温等感觉。四肢是触觉敏感部位,触觉的减退或消失明显影响患者生活质量。Merkel细胞是一种皮肤上皮细胞[2],数量很少,位于表皮、真皮交界处,和Aβ感觉神经元形成一种特殊的类似突触样的联系[3-4]。Merkel细胞存在于多数脊椎动物皮肤中的神经末梢,已有研究[5]证实,该细胞在皮肤感受轻柔触觉刺激活动中与神经末梢形成特殊结构而共同作用。本实验基于体外Merkel细胞的成功培养,结合MEBO外用为创面愈合提供的有利微环境,联合使用观察其对足底缩足反射及创面新生皮肤神经再生的影响。
1 材料与方法
1.1 实验材料 SD鼠100只(建模90只,繁殖幼鼠10只),[SPF级,许可证号:SCXK(渝)2012-0005,由陆军军医大学医学实验动物中心提供]。MEBO(美宝湿润烧伤膏,汕头市美宝制药有限公司,国药准字Z20000004)。
1.2 主要实验仪器 超净台(TDGC2J0.5,中国,上海先锋);离心机(Centrifuge 5417R,德国,Eppendorf);二氧化碳细胞培养箱(3141I/R,Thermo 美国,Scientific);显微镜及拍照系统(IX-71-S8F,日本,Olympus);超纯水系统(Milli-Q Biocel, Millipore,法国);石蜡切片机(CM3050S,Leica,德国);细胞培养板(6孔/12孔,Eppendorf,德国);细胞过滤器(中国,上海生工);以及相机、手术器械、移液器、离心管、细胞培养瓶、显微器械、无菌手套、注射器、培养皿等等。
1.3 主要实验试剂 兔抗鼠一抗CK20、山羊抗兔HRP标记的二抗、小鼠抗NF-01抗体、兔抗鼠荧光二抗(abcam,美国);重组β鼠神经生长因子(PROSPEC);抗体稀释液、胰蛋白酶、中性蛋白酶、青霉素-链霉素溶液(碧云天,中国);DAB、bFGF、中性树胶、苏木素、二甲苯(北京中杉金桥);胎牛血清、山羊血清(Gibco,美国);多聚甲醛、TritonX-100(上海生工)。
1.4 方法
1.4.1 Merkel原代细胞提取及培养 取新生的SD大鼠断头处死,75%酒精浸泡消毒5~10 min,超净工作台内解剖大鼠须垫及足底皮肤,PBS 漂洗去除附带组织及坏死细胞等杂质,将组织剪碎为1.0 cm×0.2 cm大小的细小组织块。移入50 mL的离心管中,按组织体积量(1∶4~5)中性蛋白酶(25 U/mL)室温消化1 h分离真皮和表皮。然后将表皮剪碎成大小约 1.0 mm×1.0 mm 的微小组织块,用0.25%胰蛋白酶溶液37 ℃消化30 min。完全培养基终止消化,收集消化液,以70 μm 孔径的细胞过滤器逐次过滤,1 500 rpm 上机离心11 min,去上清液,最后加入 Ham,s-F12 培养基(含10%FBS、20 ng/mL bFGF)适量,制成细胞悬液并接种于培养瓶内,放置于细胞孵箱内培养,每日观察,每2天换液1次。
1.4.2 免疫细胞化学PAP法鉴定 取原代细胞制作爬片,培养第6天取出爬片,PBS漂洗,4%多聚甲醛固定,0.5%Triton X-100和3%双氧水依次通透处理,山羊血清封闭1 h,一抗CK20(1∶70)4 ℃孵育过夜。次日取出漂洗,HRP标记的二抗(1∶70)37 ℃孵育1 h,DAB显色,苏木素复染,二甲苯透明,中性树胶封片,显微镜观察拍照记录。
1.4.3 动物模型建立及分组 建模前将大鼠置于底部带孔的透明箱内,检测前允许适应环境1 h。检测各鼠左后足缩足反射并记录缩足次数及反射情况。后麻醉固定,于左后足的底部标记直径为1 cm的圆形建模区域,术中垂直切开全层皮肤,直至皮下,妥善保护足底腱膜,切除皮肤,遗留圆形创面并彻底止血。手术部分均在无菌条件下操作。建模后将所有创面模型进行完全随机分组,采用基于Excel的随机序列发生器软件,分为5组并予相应干预:MCs+MEBO组、MCs组、MEBO组、PBS组(阴性对照)以及mNGF组(阳性对照)。设定每组每个时间点为6只大鼠,总共3个取材时间点(第7、14、 21天)。细胞则取原代培养第8天MCs,计数后终浓度为106个/mL,细胞注射点分别为创缘3、6、9、12点及基底中央共5个点,注射器选用普通微量注射器,针头选择尖头的,量程选为50 μL,每个点一次性注射同浓度的细胞悬液量体积各25 μL;阴性及阳性对照组分别以PBS、mNGF(浓度为0.1 μg/mL)等体积注射,24 h后追加注射一次,各组创面经试验干预后均用无菌纱布包扎,每日换药一次,其中用MEBO外敷的实验组用药量以完全覆盖创面为准,厚度约2 mm。
1.4.4 创面大体观察及足底行为学检测 每日换药观察创面愈合情况并拍照记录。观察实验干预后各模型足在行为状态方面的变化,包括舔舐、步态、缩足等等。于建模后的三个时间节点(7 d、14 d、21 d)以棉拭子检测模型足足底的缩足反应情况。每只大鼠每个时间点共进行5次,间隔10 s以上,统计建模干预后第7、14、21天三个时间点的各大鼠缩足次数,记录并计算其百分比(缩足百分比=缩足次数/总刺激次数×100/100)。纵向比较第7、14、21天缩足次数有无增加,横向比较各处理组在同一时相缩足次数有无差别。
1.4.5 免疫荧光染色检测皮肤神经再生 在动物模型建立后的第7、14、21天三个时间点,每个组提取6只实验大鼠,先行行为学检测,后麻醉固定取材,取材时深度以切取新生皮肤组织、保留足底腱膜为准,取得标本用多聚甲醛固定,石蜡包埋,后垂直于皮肤表面连续切片,切片厚约5 μm,以载玻片捞片。常规脱蜡至水,漂洗后胎牛血清封闭1 h,滴加小鼠抗NF-01抗体(浓度1∶500),4 ℃过夜。次日取出漂洗,滴加FITC标记的兔抗鼠二抗工作液(1∶1 000),避光孵育1 h,漂洗,抗荧光淬灭剂封片,拍照记录。

2 结果
2.1 SD大鼠MCs的原代培养 从细胞提取及培养来看,用中性蛋白酶和胰蛋白酶双酶消化法能有效提取MCs。细胞增长较快,24 h即可见大量的细胞贴壁生长,贴壁生长细胞多呈不规则形或者多角形,其包膜可见“突触”状生长,并在换液过程中逐渐得到纯化(见图1)。

A:×100;B:×200;C:×400。 图1 Merkel细胞的原代培养及形态学观察
2.2 MCs的免疫细胞化学染色 鉴定免疫细胞化学染色,以抗体CK20标记培养的细胞,细胞被染成棕黄色视为阳性反应。实验结果见实验组棕染色细胞数量较多,且形态多样,有多角形及不规则形等。对照组则未见明显棕黄色结果出现(见图2),说明培养细胞为目标Merkel细胞。
2.3 创面大体观察 实验中各组大鼠足底创面均无感染发生。建模最初24 h内创面周围水肿较为明显。在建模后第3天,各组模型鼠足底创面开始向心性回缩,其中应用MEBO外敷处理组基底湿润,持续观察,基底创面肉芽生长较好。到建模处理后第7天时各组创面缩小程度更加明显,MCs+MEBO组及MEBO组较其他处理组缩小幅度更多,水肿均已消退,创面开始结痂,新生皮肤自创缘往创面中心爬行呈现收缩性生长。等到建模第14天时, MEBO处理组创面接近完全愈合,而其他处理组也不同程度愈合。到建 模后第21天时各模型创面均完全愈合(见图3)。
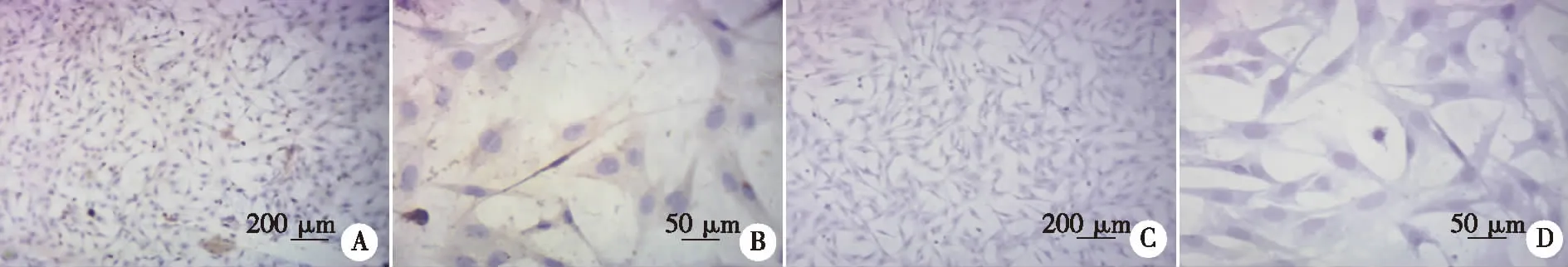
实验组(A:×100;B:×400);对照组(C:×100;D:×400)。 图2 Merkel细胞免疫细胞化学染色

图3 各组创面不同时间点大体愈合情况观察
2.4 建模后创面愈合时间的比较 在各模型创面的愈合时间的比较上,MCs+MEBO组、MCs 组、MEBO 组以及mNGF组(阳性对照)明显早于PBS组,MCs+MEBO组和MEBO组早于其他3组,其中又以MCs+MEBO组愈合最快。(P<0.05,见表1)。
2.5 大鼠行为学改变 大鼠足底创面模型建立后各组大鼠在精神状态、进食量和日常活跃程度上均无明显的差异,但建模侧均出现左后足(模型足)跛行甚至悬空,部分还出现缩足舔舐等行为;在缩足反应百分比的比较上,MCs+MEBO组优于MCs组、MEBO组、PBS组),与mNGF组相近(见表2)。
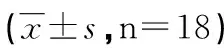

组别创面数创面愈合时间(d)MCs+MEBO1814.33±0.69▲MCs1816.44±0.86▲△MEBO1814.83±0.71▲△PBS1817.44±0.98△mNGF1816.27±0.67▲
与PBS组比较▲:P<0.05;与MCs+MEBO组比较△:P<0.05。
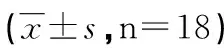

组别缩足反应(%)7 d14 d21 dMCs+MEBO23.33±8.1633.33±10.32**66.66±10.32▲MCs16.66±8.16*26.66±10.32**53.33±10.32▲MEBO16.66±8.16*26.66±10.32**43.33±8.16PBS16.66±8.16*23.33±8.16**36.66±8.16mNGF26.66±10.3246.66±10.3270.00±10.95
与同时间点mNGF组比较*:P<0.05,**:P<0.05。与同时间点PBS组比较,△:P<0.05。
2.6 免疫荧光检测足底新生皮肤神经再生 各组实验标本行石蜡切片后用免疫荧光染色显示:MCs+MEBO组在第7天时有少量紊乱的、散在的神经纤维丝;到第14天时从形态学上看神经纤维丝的数量开始增多、直径逐渐增大,但是神经纤维丝排列仍然杂乱,多数是呈粗短状;等到实验第21天时,观察MCs+MEB组的神经纤维丝在数量上多于该组第14天时的神经纤维丝数量,排列也开始逐渐变得有序。MCs+MEBO组在各观察时相点的神经纤维丝数量及直径均与mNGF组相近。单用MCs组在创面愈合的早期并未明显神经纤维丝再生,但到建模后的第21天切片观察,可见少量神经纤维丝阳性染色出现;然而单用MEBO组、PBS组在实验的观察时间内无明显神经纤维丝阳性染色的出现,仅偶见杂乱纤细的疑似神经丝纤维状染色出现(见图4)。

×200,箭头指示神经纤维。 图4 各实验组3个时间点神经纤维再生情况
3 讨论
临床上皮肤软组织缺损的病例较为常见,尤其在四肢功能部位,皮肤软组织缺损对患者影响较大,主要有局部功能的缺失,外观的缺陷,经久不愈的创面甚至可能发生癌变等。随着临床上各类皮瓣的成功应用,创面的简单修复已不再是难题,真正难为整形外科医师的,是创面愈合后局部神经功能的重获。四肢是最常与外界接触的部位,同时肢端更是触觉的敏感部位,这些特殊部位在创面愈合后神经功能的重塑对患者就显得尤为重要。既往临床上对四肢创面感觉功能的重建主要是恢复其痛觉及温度觉,如随皮瓣一起的自体神经远位游离移植[6]、邻近神经转位移植[7]等;实验研究中有雪旺氏细胞[8]、脂肪干细胞[9-10]移植以及神经生长因子和碱性成纤维细胞生长因子应用[11-13]等促进神经再生。但在触觉功能重建或再生方面鲜有体内实验报道。
Merkel细胞是位于表皮基底的一种树突状细胞,它与皮肤中的神经末梢形成类似于解剖学上的“突触联系”[14-15],该细胞与神经末梢一起,作为一个“功能体”,主要参与轻柔触觉刺激信号的传导,在人类的指腹、嘴唇以及其他脊椎动物的毛囊等部位较为多见[16-17]。已有学者[18]设计实验证实Merkel细胞内Piezo2离子通道和Ca2+动作电位是形成触觉反射的先决条件,这一研究结果为创面触觉的恢复提供了理论依据,对探索触觉功能的恢复或神经的完美再生提供了新的可能性。神经再生后可分泌多种内分泌物质,神经肽P物质就是其中一种,可反作用于受伤创面,加速创面愈合[19-20]。创面的有效愈合为神经再生提供空间,两者相互促进。MEBO是以蜂蜡加麻油为基质的一种中草药膏,用于创面主要是起到隔绝的作用,使得创面与外界不直接接触从而降低感染率,除此之外还有增强局部抗感染的能力。有研究指出,MEBO促进创面的愈合过程极为复杂,除了提供再生愈合局部微环境还提供某些促生长物质,创面愈合中有双向调节作用[21],早期可以促使创面“生肌”,晚期尚可抑制胶原蛋白的过度沉积及细胞增殖,从而有效地防止创面增生性瘢痕的形成。纵使MEBO在创面修复方面报道甚多,但在创面神经再生方面的相关基础研究却也罕见。
本实验从设计到完成,各个环节均在国内外创面神经再生相关研究的基础上进行。实验通过SD大鼠足底机械创面模型,用乳鼠提取的原代默克尔细胞局部注射,联合MEBO湿润烧伤膏外敷换药,利用MEBO的提供的“局部微环境”为创面的愈合过程保驾护航,并以此观察大鼠足底创面的愈合及创面神经再生情况。从实验结果可以看出MCs+MEBO组及MEBO组在创面愈合的时间上均优于其他实验组,这两组在实验的第14天时都已基本愈合,愈合率明显高于其他各实验组。在建模后的第7、 14、21天三个时间点实验组的创面愈合率高于对照组,又以MCs+MEBO组愈合率最高。在缩足反射对比上,MCs+MEBO组缩足反射幅度及缩足百分比均明显强于其他各组。从免疫荧光结果分析创面皮肤神经再生情况,MCs+MEBO组明显优于MCs组、MEBO组及PBS组,与mNGF组(阳性对照组)相近。从整个实验结果分析可以得出,Merkel细胞局部注射联合MEBO外用可促进大鼠足底创面皮肤神经的再生。
